Qu’est-ce que le cobalt
Le cobalt (prononciation : KO-bolt) est un élément bleu argenté dur et lustré appartenant au groupe des métaux de transition, et il est représenté par le symbole chimique Co . Il est chimiquement actif et peut former de nombreux composés. C’est un métal ferromagnétique qui peut être magnétisé et qui est allié au nickel et à l’aluminium pour produire des aimants puissants .

Symbole du cobalt
Isotopes
Il possède un isotope naturel stable, le 59Co et 28 radio-isotopes dont les plus stables sont le 60Co, le 57Co, le 56Co et le 58Co avec des demi-vies respectives de 5,2714 ans, 271,8 jours, 77,27 jours et 70,86 jours . Les périodes de demi-vie de ses autres radio-isotopes sont inférieures à 18 heures .
Où se trouve le cobalt
Le cobalt se trouve naturellement en combinaison avec d’autres éléments dans les minerais comme la cobaltite (un sulfure contenant du cobalt, de l’arsenic, du fer et du nickel), l’érythrite (arséniate de cobalt hydraté) et la skutterudite (arséniate de cobalt) . Il est généralement obtenu comme sous-produit de l’exploitation minière du cuivre et du nickel .
Les nodules de manganèse trouvés au fond des océans sont d’énormes réserves de métaux de transition, contenant des tonnes de cobalt . Les 3 principaux pays détenteurs de réserves de cobalt sont la République démocratique du Congo (RDC), l’Australie et Cuba tandis que les 3 principaux producteurs sont la RDC, la Chine et la Zambie .

Cobalt
Histoire
Origine de son nom : Le nom est dérivé de « kobald », mot allemand signifiant « gobelin » et de « cobalos », mot grec signifiant « mine » .
Qui l’a découvert : L’élément a été trouvé par le chimiste et minéralogiste suédois Georg Brandt .
Quand et comment a-t-il été découvert
La tombe de Toutankhamon, l’ancien pharaon égyptien qui a régné pendant 1361-1352 avant JC, avait un objet en verre bleu profond qui était fait de cobalt . En Chine, le bleu de cobalt était utilisé pour fabriquer des glaçures de poterie .
A part ses origines anciennes, sa découverte dans les temps récents remonte aux années 1730 lorsque Georg Brandt s’est intéressé à un minerai bleu provenant de certaines mines locales . Finalement, il réussit à prouver que le minerai bleu contenait un nouveau métal . Il a décrit ses propriétés et a publié les résultats en 1739 .
Sa découverte était controversée, car d’autres chimistes ont contesté ses résultats pendant de nombreuses années . Cependant, son collègue chimiste suédois Torbern Bergman a mené des études supplémentaires et a confirmé la découverte de Georg Brandt en 1780 .
Identification du cobalt |
|||
| Numéro atomique | 27 | ||
| Numéro CAS | 7440-48-.4 | ||
| Position dans le tableau périodique | Groupe | Période | Bloc |
| 9 | 4 | d | |
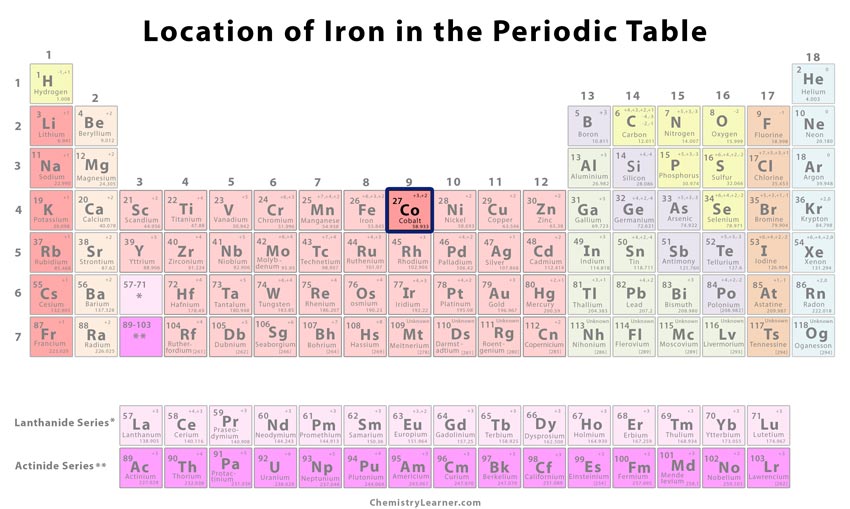
Où se situe le cobalt ? se trouve le cobalt dans le tableau périodique
Propriétés et caractéristiques du cobalt
Propriétés générales |
||||||||||||||||
| Masse atomique relative | 58.933 | |||||||||||||||
| Masse atomique | 58,933 amu | |||||||||||||||
| Masse molaire | 58,9331950 ± 0,0000050 g/mol | |||||||||||||||
| Poids moléculaire | 58.933 g/mol | |||||||||||||||
Propriétés physiques |
||||||||||||||||
| Couleur | Bleu argenté, blanc bleuté | |||||||||||||||
| Point de fusion/point de congélation | 1495 °C, 2723 °F | |||||||||||||||
| Point d’ébullition | 2927 °C, 5301 °F | |||||||||||||||
| Densité | 8.86 g cm-3 | |||||||||||||||
| État de la matière à température ambiante (solide/liquide/gaz) | Solide | |||||||||||||||
| Dureté | ||||||||||||||||
| – Brinell | 700 MPa | |||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Conductivité électrique | 1.7 X 107 S/m | |||||||||||||||
| Charge ionique | 3+ | |||||||||||||||
| Conductivité thermique | 100 W/(m K) | |||||||||||||||
| Chaleur spécifique | 421 J kg-1 K-1 | |||||||||||||||
| Module de masse | Inconnu | |||||||||||||||
| Module de cisaillement | Inconnu | |||||||||||||||
| Module de Young | Inconnu | |||||||||||||||
| Pression de vapeur | ||||||||||||||||
| – Température (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Pression (Pa) | – | – | – | 2.09 X 10-10 | 1,00 X 10-6 | 4,19 X 10-4 | 0,0379 | 1.15 | 16 | – | – | |||||
Propriétés chimiques |
||||||||||||||||
| États d’oxydation | 3, 2, 0, -1 | |||||||||||||||
| Isotopes | Isotope | Masse | Abondance (%) | Durée de vie | Mode de désintégration | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
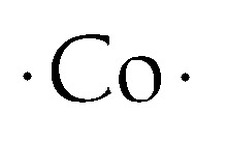
Structure du point de Lewis du cobalt
Données atomiques du cobalt (élément 27)
| Électrons de valence | 9 | |||||||
| Nombres quantiques | ||||||||
| – n | 3 | |||||||
| – ℓ | 2 | |||||||
| – mℓ | -1 | |||||||
| – ms | -1/2 | |||||||
| Configuration des électrons (configuration des gaz rares) | 3d74s2 | |||||||
| Structure atomique | ||||||||
| – Nombre d’électrons | 27 | |||||||
| – Nombre de neutrons | 32 | |||||||
| – Nombre de protons | 27 | |||||||
| Radius de l’atome | ||||||||
| – Rayon atomique | 2.00 Å | |||||||
| – Rayon covalent | 1,18 Å | |||||||
| Electronégativité (échelle de Pauling) | 1,88 | |||||||
| Affinité électronique | 63.873 kJ mol-1 | |||||||
| Énergie d’ionisation (kJ mol-1) | 1e | 2e | 3e | 4e | 5e | 6e | 7e | 8e |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |
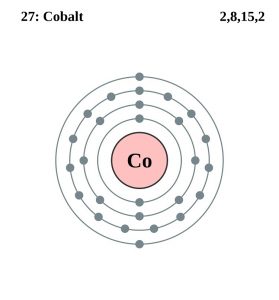
Configuration des électrons du cobalt (modèle de Bohr)
À quoi sert le cobalt
- Le cobalt est allié pour être utilisé dans les générateurs de turbines à gaz et les turbines à réaction en raison de sa résistance à haute température et à la corrosion .
- Le cobalt est occasionnellement utilisé en galvanoplastie en raison de sa dureté et de son aspect attrayant .
- Il est couramment utilisé comme matériau de cathode dans les batteries lithium-ion .
- Les sels de cobalt sont utilisés pour conférer des couleurs bleues intenses au verre, à la porcelaine, à la poterie, aux émaux et à la peinture .
- Le 60Co radioactif est utilisé pour traiter le cancer, et dans l’irradiation des aliments pour contrôler les agents pathogènes et prolonger la durée de conservation .
- Les superalliages de stellite, composés de chrome, de cobalt et de tungstène, sont utilisés pour fabriquer des outils de coupe résistant aux hautes températures et à l’usure .
Toxicité du cobalt et effets sur la santé
L’empoisonnement au cobalt peut se produire lorsque vous l’ingérez, le respirez ou le mettez accidentellement en contact avec la peau en grandes quantités . En grandes quantités, le cobalt peut être cancérigène chez l’homme et certains animaux .
Il est présent à l’état de traces chez l’homme et est un composant essentiel de la vitamine B12 . De petites doses de cobalt sont également administrées à certains animaux pour prévenir les carences minérales chez eux .

Minéral cobalt (cobaltite)
Faits intéressants
- Le cobalt est représenté graphiquement par un « kobold » ou gobelin (considéré comme gênant par les mineurs allemands médiévaux) avec de la porcelaine chinoise en arrière-plan, en référence à son utilisation comme glaçure pour la poterie dans la Chine ancienne .
- Le cobalt peut conserver ses propriétés magnétiques jusqu’à une température (point de Curie) de 1 121 °C (2049.8 °F), la plus élevée de tous les éléments ferromagnétiques .
- En 2010, des scientifiques allemands ont utilisé un atome de cobalt pour capturer les premières images de changement de spin .
Prix du cobalt
Le coût du cobalt pur est d’environ 0,21 $ par gramme, et en vrac, il coûte environ 0.044 $ par gramme .
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm