L’espace interpalpébral de la conjonctive développe fréquemment des modifications tissulaires irrégulières qui sont, la plupart du temps, peu pathologiques ou pas du tout pathologiques. Cet endroit est exposé aux rayons ultraviolets (UV) et aux irritants atmosphériques et est sensible à la sécheresse ; ainsi, les lésions telles que les pingueculae et les ptérygies sont des irrégularités de la surface oculaire couramment rencontrées et attirent généralement une attention minime à l’examen.
La maladie néoplasique squameuse, cependant, est occasionnellement rencontrée. Le carcinome spinocellulaire conjonctival invasif est souvent précédé histologiquement par un néoplasme intraépithélial conjonctival (CIN), qui représente la croissance néoplasique conjonctivale la plus fréquemment rencontrée. Ces lésions – souvent diagnostiquées à tort comme des excroissances plus typiques de la surface oculaire – sont lentement progressives, localement invasives et sans potentiel métastatique. Cependant, elles peuvent occasionnellement causer des dommages locaux importants à la surface oculaire et évoluer vers un carcinome épidermoïde plus invasif. Le diagnostic et le traitement des CIN peuvent être difficiles. Cet article offre des perspectives aux OD qui ne rencontrent peut-être pas trop souvent des CIN et qui souhaitent avoir un aperçu clinique.
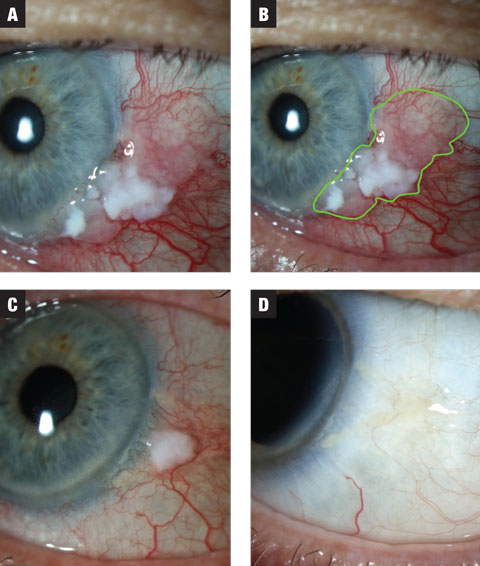
Fig. 1a. Dans le cas 1, la lésion présente à la fois des zones leucoplasiques et gélatineuses. Le traitement a été initié au MMC 0,02% QID. Fig. 1b. Estimation de l’étendue de la lésion mise en évidence. Fig. 1c. Après le premier traitement de trois semaines, la lésion présente une réduction spectaculaire de sa taille. La patiente a été placée en période de lavage de deux semaines et a reçu l’instruction d’anticiper un second traitement de MMC. Fig. 1d. La lésion a complètement disparu après la période d’élimination. Cliquez sur l’image pour l’agrandir.
Développement du CIN
La genèse d’une population de cellules épithéliales cancéreuses, ou carcinome, nécessite une série de modifications du comportement des cellules. Les cellules qui présentent cette dysplasie montrent une croissance et une maturation désorganisées, résultant en une surabondance de cellules immatures qui est contrastée par une relative rareté concomitante de cellules matures de cette lignée. Bien que la dysplasie soit un processus réversible, les cellules dysplasiques peuvent ensuite subir d’autres mutations, entraînant une transformation néoplasique, par laquelle les cellules deviennent insensibles aux inhibiteurs de croissance et deviennent invasives.
Les carcinomes néoplasiques peuvent être localement confinés par la membrane basale – connus sous le nom de carcinome in situ – ou peuvent être invasifs, caractérisés par la lésion qui traverse la membrane basale respective et se propage localement. Cette classification, cependant, ne fait pas référence à deux entités distinctes ; le carcinome in situ représente plutôt une étape préliminaire dans le même continuum de néoplasie. S’il est laissé seul, le carcinome in situ peut éventuellement devenir invasif.
Bien qu’il soit possible pour un carcinome spinocellulaire de sauter l’étape de la CIN, celle-ci constitue fréquemment le point médian de l’étiologie de la maladie. La CIN est une ligne anormale de cellules épithéliales conjonctivales (et éventuellement cornéennes) et représente soit une simple dysplasie (épaisseur partielle du tissu épithélial), soit un carcinome in situ lorsque la lésion est de pleine épaisseur.1-4 La CIN fait partie du spectre des troubles néoplasiques de la conjonctive et de la cornée connus collectivement sous le nom de néoplasie malpighienne de la surface oculaire (NSMO). Si la CIN devient invasive en perçant la membrane basale, elle est reclassée en carcinome spinocellulaire invasif (CSC).
Bien que peu fréquente, la CIN est le néoplasme conjonctival le plus fréquemment rencontré aux Etats-Unis.4 Les facteurs de risque de développement de la CIN, et de toutes les formes d’OSSN, sont l’exposition aux UV (en particulier les UV-B), le sexe masculin, l’exposition aux produits pétroliers, la fumée de tabac intense, le virus de l’immunodéficience humaine (VIH) et le papillomavirus humain (HPV) de type 16, bien que ce dernier risque reste controversé.1,3-5 Le pronostic de la CIN est généralement bon, sauf dans les cas où la croissance est anormalement importante. Une fois que la lésion brise la membrane basale et devient invasive, le pronostic est moins bon et appelle souvent un traitement agressif comme l’énucléation ou l’extenération. Même dans ces cas, le risque de métastase à distance est faible.
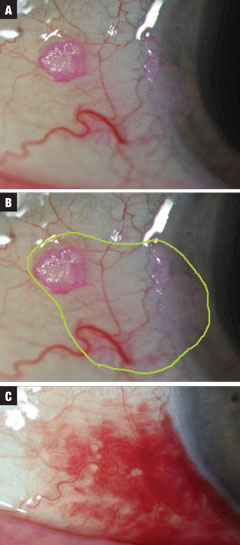
Figs. 2a-c (de haut en bas). Le cas 2 concernait une petite lésion suspecte de CIN découverte fortuitement à l’examen. Le traitement a été initié à l’INF-a2b QID jusqu’à ce que le flacon de 10mL soit vide. L’étendue totale estimée des marges néoplasiques est surlignée en vert. Finalement, une résolution a été observée, avec une PPB concomitante liée au valsalva (non induite par les médicaments). Le traitement a nécessité un mois à un million d’UI QID, puis 10 jours QID à trois millions d’UI d’INF-a2b. Cliquez sur l’image pour l’agrandir.
Présentation clinique
L’aspect clinique de la CIN est celui d’une masse charnue anormale, légèrement élevée, typiquement située au niveau de la zone limbique interpalpébrale (95% de toutes les lésions).6 La prédilection pour cette zone est probablement due à ses caractéristiques. La prédilection pour cette zone est probablement due à ses caractéristiques. L’exposition aux UV-B est plus importante dans la zone interpalpébrale, et la zone des cellules souches du limbe est un espace de transition entre l’épithélium cornéen et conjonctival. Cette zone de transition confère probablement un risque particulier au tissu de subir une dysplasie.
Les lésions conjonctivales peuvent être gélatineuses, papillaires ou, plus rarement, leucoplasiques, qui surviennent à la suite d’une hyperkératose. Ces lésions sont généralement bien définies et présentent un certain degré de vascularisation nourricière.3,7,8 Dans 95 % des cas, le limbe est touché.6 Les manifestations cornéennes présentent un blanchiment similaire et peuvent présenter des projections épithéliales grises et fimbriées (c’est-à-dire en forme de doigts) à partir du limbe. Classiquement, les lésions présentent une coloration positive ou des pointillés au rose bengale, ce qui peut être utile pour différencier cliniquement la CIN des autres lésions conjonctivales.8,9
Malgré des résultats relativement importants sur le papier, les lésions de CIN et de SCC peuvent être difficiles à différencier des excroissances plus normales de la conjonctive, telles que les pingueculae, les ptérygies et les naevus. Cela peut conduire à un mauvais diagnostic dans jusqu’à 60 % des cas, même lorsqu’ils sont évalués par des cliniciens expérimentés, ce qui rend la biopsie avec évaluation histologique potentiellement précieuse.3
Tests diagnostiques
Historiquement, les tests comprenaient une biopsie d’excision réalisée au moment de l’ablation chirurgicale. Cependant, les médecins utilisent maintenant la chimiothérapie comme modalité de traitement primaire, ce qui peut limiter l’accès à la biopsie.
Un outil de diagnostic plus récent est la cytologie d’impression, qui est réalisée en appliquant un papier filtre sur la lésion, enlevant l’épithélium superficiel et permettant des études histologiques peu invasives. Sa sensibilité est d’environ 80 %, bien que les faux négatifs restent sa faiblesse, car le papier collecteur peut être bloqué par l’excès de kératose de la lésion ; des tentatives répétées sont généralement plus fructueuses8. Une étude montre que l’OCT à ultra-haute résolution, bien que non disponible actuellement, est très sensible dans la différenciation de l’OSSN et du ptérygion sur la base de l’épaisseur épithéliale de la lésion.10
Traitement
Le traitement traditionnel de la CIN est l’excision avec des marges de 1mm à 5mm, selon l’étendue et l’historique des lésions primaires et récurrentes. L’atteinte cornéenne est débridée à l’aide d’une lame chirurgicale, et la cryothérapie est appliquée au lit et aux bords conjonctivaux. La sclérotique est laissée à nu. L’opération est généralement réussie, mais les récidives sont signalées entre 10 % et 52 %, selon le taux de marges chirurgicales nettes déterminé par l’histologie postopératoire.6-11 Le taux tombe à 5 % si les marges sont nettes ; malheureusement, les études montrent qu’il est difficile de garantir des marges nettes.8,9 Ces chiffres semblent plaider en faveur de l’utilisation des marges les plus larges possibles ; cependant, l’excision conjonctivale extensive a des conséquences : modifications cicatricielles, déficit en cellules souches limbiques, fonte sclérale, perturbation importante du film lacrymal et modifications irrégulières de l’astigmatisme cornéen.
Options topiques
Plus récemment, les chimiothérapies topiques sont devenues populaires pour gérer la CIN, car elles ont l’avantage de traiter toute la surface oculaire et, lorsqu’elles sont utilisées judicieusement, semblent être bien tolérées.
Mitomycine. Découvertes dans les années 1950, les mitomycines sont des sous-produits de fermentation de Streptomyces caespitosus. La mitomycine-C (MMC), la dernière de ces molécules découverte, est un antimétabolite utilisé en dehors de l’ophtalmologie comme agent de chimiothérapie antitumorale.12,13 La MMC fonctionne comme un agent alkylant qui empêche la scission de l’ADN pendant la mitose cellulaire, une altération extrêmement toxique.1 Une seule de ces liaisons croisées peut être fatale à une cellule.13 De plus, la MMC peut générer des espèces réactives de l’oxygène et augmenter la synthèse du facteur de nécrose tumorale (TNF).
Bien qu’elle trouve ses racines dans l’oncologie, l’utilisation de la MMC s’est généralisée, notamment au sein des soins ophtalmologiques, pour tenter de limiter la formation excessive de cicatrices postopératoires. Les optométristes qui prennent en charge des patients en chirurgie connaissent peut-être son utilisation peropératoire pour prévenir la formation de cicatrices chez les patients ayant subi une procédure de filtrage du glaucome et son utilisation dans le cadre de la PRK pour prévenir le voile cornéen. Depuis sa première utilisation associée à l’OSSN au milieu des années 1990, la MMC s’est avérée efficace, avec des taux de réussite compris entre 82 % et 100 %. Le dosage est généralement une concentration de 0,04% administrée QID dans des cycles d’une semaine sur, une semaine hors, ou une concentration de 0,02% est dosée en continu dans des traitements de quatre semaines.4 La toxicité du médicament est plus grande avec des traitements prolongés ou des concentrations plus élevées
Comme le MMC est un médicament particulièrement puissant et potentiellement dangereux, ses effets secondaires – déficit en cellules souches de la cornée et fusion sclérale, par exemple – peuvent être graves. Les effets secondaires plus fréquemment rencontrés, tels que l’épithéliopathie cornéenne et conjonctivale et l’injection conjonctivale, sont transitoires.4,14 Lorsqu’il est utilisé, le MMC nécessite un suivi attentif et l’arrêt du traitement lorsqu’un effet secondaire important est suspecté.
5-Fluorouracil (5-FU). C’est un autre antimétabolite utilisé dans le traitement des tumeurs dermatologiques, et également par les chirurgiens du glaucome. Son mécanisme bloque la synthèse de l’ADN en interférant avec l’enzyme thymidylate synthase. Dans le traitement de l’OSSN, le 5-FU est généralement administré à une concentration de 1 % QID un mois de suite, un mois de suite jusqu’à résolution. La plupart des cas se résorbent en un ou deux cycles, mais certains prennent jusqu’à cinq cycles. La toxicité épithéliale, qui se traduit par une érosion ou une desquamation, est fréquente. Dans une étude, la durée du traitement a été fixée jusqu’à l’apparition de la desquamation, l’arrêt du traitement se faisant jusqu’à la réépithélialisation. Malgré cette complication douloureuse, les effets secondaires du 5-FU ne semblent pas être aussi graves que ceux du MMC, et les taux de récidive sont généralement signalés comme équivalents.4,14
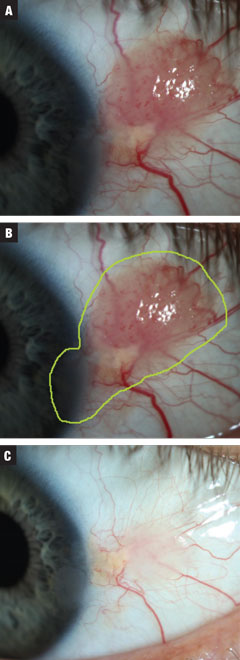
Fig. 3a. Le cas 3 concernait une CIN présumée papillomateuse de taille modérée. Le patient a été mis sous traitement INF-a2b trois millions d’UI pendant 10 jours. Fig. 3b. Estimation de la taille totale de la lésion. Fig. 3c. Post-traitement. Résolution presque complète de la croissance avec un épithélium cornéen toujours irrégulier. Contre avis, le patient a choisi d’observer à ce moment-là. Cliquez sur l’image pour l’agrandir.
Interféron alpha 2b (INF-a2b). Les interférons sont un sous-groupe de protéines inflammatoires naturelles connues sous le nom de cytokines. Ils sont produits par les cellules immunitaires activées et ont des effets antinéoplasiques, antiviraux et antimicrobiens variables. La première utilisation rapportée de l’INF-a2b en 1994 a donné lieu à une résolution réussie d’une lésion de CIN avec son utilisation topique.5 Depuis lors, l’INF-a2b a été utilisé à la fois par voie topique et sous-conjonctivale, avec un bon effet, dans le traitement de l’OSSN.
L’administration par voie périlésionnelle présente la plus grande efficacité, avec une résolution de 87 % à 100 % sur une période de cinq semaines (avec des injections administrées jusqu’à trois fois par semaine).4,14,15 Plusieurs injections sont nécessaires pour obtenir ce niveau d’efficacité, ce qui entraîne jusqu’à 100 % des patients qui développent des myalgies systémiques et de la fièvre.5,14 L’administration topique est à peu près équivalente à la MMC en termes d’efficacité.14,15 Elle est administrée à une concentration d’un million d’unités internationales (UI) par millimètre et administrée QID pendant un mois au-delà de la résolution clinique. En l’absence de résolution, la concentration peut être augmentée jusqu’à trois millions d’UI, également QID. En général, quelle que soit la concentration du traitement, les pharmacies préparent le flacon à partir d’une seule préparation d’un million d’UI. Cette préparation d’un million d’UI peut être concentrée davantage en réduisant la quantité de véhicule dans le flacon. Les effets secondaires de l’INF-a2b topique sont légers, l’hyperémie et la conjonctivite folliculaire étant fréquemment signalées ; la kératite est signalée moins fréquemment.4
Topique vs chirurgie
Bien que la biopsie et l’excision chirurgicale aient été le traitement historique de choix, les chimiothérapies topiques, qui présentent certains avantages théoriques par rapport à la chirurgie, ont gagné une certaine acceptation en tant que thérapie de première ligne. Avec la chirurgie, il est impossible de garantir des marges nettes – une caractéristique nécessaire pour le meilleur pronostic. Plus la quantité de tissu retirée pour garantir des marges nettes est importante, plus le risque de perturbation à long terme de la surface oculaire est élevé. Les agents topiques traitent la totalité de la surface oculaire, ce qui élimine la nécessité d’identifier les marges et permet de traiter efficacement les populations cellulaires néoplasiques qui ne pourraient pas être clairement identifiées par une analyse microscopique – un avantage qui pourrait conduire à l’association des agents topiques et de l’excision chirurgicale en tant que protocole de traitement total pour les grandes lésions. L’inconvénient de la thérapie topique, bien sûr, est que puisque toute la surface oculaire est exposée au médicament – techniquement un surtraitement – des complications peuvent survenir et, dans le cas du MMC en particulier, ces complications, bien que rares, peuvent être graves.
En ce qui concerne l’efficacité, tous les agents de chimiothérapie topique pour la prise en charge de l’OSSN donnent des résultats raisonnables. L’INF-a2b a fait l’objet d’études d’efficacité en tête-à-tête avec la résection chirurgicale et il a été démontré qu’il élimine la lésion à des taux comparables, et les taux de récidive peuvent en fait être plus faibles pour l’INF-a2b par rapport à la résection4. Les études de suivi rapportent que son utilisation est plus appropriée dans les lésions simples ou petites, tandis que la chirurgie est préférable dans les cas de lésions plus avancées, bien qu’un traitement topique puisse être préférable pour les lésions récurrentes.4,15
Le MMC a généralement le traitement le plus court, mais il est le plus toxique et comporte le plus grand risque de complications. Le 5-FU présente un profil d’effets secondaires et une durée de traitement moyens ; il est également le moins coûteux du groupe. L’INF-a2b présente une tolérance supérieure, mais est souvent associé à un traitement plus long et à un coût plus élevé.4,13-16
Le coût peut certainement être un élément à prendre en compte lors de la décision d’utiliser des chimiothérapies topiques. Les compagnies d’assurance refusent parfois de couvrir ces médicaments, signalant leur utilisation comme expérimentale. Dans le cadre de traitements courts et en ne comparant que les dépenses totales de santé, les chimiothérapies topiques sont moins coûteuses que la chirurgie ; cependant, elles peuvent dépasser les dépenses de la chirurgie après plusieurs traitements.
Cette éventuelle pierre d’achoppement mise à part, compte tenu de l’efficacité, de la possibilité d’éviter la chirurgie et de la tolérance générale, lorsqu’ils sont utilisés de manière contrôlée, les chimiothérapies topiques semblent être une bonne option pour le traitement des lésions de néoplasmes intraépithéliaux conjonctivaux.
Le Dr Bronner est un optométriste salarié du Pacific Cataract and Laser Institute à Kennewick, Wash.
1. Kiire CA, Dhillon B. L’étiologie et les associations de néoplasie intraépithéliale conjonctivale. Br J Ophthalmol. 2006:90(1);109-13.
2. Birkholz ES et al. Traitement de la néoplasie intraépithéliale à cellules squameuses de la surface oculaire avec et sans mitomycine C. Cornea. 2011;30:37-41.
3. Lee GA, Hirst LW. Néoplasie malpighienne de la surface oculaire. Enquête sur l’ophtalmologie. 1995 ; 39:429-50.
4. Nelson KD, McSoley JJ. Résultats cliniques et gestion de la néoplasie intraépithéliale conjonctivale. Optométrie. 2011 ; 82:15-21.
5. Nanji AA, Sayyad FE, Karp CL. Chimiothérapie topique pour les néoplasies squameuses de la surface oculaire. Opinion courante en ophtalmologie. 2013 ; 24:336-42.
6. Warner M, Jakobiec F. Tumeurs squameuses de la conjonctive. In : Krachmer JH, Mannis MJ, Holland EJ eds. Cornea. 2nd ed. St Louis : Mosby ; 2004:557-70.
7. Rapuono CJ, Luchs JI, Kim T. Conjonctival and External Disease. Segment antérieur : les conditions requises. Ed. Krachmer, JH. Mosby. 2000;33-6.
8. Huerva V et Ascaso FJ. Néoplasie intraépithéliale conjonctivale – Présentation clinique, diagnostic et possibilités de traitement. Srivstava S (Ed.) ISBN : 978-953-307-987-5, InTech.
9. Nelson KD, McSoley JJ. Résultats cliniques et gestion de la néoplasie intraépithéliale conjonctivale. Optométrie. 2011;82:15-21.
10. Kieval JZ1, Karp CL, Abou Shousha M, et al. Tomographie par cohérence optique à ultra-haute résolution pour la différenciation de la néoplasie squameuse de la surface oculaire et de la ptérigie. Invest Ophthalmol and Vis Sci. 2011 ; 52:1741.
11. Peksayar G, Soyturk MK, Demiryont M : Résultats à long terme de la cryothérapie sur les tumeurs épithéliales malignes de la conjonctive. Amer J of Ophthalmol. 1989;107 : 337.
12. Santhiago MR, Netto MV, Wilson SE. Mitomycine C : Effets biologiques et utilisation en chirurgie réfractive. Cornea. 2012 ; 31:311-21.
13. Tomaz M. La mitomycine C : petite, rapide et mortelle (mais très sélective). Chem and Biol. 1995 ; 2:575-9.
14. Majmudar PA, Epstein RJ. Les antimétabolites dans les néoplasies de la surface oculaire. Curr Opin in Ophthalmol. 1998 ; 9:35-9.
15. Besley J, Pappalardo J, Lee GA. Facteurs de risque de récidive de néoplasie squameuse de la surface oculaire après un traitement par mitomycine C topique et interféron alpha 2b. Amer J of Ophthalmol 2014 ; 157:287-93.
16. Boehm M et Huang AJW. Traitement des néoplasies intraépithéliales cornéennes et conjonctivales récurrentes avec l’interféron alpha-2b topique. Ophthalmol. 2004 ; 111:1755-61.