Chaque électron dans un atome peut être identifié de manière unique par un ensemble de quatre nombres quantiques.

Bien que leur découverte ait nécessité des mathématiques avancées, ce sont tous des nombres conventionnels :trois d’entre eux ne peuvent prendre que des valeurs entières simples ; le quatrième est une simple fraction.
Les trois premiers nombres quantiques proviennent de la fonction d’onde, Ψ, obtenue en résolvant l’équation de Schrödinger.
Le quatrième nombre quantique, le spin de l’électron, découle de la découverte que les électrons ont deux orientations possibles.
Les nombres et leurs définitions sont les suivants :
Les nombres quantiques
| Nombre quantique | Nom | Valeurs possibles | Information | |
|---|---|---|---|---|
| n | nombre quantique principal | 1, 2, 3,……., n | Définit la coquille énergétique occupée par l’électron. Les coquilles les plus proches du noyau ont la valeur la plus faible de n et l’énergie potentielle la plus faible.N est le premier nombre écrit dans les configurations électroniques telles que celle du magnésium : 1s2 2s2 2p6 3s2 |
|
| l | nombre quantique du moment angulaire orbital (également appelé nombre quantique azimutal) |
0, 1, 2,…, (n-1) | …., (n-1) | Définit la sous-coquille énergétique – dans les systèmes comportant plus d’un électron, les sous-coquilles ont des énergies différentes. l définit la lettre de la sous-coquille dans les configurations électroniques. Par exemple : 1s2 2s2 2p6 3s2 l = 0 donne une sous coquille s. l = 1 donne une sous coquille p. l = 2 donne une sous coquille d, etc. |
| ml | nombre quantique magnétique | -l, (l+1), …, 0,…. , (l+1), l | Définit l’orientation de l’orbitale de la sous-coquille. La sous-coquille p, avec l = 1, a trois valeurs ml : -1, 0, 1.Celles-ci indiquent que trois orbitales p existent.c’est-à-dire les orbitales px, py, et pz. La sous-coquille d, avec l = 2, a cinq valeurs ml : -2, -1, 0, 1, 2.Celles-ci indiquent que cinq orbitales d existent. |
|
| ms | nombre quantique de spin de l’électron | -½ ou +½ | Les électrons ont deux orientations de spin possibles. |
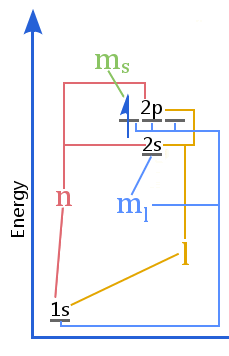
Le diagramme de niveau d’énergie montre la relation entre les nombres quantiques par rapport aux coquilles, aux sous-coquilles, aux orbitales et au spin des électrons dans un atome.
Aucun électron dans un atome ne partage les quatre nombres quantiques.Chaque électron peut être identifié de façon unique par son numéro quantique – voir le principe d’exclusion de Pauli.
Les formes des orbitales ne sont pas données par les numéros quantiques, mais sont des densités de probabilité – des cartes tridimensionnelles de l’espace autour du noyau où un électron se trouvera 99 % du temps.Les formes des orbitales sont obtenues à partir du carré de la fonction d’onde, Ψ2.L’emplacement et le moment précis de tout électron ne peuvent jamais être connus – voir le principe d’incertitude d’Heisenberg.

.