Introduction
La fièvre est fréquente chez les patients en état critique et est observée chez 90% de tous les patients septiques.1,2 Un épisode fébrile peut être d’origine infectieuse ou non infectieuse. La pneumonie, la sinusite et la bactériémie (primaire ou liée au cathéter) sont les causes infectieuses les plus fréquentes de la fièvre, tandis que les origines non infectieuses comprennent le cancer, les médicaments, les transfusions et les réactions allergiques.3
La prise en charge initiale de la fièvre comprend le traitement de la cause et l’administration de médicaments antipyrétiques (qui font baisser la fièvre). Les traitements antipyrétiques sont efficaces pour faire baisser la température, mais peuvent avoir des effets secondaires importants.4 Ces médicaments ne doivent pas être utilisés de manière systématique dans l’unité de soins intensifs (USI). Les risques et les avantages doivent être évalués individuellement pour chaque épisode de fièvre. Le paracétamol est simple à administrer et sûr, avec un indice thérapeutique élevé et un faible risque d’effets secondaires sous forme de troubles rénaux, gastro-intestinaux ou hématologiques.5 Le métamizol, quant à lui, est généralement utilisé pour traiter les douleurs et la fièvre postopératoires. Le dexkétoprofène est un sel hydrosoluble du kétoprofène, un énantiomère dextrogyre appartenant au groupe des anti-inflammatoires non stéroïdiens (AINS). Il est utilisé comme agent analgésique et anti-inflammatoire et constitue in vitro l’un des plus puissants inhibiteurs de la synthèse des prostaglandines.6 A ce jour, l’effet antipyrétique du dexkétoprofène n’a été décrit que dans des modèles animaux.7 Cette substance médicamenteuse a été comparée à d’autres AINS dans la prise en charge de la douleur postopératoire. Elle semble être mieux tolérée que les autres AINS,8 mais son effet antipyrétique et son profil hémodynamique chez les patients en état critique n’ont pas été décrits.
La présente étude compare les effets antipyrétiques et hémodynamiques du paracétamol, du métamizol et du dexkétoprofène – les principaux médicaments utilisés pour traiter la fièvre chez les patients en état critique.
Patients et méthodes
Une étude observationnelle prospective a été menée dans l’unité de soins intensifs de 16 lits d’un hôpital universitaire entre 2005 et avril 2007, portant sur 150 patients présentant un épisode de fièvre (plus de 38°C) que le médecin superviseur a décidé de traiter à l’aide de l’un des trois médicaments employés dans l’unité à cette fin. Chaque patient n’a été inclus dans l’étude qu’une seule fois. La décision de traitement a été établie chez chaque patient en fonction des répercussions cliniques de la fièvre : tachypnée, tachycardie, modifications de la pression artérielle et augmentation de la production de dioxyde de carbone ou de la consommation d’oxygène. Les traitements antipyrétiques couramment utilisés dans notre unité pour la fièvre sont le paracétamol 1000mg, le métamizol 2000mg et le dexkétoprofène 50mg – tous administrés en perfusion intraveineuse pendant 30 minutes. Un comité d’éthique de notre hôpital a approuvé l’étude sans qu’un consentement éclairé soit nécessaire. Les variables suivantes ont été contrôlées au départ (immédiatement avant le début du traitement) et 30, 60 et 120 minutes après la perfusion du médicament : température axillaire, pression sanguine systolique, pression sanguine diastolique, pression sanguine moyenne (PSM), fréquence cardiaque (FC) et saturation en oxygène (SatO2) mesurée par pulsioximétrie. La température a été surveillée 180minutes après la perfusion du médicament afin de déterminer une diminution d’au moins 1°C. La pression artérielle a été enregistrée à l’aide d’un système invasif chez les patients pour lesquels un tel système était déjà en place, basé sur un cathéter artériel fémoral ou radial, et de manière non invasive à l’aide d’un sphygmomanomètre numérique à bras dans les autres cas. Le système de mesure de la pression d’un patient donné n’a pas été modifié au cours des différentes mesures. La diurèse a été enregistrée à partir de la ligne de base et jusqu’à 120minutes. Nous avons également documenté les besoins relatifs aux médicaments vasopresseurs, aux vasodilatateurs et à la fluidothérapie avant le traitement et pendant les 120 minutes suivant la perfusion. De même, le SAPS (Simplified Acute Physiology Score) II9 a été enregistré à l’admission, ainsi que la raison de l’admission et le besoin de ventilation mécanique (MV) au moment de l’étude.
La taille de l’échantillon calculée pour détecter une diminution de 1°C de la température était de 50 patients par groupe, avec une erreur de type I de 5% (α=0,05) et une puissance statistique de 80% (β=0,20). Les patients ont été inclus dans l’étude jusqu’à la fin de l’assignation de 50 sujets par groupe. Les variables quantitatives ont été soumises à une analyse de variance (ANOVA), tandis que le test du chi carré a été utilisé pour analyser les variables qualitatives. Une ANOVA à deux facteurs a été utilisée avec le modèle linéaire général (GLM). Les facteurs étaient : le temps (début de l’étude, 30, 60 et 120 minutes), le traitement (paracétamol, métamizol et dexkétoprofène) et leur interaction, ce qui permettrait de répondre à la question de savoir si l’évolution des traitements différait au cours du suivi. Une analyse post hoc a été effectuée lorsque cela était nécessaire. En outre, l’ANOVA a été utilisée pour comparer la diminution de la PBM avec chaque traitement à partir de la ligne de base et jusqu’à 120 minutes. La signification statistique a été considérée pour p
0,05. Le progiciel statistique SPSS version 14.0.1 (SPSS Inc., Chicago, IL, USA) a été utilisé tout au long de l’étude.Résultats
Sur les 150 patients étudiés, 102 étaient des hommes (68%) et 48 des femmes (32%). L’âge moyen était de 58±16 ans (intervalle 19-86). Le score SAPS II était de 42,4±13,4. Chaque groupe (paracétamol, métamizol et dexkétoprofène) comprenait 50 patients. Les caractéristiques démographiques sont présentées dans le tableau 1. Il n’y avait aucune différence statistiquement significative entre les groupes pour l’une ou l’autre de ces variables. Tous les patients inscrits ont terminé l’étude.
Caractéristiques des patients au départ et par groupe de traitement. Il n’y avait pas de différences statistiquement significatives entre les groupes.
| Total (n=150) | Paracétamol (n=50) | Métamizol (n=50) | Dexkétoprofène (n=50) | p. | |
| Âge (années moyennes±SD) | 58±16 | 54±18 | 62±15 | 58±16 | ns |
| SAPS II | 42.4±13.4 | 43.8±14.9 | 41.7±13.3 | 41.7±12.0 | ns |
| Sexe : M/F | 102/48 | 34/16 | 40/10 | 28/22 | ns |
| Ventilation mécanique | 123 (82%) | 41 (82%) | 38 (76%) | 44 (88%) | ns |
| Motif d’admission | |||||
| Pneumonie | 35 (23%) | 12 (24%) | 12 (24%) | 11 (22%) | ns |
| Neurologique | 44 (29%) | 14 (28%) | 16 (32%) | 14 (28%) | ns |
| Cardiovasculaire | 16 (11%) | 5 (10%) | 7 (14%) | 4 (8%) | ns |
| Chirurgie abdominale | 37 (25%) | 10 (20%) | 10 (20%) | 17 (34%) | ns |
| BPCO exacerbée-asthme | 3 (2%) | 2 (4%) | 0 (0%) | 1 (2%) | ns |
| Autres | 15 (10%) | 7 (14%) | 5 (10%) | 3 (6%) | ns |
SD : écart-type ; BPCO : bronchopneumopathie chronique obstructive ; M : homme ; F : femme ; ns : non significatif ; SAPS : Simplified Acute Physiology Score.
Température
Nous avons enregistré une diminution significative de la température d’au moins 1°C après 180minutes chez 38 patients traités par dexkétoprofène (76%), chez 36 traités par métamizol (72%) et chez 20 traités par paracétamol (40%) (p
0,001). Chez 37% des patients, aucune diminution d’au moins 1°C n’a été observée après 180 minutes. La figure 1 montre la diminution moyenne de la température dans chaque groupe aux quatre points de temps, tandis que le tableau 2 documente la moyenne et l’écart-type de la baisse de température pour chaque médicament et à chacun des points de temps étudiés. Une baisse significative de la température a été enregistrée au fil du temps, mais il n’y a pas eu d’interactions entre les trois différents traitements au fil du temps – c’est-à-dire qu’aucun des traitements n’a fait baisser la température corporelle plus que les autres à aucun des points temporels.
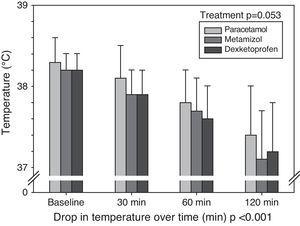
Moyenne et écart-type de la température au départ et après 30, 60 et 120minutes avec chaque traitement.
Température axillaire, pression artérielle moyenne, fréquence cardiaque, saturation en oxygène déterminée par pulsioxymétrie au départ et après 30, 60 et 120minutes, et diurèse du départ à 120minutes.
| Paracétamol | Métamizol | Dexkétoprofène | ||||||||||
| Baseline | 30min | 60min | 120min | Baseline | 30min | 60min | 120min | Baseline | 30min | 60min | 120min | |
| Ta (°C) | 38.3±0.3 | 38.1±0.4 | 37.8±0.4 | 37.4±0.6 | 38.2±0.2 | 37.9±0.3 | 37.7±0.4 | 37.1±0.6 | 38.2±0.2 | 37.9±0.3 | 37.6±0.4 | 37.2±0,5 |
| MPB (mmHg) | 83,8±12,9 | 77,7±11,9 | 76,0±11,8 | 75.3±13.8 | 87.6±13.0 | 79.8±10.6 | 75.0±11.2 | 72.7±11.6 | 87.4±12.6 | 78.4±10.1 | 73.1±10.3 | 70.6±11.7 |
| Rythme cardiaque (bpm) | 104.7±23.2 | 101.5±22.7 | 99.9±22.7 | 96.9±22.4 | 102.68±19.6 | 100.0±18.8 | 98.0±17.3 | 94.3±16.8 | 103.1±19.6 | 100.2±17.9 | 98.0±18.8 | 93.2±16.7 |
| SatO2 (%) | 96.8±2.7 | 97.0±2.4 | 97.4±2.6 | 97.2±2.6 | 97.0±2.3 | 97.0±2.1 | 97.2±2.2 | 97.2±2.1 | 97.9±2.1 | 98.0±1.7 | 98.1±1.5 | 98.0±1,7 |
| Volume urinaire (ml) | 140,6±114,9 | 116.7±82,6 | 104,7±66,4 | |||||||||
Toutes les valeurs sont exprimées en moyenne±écart-type. p=non significatif pour toutes les variables étudiées.
HR : fréquence cardiaque ; bpm : battements par minute ; min : minutes ; MBP : pression artérielle moyenne ; SatO2 : saturation en oxygène ; Ta : température axillaire.
Hémodynamique
Les variables hémodynamiques systémiques sont présentées dans le tableau 2, exprimées en moyenne et écart-type. Il n’y a pas eu de différences statistiquement significatives entre les groupes en termes de pression artérielle moyenne, de saturation en oxygène déterminée par pulsioxymétrie ou de fréquence cardiaque aux différents points temporels étudiés et pour chaque médicament antipyrétique. De même, il n’y a pas eu de différences dans la diurèse enregistrée pendant la période d’étude entre les différents traitements. La figure 2 montre l’évolution de la PBM±écart-type aux quatre points temporels (ligne de base, et après 30, 60 et 120 minutes) dans chacun des trois groupes. Il n’y a pas eu de différences statistiquement significatives entre les traitements à aucun moment. Une diminution significative de la PBM a été enregistrée au cours du temps, avec une interaction des trois traitements différents dans le temps. La figure 3 montre la diminution moyenne de la PBM dans chaque groupe. Après 120 minutes, la diminution moyenne de la PBM était de 8,5±13,6mmHg avec le paracétamol, 14,9±11,8mmHg avec le métamizol, et 16,8±13,7mmHg avec le dexkétoprofène (p=0,005). L’analyse post hoc a montré que la baisse de la PBM dans le groupe paracétamol était plus faible que dans les groupes métamizol et dexkétoprofène, tandis qu’aucune différence statistiquement significative n’a été enregistrée entre les groupes métamizol et dexkétoprofène.
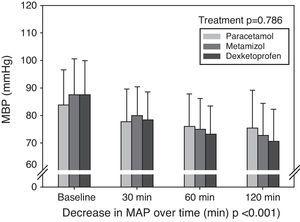
Moyenne et écart-type de la pression sanguine moyenne (PSM) au départ et après 30, 60 et 120minutes avec chaque traitement.
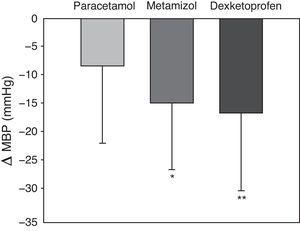
Moyenne et écart-type de la variation de la pression artérielle moyenne (PAM) entre la ligne de base et après 120minutes. Les différences entre le paracétamol et le métamizol (*) et le paracétamol et le dexkétoprofène (**) étaient statistiquement significatives (p=0,005).
Trente-neuf des 150 patients (26%) recevaient des vasoconstricteurs pendant l’épisode de fièvre : 15 dans le groupe paracétamol (38,5%), 9 dans le groupe métamizol (23%) et 15 dans le groupe dexkétoprofène (38,5%). Sur ces 39 patients, un dans le groupe paracétamol recevait de l’adrénaline, un dans le groupe métamizol recevait de la dopamine, et les autres recevaient tous de la noradrénaline aux doses requises pour maintenir la pression artérielle moyenne au-dessus de 65mmHg. Après le début du traitement antipyrétique, 10 des 15 patients traités par le paracétamol (66 %), y compris le patient recevant de l’adrénaline, ont dû augmenter la dose de vasoconstricteur. Sept des 9 patients du groupe métamizol (77%) et 12 des 15 patients du groupe dexkétoprofène (80%) ont nécessité une augmentation de la dose de noradrénaline. Un traitement vasopresseur a été instauré pour maintenir une pression artérielle systémique adéquate chez 7 patients : un dans le groupe paracétamol, deux dans le groupe métamizol et quatre dans le groupe dexkétoprofène. Vingt-huit des 150 patients (18,7 %) recevaient des vasodilatateurs en perfusion continue avec du nitroprussiate ou du labétalol : 10 dans le groupe paracétamol (35,7%), 11 dans le groupe métamizol (39,3%) et 7 dans le groupe dexkétoprofène (25%). La dose de vasodilatateur a dû être diminuée chez 6 des 10 patients traités par le paracétamol (60%), chez 9 des 11 patients traités par le métamizol (81,8%) et chez 5 des 7 patients traités par le dexkétoprofène (71,4%). Chez 7 des patients recevant des vasodilatateurs, le traitement a dû être suspendu : trois dans le groupe paracétamol, trois dans le groupe métamizol et un dans le groupe dexkétoprofène. Aucun de ces patients n’a nécessité la mise en place d’un traitement vasoconstricteur. Il n’y a pas eu de différences statistiquement significatives dans la nécessité d’augmenter la dose de vasoconstricteurs ou de diminuer la dose de vasodilatateurs entre les groupes, et chez tous les patients, l’objectif était de maintenir la pression artérielle moyenne au-dessus de 65mmHg.
Quinze des 150 patients (10%) ont eu besoin d’une fluidothérapie pendant le traitement antipyrétique, afin d’éviter une chute excessive de la pression artérielle. Quatre patients dans le groupe paracétamol, 5 dans le groupe métamizol et 6 dans le groupe dexkétoprofène ont nécessité l’administration de 250-500ml de cristalloïdes, administrés pendant 30minutes après avoir détecté la baisse de la pression artérielle.
Vingt patients ont souffert d’une insuffisance rénale aiguë et ont dû subir une hémodialyse avant le traitement antipyrétique : 8 dans le groupe paracétamol, 5 dans le groupe métamizol et 7 dans le groupe dexkétoprofène. Après le traitement antipyrétique, 5 patients supplémentaires ont dû subir une hémodialyse : quatre dans le groupe paracétamol et un dans le groupe dexkétoprofène. Aucun des patients n’a été connecté au système de dialyse pendant l’étude.
Discussion
Les principales conclusions de cette étude d’observation étaient que le paracétamol semblait être le meilleur des trois médicaments étudiés en termes de réduction moindre de la PBM. Cependant, le paracétamol ne s’est avéré capable d’abaisser la température d’au moins 1°C après 180 minutes que chez moins de la moitié des patients. Ces résultats suggèrent qu’il peut être le médicament de choix dans le traitement d’un épisode de fièvre lorsque le patient est hémodynamiquement instable, bien qu’une baisse significative de la température soit peu probable. Chez les patients dont l’état hémodynamique est stable, le métamizol ou le dexkétoprofène pourraient être le premier choix pour abaisser la température, en raison du plus grand pourcentage de réussite avec ces médicaments par rapport au paracétamol. Chez les patients chez qui la température n’a pas diminué (37%), nous ne savons pas quelle aurait été l’évolution sans l’administration d’un traitement antipyrétique.
Bien que les mesures de refroidissement physique soient efficaces pour réduire la température de la peau lorsque les mécanismes physiologiques de thermorégulation sont altérés, ces mesures n’abaissent pas le réglage de la température du centre thermorégulateur et, de plus, peuvent augmenter l’inconfort et le stress métabolique chez les patients fébriles non sédatés.10
Notre étude a été réalisée avec trois substances médicamenteuses couramment utilisées : le paracétamol, le métamizol et le dexkétoprofène. Un certain nombre d’études dans la littérature ont comparé les changements de température et les effets hémodynamiques des médicaments utilisés pour le traitement de la fièvre. Les effets antipyrétiques du métamizol et du paracétamol ont été décrits ailleurs.11-15 Poblete et al.14 ont constaté que le paracétamol et le métamizol n’induisent pas de réductions de température cliniquement significatives chez les patients critiques atteints de fièvre, par rapport à l’adoption de mesures de refroidissement physique. Cependant, Gozzoli et al.16 ont comparé ces mêmes médicaments, c’est-à-dire le métamizol et le paracétamol, avec des mesures physiques dans le traitement de la fièvre, et ont constaté que les trois traitements abaissaient la température de la même manière. Comme dans notre étude, ces auteurs ont conclu que le métamizol ne devait pas être considéré comme le médicament antipyrétique de premier choix chez les patients hémodynamiquement instables, et que le paracétamol devait être préféré dans de tels cas. Les divergences entre les études de Poblete et Gozzoli sont probablement dues au petit nombre de patients étudiés dans chaque groupe : 20 dans le premier et 30 dans le second. Oborilová et al.11 ont à leur tour étudié 254 épisodes de fièvre, essentiellement chez des patients hémato-oncologiques traités par métamizol, diclofénac et paracétamol. Ils ont constaté que tous ces médicaments offraient un effet antipyrétique significatif, bien que le métamizol se soit avéré meilleur que le paracétamol pour améliorer l’inconfort du patient associé à la fièvre. Cependant, cette étude n’incluait pas de patients critiques et, d’autre part, comme il s’agissait de patients hémato-oncologiques, les altérations immunitaires produites par la maladie tumorale ou par le traitement associé ont pu influencer les valeurs de température.
Dans notre étude, les trois substances médicamenteuses ont abaissé la PBM. Sur 39 patients recevant un traitement vasoconstricteur, un pourcentage important dans chaque groupe a nécessité une augmentation de la dose de médicament, et un traitement vasoconstricteur a dû être commencé chez 7 patients. Sur un total de 28 patients recevant des vasodilatateurs, la dose de médicament a dû être diminuée chez une grande partie des patients et suspendue chez 7 des 28 sujets. Dans ce groupe de patients, l’effet hypotenseur des médicaments antipyrétiques a pu être amplifié par la perfusion concomitante d’un médicament vasodilatateur. Cependant, étant donné qu’un faible pourcentage de patients a été impliqué, avec une distribution homogène parmi tous les groupes de traitement, nous soupçonnons que cet effet est peu pertinent en termes de résultat final. Malgré ces changements hémodynamiques, la diurèse n’a pas été modifiée pendant les 120 minutes de suivi. Ces résultats sont comparables à ceux d’autres études dans lesquelles le métamizol a induit une diminution significative de la PBM par rapport au paracétamol. En utilisant le métamizol, le kétorolac et le paracétamol comme traitement de la douleur postopératoire chez des patients critiques, Avellaneda et al.17 ont rapporté une diminution de la pression artérielle radiale dans les trois groupes de traitement, tandis que Hoigné et al.18 ont enregistré une baisse significative de la pression systolique chez les patients traités par le métamizol.
Cruz et al.15 ont également décrit une diminution de la PBM et d’autres variables hémodynamiques après l’administration de métamizol ou de paracétamol chez 60 patients ayant de la fièvre. Dans le cas de l’hypotension induite par le métamizol, cela a été expliqué par l’effet relaxant du médicament sur les cellules musculaires lisses, entraînant une vasodilatation périphérique.16
Notre étude présente un certain nombre de limites. Une première considération est la conception de l’étude. Comme il s’agit d’une étude d’observation et non d’une étude randomisée ou masquée, les résultats obtenus ne sont pas concluants. Le choix du traitement antipyrétique basé sur la décision du médecin superviseur peut avoir introduit un biais de sélection entre le médicament et le patient. D’autre part, comme les effets des trois substances médicamenteuses n’ont pas été comparés à l’adoption de mesures de refroidissement physique comme dans d’autres études, les possibilités de comparaison sont limitées. De notre côté, nous avons enregistré la température axillaire mais pas la température centrale, cette dernière n’étant enregistrée de manière routinière dans notre unité de soins intensifs qu’une ou deux fois par jour. D’autre part, l’American College of Critical Care Medicine et l’Infectious Diseases Society of America définissent la fièvre comme une température supérieure à 38,3°C.19 Dans notre USI, cependant, nous traitons des patients dont la température est égale ou supérieure à 38°C, avec des répercussions cliniques. Notre étude ne fait que refléter notre pratique clinique quotidienne. Par ailleurs, la dose de médicament administrée n’a pas été calculée en fonction du poids corporel, et la dose standard prescrite peut avoir influencé les résultats. De même, aucun enregistrement de la douleur n’a été effectué. Dans notre unité de soins intensifs, les patients soumis à une ventilation mécanique reçoivent une sédation et une analgésie afin de maintenir un score de l’échelle de sédation de Ramsay20 compris entre 2 et 3. Dans notre série, 123 patients étaient sous ventilation mécanique au moment de l’épisode de fièvre, mais nous ne disposons pas de données spécifiques concernant la situation de la douleur parmi les patients inclus ; un effet hémodynamique de la douleur ne peut donc pas être écarté.
Il n’est pas clair si la fièvre en elle-même est bénéfique ou nuisible.4,21 Les études sur les animaux atteints d’une infection décrivent la fièvre comme étant bénéfique, et il n’y a aucune preuve que l’administration de médicaments antipyrétiques modifie la mortalité.1 La fièvre complète les défenses immunitaires de l’hôte contre l’infection22 et active certains paramètres de la fonction immunitaire, avec l’activation des lymphocytes T, la production de cytokines et d’anticorps, et la fonction des neutrophiles et des macrophages.23 D’autre part, une température corporelle élevée peut être associée à une série d’effets délétères tels que l’augmentation du débit cardiaque, de la consommation d’oxygène et de la production de dioxyde de carbone. Ces changements peuvent être mal tolérés par les patients critiques dont la réserve cardiorespiratoire est limitée.24 Les effets hémodynamiques et métaboliques négatifs de la fièvre sont particulièrement indésirables en présence de problèmes cardiaques ou dans les situations de septicémie clinique, dans lesquelles la fonction myocardique est déprimée.25 De plus, pendant ou après une période d’ischémie cérébrale ou de traumatisme, l’hyperthermie augmente de façon marquée les dommages neuronaux qui en résultent.26 Toutes ces données suggèrent que le traitement d’un épisode de fièvre doit être évalué individuellement en tenant compte des bénéfices et des effets secondaires possibles.27
En résumé, le dexkétoprofène et le métamizol ont présenté un meilleur effet antipyrétique aux doses étudiées, mais avec un profil hémodynamique moins bon. En revanche, le paracétamol a été associé à une stabilité hémodynamique accrue mais à un effet antipyrétique moindre. Les caractéristiques de chaque patient doivent être prises en compte lors de la prescription d’un médicament antipyrétique, afin d’éviter une instabilité hémodynamique. Néanmoins, d’autres études sont nécessaires, impliquant une conception randomisée, afin de pouvoir tirer des conclusions fermes.
Conflits d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts.
.