Introduction
Les méningiomes sont les néoplasmes primaires du système nerveux central (SNC) les plus fréquents et représentent plus de 37% de toutes les tumeurs cérébrales primaires (1). Les options de gestion des méningiomes comprennent l’observation, la chirurgie et la radiothérapie (2, 3). Si une minorité de méningiomes sont agressifs, notamment les grades II et III de l’Organisation mondiale de la santé (OMS), plus de 80 % sont de grade I de l’OMS et sont souvent qualifiés de « bénins » (4). Cependant, même les méningiomes de grade I de l’OMS peuvent récidiver, des études antérieures ayant mis en évidence un taux de récidive allant jusqu’à 47 % avec un suivi à long terme (4, 5). La récidive des méningiomes nécessite souvent un traitement par chirurgie supplémentaire ou radiothérapie de sauvetage, ce qui entraîne une morbidité potentielle (6, 7). Par conséquent, la capacité à prédire la récidive est un élément crucial de la gestion des méningiomes de grade I de l’OMS pour faire des recommandations concernant la fréquence de l’imagerie de surveillance, ou l’utilisation de la radiothérapie adjuvante.
En plus du grade de Simpson atteint lors de la résection, un certain nombre de caractéristiques de la tumeur ont été évaluées comme des prédicteurs possibles de la récidive, en mettant l’accent sur les résultats histopathologiques (8). Il s’agit notamment de l’indice MIB-1 (un marqueur de prolifération cellulaire), de l’invasion cérébrale et de la présence de caractéristiques histologiques atypiques, notamment une cellularité accrue, la présence de nappes, des foyers de nécrose spontanée et des atypies nucléaires (9-13). En effet, les classifications de l’OMS de 2016 utilisent exclusivement les résultats pathologiques pour déterminer le grade de la tumeur, le grade II étant défini par une invasion cérébrale et une augmentation des mitoses sur 4/10 high powered field (HPF) (4). En outre, trois caractéristiques atypiques entraînent ensemble une augmentation du grade de la tumeur (4). Dans l’avenir, les caractéristiques moléculaires des méningiomes ont récemment été associées au risque de récidive, et seront probablement utilisées dans le classement des méningiomes à l’avenir (14-16).
Alors que les classifications de l’OMS synthétisent la littérature disponible pour créer des délimiteurs clairs entre les grades de tumeurs, la littérature entourant la récidive des méningiomes de grade I de l’OMS reste mitigée. Par exemple, alors que l’invasion cérébrale seule peut entraîner une augmentation du grade tumoral du grade I-II de l’OMS, un certain nombre d’études ultérieures n’ont pas trouvé de relation entre l’invasion cérébrale et la récidive, soulignant la nécessité de recherches supplémentaires sur les prédicteurs de récidive (10, 17, 18). L’utilité de l’indice MIB-1 pour prédire la récidive des méningiomes est également controversée ; une étude sur les méningiomes de grade I de l’OMS a seulement suggéré un risque de récidive plus élevé avec un indice MIB-1 >3%, mais d’autres publications incluant tous les grades de l’OMS ont démontré une incidence plus élevée de récidive à >5% ou >10% (9-11). Des études antérieures ont également proposé un seuil de MIB-1 >3% uniquement chez les patients ayant subi une résection de Simpson II ou III, démontrant ainsi la diversité des seuils de MIB-1 et de leur utilisation (13). En comparaison, un nombre limité d’études ont examiné l’impact des caractéristiques atypiques dans la récurrence des méningiomes de grade I de l’OMS ; bien qu’elles aient suggéré un risque plus élevé de récurrence dans les tumeurs de grade I de l’OMS présentant des caractéristiques atypiques lors de l’analyse pathologique (9).
C’est pourquoi l’objectif de cette étude était d’examiner les prédicteurs cliniques, radiographiques et pathologiques de la récurrence des méningiomes de grade I de l’OMS. Étant donné l’absence de consensus sur l’utilisation du MIB-1 dans les méningiomes de grade I de l’OMS, nous utilisons également une analyse de partitionnement récursive pour identifier un seuil cliniquement pertinent pour l’indice MIB-1. Nous identifions ensuite les prédicteurs de récidive précoce et post-médiane dans les tumeurs de grade I de l’OMS.
Méthodes
Population de patients
Les patients qui ont subi un traitement pour un méningiome de grade I de l’OMS entre 2007 et 2017 ont été identifiés rétrospectivement en utilisant une base de données institutionnelle. Cette étude a été formellement approuvée par le comité d’examen institutionnel de l’Université de Californie, San Francisco (IRB#13-12587). Les patients sans valeurs d’indice MIB-1 disponibles dans le dossier médical électronique ont été exclus. Au début de la période d’étude, le MIB-1 a été obtenu à la discrétion du neuropathologiste traitant, mais, au fil du temps, le MIB-1 a été obtenu sur tous les patients atteints de méningiome de grade I de l’OMS.
Données cliniques
Les caractéristiques démographiques, cliniques et de traitement des patients, les données histopathologiques et les résultats cliniques ont été examinés et recueillis rétrospectivement. Les données cliniques recueillies comprenaient l’âge du patient, son sexe, l’état de performance de Karnofsky (KPS) au moment du traitement, la présentation clinique et les antécédents de traitement du méningiome. Les données histopathologiques comprenaient l’indice MIB-1, la présence de feuillets/perte d’architecture, une cellularité accrue, une nécrose, des atypies nucléaires et la présence d’une invasion osseuse. Les résultats de la coloration du récepteur de la progestérone (PR), de l’antigène de la membrane épithéliale (EMA), du CD34, du S100, de la protéine gliale fibrillaire et acide (GFAP) ont été recueillis lorsqu’ils étaient disponibles. Les données pathologiques ont été extraites du rapport de pathologie généré au moment de l’intervention chirurgicale. La localisation de la tumeur, sa taille et la présence d’un œdème péritumoral préopératoire ont été déterminées à l’aide de l’imagerie IRM préopératoire. Les diamètres antérieur-postérieur (AP), supérieur-inférieur (SI) et transversal (TV) ont été recueillis. Le volume tumoral préopératoire a été calculé en utilisant l’équation pour le volume tumoral non sphérique. Le type de traitement a été recueilli de la même manière. Le grade de Simpson a été déterminé par le rapport opératoire. La résection totale brute (RTG) et la résection subtotale (RST) ont été déterminées à l’aide des examens d’imagerie par résonance magnétique (IRM) postopératoires.
Les principaux résultats d’intérêt étaient la récidive tumorale et le délai de récidive. La récidive a été déterminée sur la radiographie postopératoire comme une récidive locale ou une progression de la tumeur résiduelle. Le délai avant la récidive a été déterminé à partir de la date de traitement du patient. La durée du suivi a été calculée à partir de la date du traitement jusqu’à la dernière visite à la clinique de neurochirurgie. Les résultats secondaires comprenaient la récidive précoce et post-médiane. La récidive précoce a été définie comme étant dans les 2 ans suivant le traitement initial (19). La récidive post-médiane a été définie comme survenant >2 ans après le traitement initial.
Analyse statistique
Le chi-carré et le test t de Student ont été utilisés pour la comparaison des variables catégorielles et continues, respectivement. Un modèle de régression multivarié de Cox à vraisemblance inverse pour la récurrence a été construit en utilisant les variables avec p < 0,200 sur l’analyse univariée. De la même manière, des modèles logistiques binaires multivariés à probabilité inverse ont été construits pour prédire la récidive précoce et post-médiane en utilisant des variables avec p < 0,200 dans l’analyse univariée. L’analyse par partitionnement récursif (RPA) a été utilisée pour identifier plus précisément les facteurs de risque clés de la récidive globale, précoce et post-médiane des méningiomes. Un p < 0,050 a été utilisé comme seuil de signification statistique. Toutes les analyses statistiques ont été effectuées avec SPSS 26.
Résultats
Démographie globale des patients et résultats cliniques
La démographie globale des patients, les caractéristiques histopathologiques et les résultats cliniques sont visibles dans le tableau 1. Au total, 239 patients atteints de méningiomes de grade I de l’OMS ont été inclus dans l’étude. L’âge moyen était de 60,0 ans et 69,5 % des patients étaient des femmes. Le symptôme le plus fréquent était la céphalée (30,5 %), suivie par un déficit neurologique focal (27,6 %). La majorité des patients ont subi une intervention chirurgicale seule (98,3 %), deux patients ayant reçu chacun un traitement adjuvant par radiothérapie (0,8 %) ou par gamma knife (0,8 %). Un œdème péritumoral était présent sur les IRM préopératoires de 38,1% des patients. Le volume tumoral moyen calculé était de 30,6 cm3 (intervalle = 0,23-215,73 cm3), et la plus grande dimension tumorale moyenne était de 3,8 cm (intervalle = 0,6-11,3 cm). Dans l’ensemble, 91 (38,1 %) tumeurs étaient situées sur la base du crâne, 57 (23,8 %) étaient des tumeurs convexes, 43 (18,0 %) avaient une localisation falx/parasagittale et 55 (23,0 %) avaient une autre localisation. La plupart des patients ont subi une résection totale (63,6 %). L’incidence de la résection de Simpson I, II, III et IV était de 31,4, 29,7, 2,5 et 35,6 %, respectivement. Des caractéristiques atypiques étaient présentes chez un certain nombre de patients ; les caractéristiques atypiques les plus courantes étaient l’invasion osseuse (18,0 %) et la feuille/perte d’architecture (8,4 %). Le suivi moyen était de 41,1 mois (intervalle : 0-147 mois).
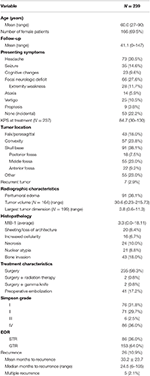
Tableau 1. Caractéristiques des patients, caractéristiques histopathologiques, radiographie et résultats.
Prédicteurs de récidive des méningiomes de grade I de l’OMS
Un total de 26 patients ont récidivé avec un délai médian de récidive de 24,5 mois (tableau 1). Une comparaison entre les patients avec une récidive et ceux sans récidive peut être trouvée dans le tableau 2. Il n’y avait pas de différence en termes d’âge (60,2 vs 58,8, p = 0,582) ou de sexe féminin (61,5 vs 70,4 %, p = 0,353) entre les patients dont les tumeurs ont récidivé et les patients sans récidive. Les caractéristiques du traitement étaient similaires entre les groupes, la plupart des patients de chaque groupe ayant subi une intervention chirurgicale seule (100,0 vs 98,1 %, p = 1,000). Cependant, les patients présentant des tumeurs récurrentes avaient une incidence plus élevée de STR (61,5 vs. 32,7%, p = 0,004) et une incidence plus faible de résection de grade I de Simpson (11,5 vs. 34,1%, p = 0,019). L’incidence de l’œdème péritumoral, la taille de la tumeur et le volume tumoral étaient similaires entre les groupes. Lors de l’analyse histopathologique, les patients présentant une récidive avaient tendance à présenter une augmentation des atypies nucléaires (19,2 vs. 7,5 %, p = 0,061). Les patientes avec récidive avaient également un suivi moyen plus élevé (68,9 vs 37,7 mois, p = 0,001).
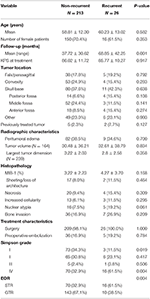
Tableau 2. Comparaison des patients atteints de méningiomes récurrents par rapport aux méningiomes non récurrents.
Une analyse de cox-régression de vraisemblance inverse ultérieure a mis en évidence une relation indépendante entre la récurrence et la localisation de la tumeur dans la fosse postérieure (HR = 5.25, IC 1,71-16,17, p = 0,004), l’indice MIB-1 (HR = 1,18, IC 1,05-1,34, p = 0,008), les atypies nucléaires (HR = 5,24, IC 1,73-15,92, p = 0,003) et la STR (HR = 5,66, IC 1,30-13,92, p < 0,001 ; tableau 3). Les courbes de Kaplan-Meier mettant en évidence la survie sans récidive pour la localisation dans la fosse postérieure (p = 0,007), les atypies nucléaires (p = 0,137), l’étendue de la résection (p = 0,001) et le MIB-1 >4,5 % (p = 0,001) sont présentées dans les figures 1A-D.
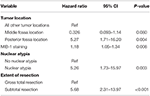
Tableau 3. Analyse de régression de Cox pour la récidive.

Figure 1. Courbes de Kaplan Meier des facteurs de risque de récidive des méningiomes de grade I de l’OMS. (A) Atypies nucléaires (ligne bleue) par rapport à l’absence d’atypies nucléaires (ligne rouge) (X2 = 2,21, p = 0,137). (B) Localisation de la tumeur dans la fosse postérieure (ligne bleue) par rapport aux autres localisations (ligne rouge) (X2 = 10,36, p = 0,001). (C) Indice MIB-1 >4,5 % (ligne bleue) vs. ≤4,5 % (ligne rouge) (X2 = 6,17, p = 0,013). (D) STR (ligne bleue) vs GTR (ligne rouge) (X2 = 10,46, p = 0,001).
Prédicteurs de récidive précoce vs post-médiane des méningiomes de grade I de l’OMS
Une comparaison entre les patients non récidivistes et les patients dont les tumeurs ont récidivé précocement ou post-médiane est présentée dans le tableau 4. Les patients présentant une récidive précoce avaient une incidence plus élevée de résection subtotale (76,9 vs 32,7%, p = 0,001). Ils avaient également tendance à présenter une incidence plus élevée d’atypies nucléaires (23,1 vs. 7,5 %, p = 0,084) à l’histopathologie (tableau 4). Les patients présentant une récidive post-médiane avaient tendance à avoir une incidence plus élevée de localisation tumorale dans la fosse postérieure (23,1 vs. 6,6 %, p = 0,063) et une incidence plus élevée d’invasion osseuse (38,5 vs. 16,9 %, p = 0,064) ainsi qu’un indice MIB-1 plus élevé (5,55 vs. 3,22 %, p = 0,098). Il n’y avait pas de différence significative entre le classement de Simpson ou les taux de RTG chez les patients présentant une récidive post-médiane par rapport aux patients non récidivistes (tableau 4).
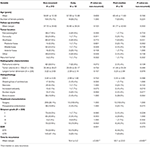
Tableau 4. Récidive précoce par rapport à la récidive post-médiane.
Deux modèles logistiques binaires de vraisemblance inverse multivariés ont été utilisés pour identifier les prédicteurs de la récidive précoce par rapport à la récidive post-médiane (tableau 5). Les prédicteurs indépendants de récidive tumorale précoce comprenaient les atypies nucléaires à l’histopathologie (OR = 6,45, IC 1,34-31,07, p = 0,020) et la STR (OR = 8,92, IC 2,18-36,46, p = 0,002). Le seul facteur prédictif indépendant de récidive post-médiane était l’indice MIB-1 (OR = 1,24, IC 1,05-1,45, p = 0,010), bien que la localisation dans la fosse postérieure ait approché la signification (OR = 4,42, IC 0,954-20,49, p = 0,058 ; tableau 5).

Tableau 5. Modèle logistique binaire pour la récidive tumorale post-médiane et précoce.
Analyse par partitionnement récursif de la récidive
L’APR a été réalisée pour identifier les principaux facteurs de risque de récidive des méningiomes (figure 2). Conformément à l’analyse de cox-régression, STR était la première partition lors de la prédiction de la récidive globale : 18,6% des patients avec une résection STR ont récidivé contre 6,5% avec une GTR. Le nœud décisionnel suivant au sein des seuls patients ayant subi une RTG impliquait un seuil de MIB-1 de 4,5 %, puisque 18,8 % des patients ayant un MIB-1 >4,5 % ont récidivé contre 3,3 % des patients ayant un MIB-1 ≤4,5 % (Figure 2A). En ce qui concerne spécifiquement la récidive post-médiane, le RPA a identifié le premier nœud de décision comme un seuil de MIB-1 de 5,83 % : 22,2 % des patients avec un MIB-1 >5,83 % ont récidivé contre 3,3 % des patients avec un MIB-1 ≤5,83 %. Le nœud de décision suivant a utilisé une localisation de la tumeur dans la fosse postérieure : 13,3 % des patients présentant une tumeur de la fosse postérieure ont récidivé contre 2,5 % pour les autres localisations tumorales (figure 2B). L’APR pour la récidive précoce a identifié l’étendue de la résection comme le nœud de décision primaire : 11,6 % des patients atteints de STR ont récidivé contre 2,0 % des patients atteints de GTR. Le nœud de décision suivant a été la localisation falx ou parasagittale : 36,4% des tumeurs falx ou parasagittales ont récidivé contre 8,1% des autres localisations tumorales (Figure 2C).
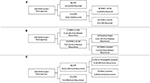
Figure 2. Analyse de partitionnement récursive mettant en évidence les facteurs de risque clés pour (A) la récidive globale, (B) la récidive post-médiane et (C) la récidive précoce.
Discussion
Résultats clés
La récidive des méningiomes de grade I de l’OMS est indépendamment associée à l’indice MIB-1, à la localisation de la tumeur dans la fosse postérieure, à la présence d’atypies nucléaires et à la STR. Plus précisément, un indice MIB-1 de 4,5 % a été identifié comme un seuil cliniquement pertinent pour la stratification du risque des patients atteints de méningiomes de grade I de l’OMS après une RTG. Les patients avec un indice MIB-1 >4,5% et une RTG de leur méningiome de grade I de l’OMS avaient un risque de récidive similaire à celui des patients avec une STR. Une analyse plus poussée a mis en évidence le MIB-1 comme un facteur critique associé à la récidive post-médiane, tandis que l’étendue de la résection était le principal moteur de la récidive précoce.
Prédicteurs de la récidive des méningiomes de grade I de l’OMS
Des études antérieures ont évalué de la même manière la relation entre les caractéristiques histopathologiques, les caractéristiques cliniques et la récidive dans tous les grades de méningiomes de l’OMS. Dans une étude portant sur 901 patients (716 de grade I de l’OMS, 174 de grade II et 11 de grade III), Gousias et al. démontrent un risque plus élevé de récidive dans les méningiomes ayant un indice MIB-1 >10%, un grade OMS plus élevé, une taille de tumeur >6 cm, une localisation pétroclivale ou de sinus caverneux, et une multiplicité (11). Cependant, Gousias et al. n’ont pas évalué la relation entre la présence de caractéristiques atypiques sur l’histologie et la récidive tumorale. Dans les méningiomes de grade I de l’OMS, Marciscano et al. ont utilisé une cohorte de 148 patients atteints de méningiomes de grade I de l’OMS avec une analyse pathologique complète pour identifier les variables associées à la récidive, en se concentrant sur l’impact des caractéristiques pathologiques atypiques sur le risque de récidive (9). De manière intéressante, ils identifient la présence de caractéristiques atypiques comme un facteur de risque indépendant en plus de l’indice MIB-1 >3% et de la résection de Simpson. Notre étude met également en évidence la RTG chirurgicale et l’atypie nucléaire, une caractéristique atypique, comme facteurs prédictifs indépendants de récidive (tableau 3), bien que nous ayons évalué chaque caractéristique atypique indépendamment. Nous prenons également en compte la localisation de la tumeur dans notre modèle de cox-régression, identifiant de plus la localisation de la tumeur dans la fosse postérieure comme un facteur de risque indépendant de récidive. Alors que Marciscano et al. n’ont pas inclus la localisation de la tumeur dans leur analyse des prédicteurs de la progression, Gousias et al. démontrent de manière similaire la localisation pétroclivale de la tumeur comme un facteur de risque de récidive, bien qu’en considérant tous les grades de méningiomes de l’OMS (9, 11). Le risque plus élevé de récidive associé à la localisation dans la fosse postérieure peut être dû à la prévalence accrue de mutations NF2 dans la fosse postérieure (14, 15, 20), bien que nous ne soyons pas en mesure d’explorer pleinement cette possibilité car nous ne réalisons pas systématiquement de tests génétiques des méningiomes dans notre institution. Quoi qu’il en soit, des études supplémentaires avec de plus grandes cohortes de patients atteints de méningiomes de grade I de l’OMS sont nécessaires pour étudier cette relation.
Indice MIB-1 et récidive des méningiomes de grade I de l’OMS
Similairement aux études précédentes (9, 11, 13, 21), nous avons ensuite également évalué la relation entre l’indice MIB-1 d’une tumeur et son risque de récidive. Nous avons d’abord évalué l’indice MIB-1 dans un modèle de cox-régression pour la récidive globale, comme discuté précédemment. En accord avec les études précédentes, nous avons constaté qu’un indice MIB-1 plus élevé était indépendamment associé à un risque global accru de récidive. Compte tenu des divergences entre les valeurs seuils du MIB-1 dans la littérature et de la variabilité inter-laboratoires, nous avons d’abord évalué le MIB-1 comme une variable continue. Nous avons ensuite cherché à déterminer le seuil de l’indice MIB-1 dans notre population de patients en utilisant l’APR pour modéliser la récidive globale, ce qui a permis d’identifier une valeur seuil de MIB-1 de 4,5 % chez les patients atteints de RTG (Figure 2A). Il est intéressant de noter que ces patients présentaient un risque de récidive similaire à celui des patients présentant une STR, ce qui démontre l’utilité du MIB-1 chez les patients ayant subi une RTG. Perry et al. identifient également un indice MIB-1 de 4,2 % comme associé à une récidive après une RTG sur une analyse univariée, bien qu’en considérant tous les grades de méningiomes (22).
Le taux de récidive de 18,8 % chez les patients avec une RTG et un MIB-1 >4,5 %, souligne la nécessité d’une surveillance étroite de ces patients ou même la considération d’une radiothérapie adjuvante, selon la préférence du patient. Il a été démontré que la radiothérapie adjuvante après résection d’un méningiome de grade I de l’OMS réduit la récidive, en particulier après une STR (23-25), bien que l’observation après une STR reste la pratique standard (8). Dans une étude portant sur 92 méningiomes de grade I de l’OMS, Soyuer et al. ont démontré une survie sans progression (SSP) de 91% chez les patients ayant reçu une radiothérapie adjuvante après une STR, ce qui était significativement plus élevé que la SSP de 38% chez les patients n’ayant pas reçu de radiothérapie adjuvante (24). Comme les patients de notre étude ayant subi une STR présentaient un risque de récidive similaire à ceux ayant subi une GTR et un MIB-1 >4,5 %, une radiothérapie adjuvante pour les deux groupes peut être raisonnable. Cependant, des études plus importantes sont nécessaires pour valider davantage notre seuil de MIB-1 et les implications cliniques associées. Des études prospectives portant sur l’utilisation de la radiothérapie adjuvante dans les méningiomes de grade I de l’OMS sont également nécessaires.
Prédicteurs de récidive précoce et post-médiane des méningiomes de grade I de l’OMS
Compte tenu de la tendance à une récidive plus tardive chez les patients ayant un MIB élevé >4.5% (Figure 1C), nous avons ensuite cherché à étudier les différences de prédicteurs entre les patients qui ont récidivé précocement (définis comme dans les 2 ans suivant le traitement) ou après la médiane (ceux qui ont récidivé >2 ans après le traitement). Peu d’études dans la littérature se sont penchées sur les prédicteurs de la récidive précoce des méningiomes. Une étude de Budohoski et al. identifie la localisation parafalque, la STR et l’œdème péritumoral sur l’imagerie radiographique comme des facteurs prédictifs de récidive précoce dans une cohorte de 220 méningiomes atypiques (26). Une étude similaire menée par Maillo et al. sur des méningiomes de grade I de l’OMS, utilise l’hybridation in situ en fluorescence (FISH) interphasique et les caractéristiques pathologiques pour identifier les facteurs de risque de récidive précoce (définie comme 2,5 ans après le traitement) et a trouvé qu’une taille de tumeur plus importante, des anomalies du caryotype, l’âge du patient et des anomalies du chromosome 10 étaient associés à un risque accru de récidive (19). Cependant, les auteurs n’ont pas pris en compte la présence d’atypies sur la pathologie ou l’indice MIB-1. En utilisant une cohorte de patients atteints de méningiomes de grade I de l’OMS avec des données pathologiques et cliniques plus granulaires, nous avons identifié l’étendue de la résection et l’atypie nucléaire sur la pathologie comme des prédicteurs indépendants de récidive précoce sur une modélisation de régression logistique binaire (Tableau 5). L’APR a également révélé l’importance de l’étendue de la résection dans la stratification du risque de récidive précoce chez les patients (figure 2C). Il est intéressant de noter qu’elle a également mis en évidence le risque accru associé à la localisation falx/parasagittale de la tumeur, ce qui correspond aux résultats de Budohoski et al. (26). Le seul facteur prédictif significatif de récidive tumorale post-médiane dans la modélisation de régression logistique binaire était l’indice MIB-1, bien que la localisation de la tumeur dans la fosse postérieure ait approché la signification. Ceci a été démontré par l’APR (Figure 2B). De manière surprenante, l’étendue de la résection n’était pas un facteur prédictif indépendant de récidive post-médiane, car la majorité des récidives post-médianes avaient subi une RTG. Les récidives post-médianes peuvent mettre en évidence une catégorie de méningiomes de grade I de l’OMS qui est moléculairement plus agressive et qui récidive malgré une RTG, étant donné leur indice MIB-1 élevé et leur localisation dans la fosse postérieure. Les récurrences précoces sont significativement plus affectées par l’étendue de la résection et, par conséquent, représentent probablement la croissance continue de la tumeur résiduelle par opposition à la récurrence d’une tumeur antérieure complètement réséquée, comme on le voit dans les récurrences post-médianes. Ainsi, nos résultats représentent potentiellement deux sous-types moléculaires différents de méningiomes de grade I de l’OMS. Cependant, des études futures avec des cohortes de patients plus importantes et des données tumorales moléculaires sont nécessaires pour étudier plus en détail les différences sous-jacentes dans les altérations moléculaires entre les récidives précoces et post-médianes.
Limitations
Les limites de notre étude incluent sa nature rétrospective et la faible incidence de récidive. Notre étude inclut également des patients à partir de 2007 et, par conséquent, couvre à la fois les schémas de classification du SNC de l’OMS de 2007 et de 2016. Cependant, le seul changement significatif entre les deux classifications est l’ajout de l’invasion cérébrale comme critère unique pour le statut de grade II de l’OMS. Seuls deux des patients inclus dans notre cohorte présentaient une invasion cérébrale constatée lors de l’analyse pathologique, et aucun des patients n’a récidivé. Par conséquent, nous ne pensons pas que l’inclusion de patients classés selon le schéma de classification de 2007 ait eu un impact significatif sur nos résultats. En outre, notre étude s’appuie sur les rapports pathologiques après la résection initiale, sans un réexamen central des lames pathologiques. Cela peut conduire à une variabilité accrue des variables pathologiques, telles que les atypies nucléaires et autres résultats pathologiques similaires qui peuvent démontrer une variabilité inter-observateur (27, 28). Cependant, le MIB-1 est une mesure relativement objective avec une variabilité inter-observateur plus faible entre les pathologistes utilisant la même méthode dans un laboratoire de pathologie (29). Les modèles de pratique concernant le test MIB-1 ont également changé au cours de la période de l’étude, passant de la préférence individuelle du pathologiste, qui variait selon le pathologiste, au test chez tous les patients. Les facteurs pris en compte par les pathologistes pour décider du test MIB-1 comprenaient les caractéristiques atypiques incluses dans notre étude, minimisant ainsi leur impact potentiel sur nos résultats. En outre, tous les méningiomes inclus dans notre étude sont de grade I de l’OMS. Par conséquent, nous pensons que tout biais introduit dans l’étude sur la base de ces changements dans les pratiques est minime. Enfin, bien que nous incluions des caractéristiques cliniques et pathologiques détaillées, notre cohorte de patients manque d’informations concernant les changements génétiques et moléculaires de la tumeur, dont il a été démontré qu’ils ont un impact significatif sur les résultats de la tumeur (15, 30-32). Ainsi, il reste nécessaire de mener d’autres grandes études multi-institutionnelles avec des données moléculaires/génétiques en plus des variables pathologiques et cliniques traditionnelles pour prédire la récidive globale des méningiomes de grade I de l’OMS. Cela inclut la prise en compte des pronostics moléculaires/génétiques, tels que les schémas de méthylation à l’échelle du génome (33, 34), les mutations du promoteur TERT (35), et des données moléculaires tumorales supplémentaires étant donné nos résultats, des enquêtes futures sur les prédicteurs génétiques/moléculaires, cliniques et pathologiques uniques des récidives précoces et ultérieures sont également justifiées, étant donné l’impact potentiel sur la prise de décision thérapeutique par les médecins.
Néanmoins, notre étude fournit un aperçu détaillé des prédicteurs cliniques et histopathologiques de la récidive, spécifiquement dans les méningiomes de grade I de l’OMS. En outre, nous identifions les patients avec un MIB-1 >4,5% comme étant à haut risque de récidive après une RTG. Nous exploitons également nos données pour fournir un aperçu des différences entre les récidives précoces et post-médianes des méningiomes de grade I de l’OMS, identifiant potentiellement différents sous-groupes moléculaires de méningiomes de grade I de l’OMS. Nos résultats suggèrent que les patients présentant un indice MIB-1 élevé et des atypies nucléaires à l’analyse pathologique, une localisation de leur tumeur dans la fosse postérieure et une STR présentent un risque plus élevé de récidive et devraient être considérés pour un suivi plus étroit, voire une radiothérapie adjuvante. De plus, les patients avec un MIB-1 supérieur à 4,5% ont un risque de récidive similaire à ceux qui ont subi une STR de leur tumeur et devraient aussi potentiellement être considérés pour une radiothérapie adjuvante.
Conclusion
Il reste une rareté de la littérature sur les prédicteurs spécifiques de récidive dans les méningiomes de grade I de l’OMS. Les résultats de cette étude mettent en évidence la localisation de la tumeur dans la fosse postérieure, l’indice MIB-1, les atypies nucléaires et l’étendue de la résection comme étant indépendamment associés à la récidive des méningiomes de grade I. Nous démontrons également que les patients avec un MIB-1 >4,5% et une GTR ont un risque de récidive similaire à celui des patients avec une STR. Enfin, l’analyse différentielle des récidives précoces et post-médianes a révélé l’association de l’indice MIB-1 et de la localisation dans la fosse postérieure dans les récidives post-médianes, alors que les récidives précoces étaient plus significativement impactées par l’étendue de la résection. Des études supplémentaires validant nos résultats et incluant des données moléculaires/génétiques sont nécessaires pour identifier des prédicteurs supplémentaires de récidive dans les méningiomes de grade I de l’OMS. De telles études pourraient fournir un cadre plus précis pour stratifier les risques des patients et aider à la prise de décision thérapeutique, y compris le potentiel de radiothérapie adjuvante.
Data Availability Statement
Les données brutes soutenant les conclusions de cet article seront mises à disposition par les auteurs, sans réserve indue.
Ethics Statement
Les études impliquant des participants humains ont été examinées et approuvées par le conseil d’examen institutionnel de l’UCSF. Le consentement éclairé écrit pour la participation n’était pas requis pour cette étude, conformément à la législation nationale et aux exigences institutionnelles.
Contributions des auteurs
AH : conceptualisation, méthodologie, analyse formelle, enquête, rédaction – version originale, rédaction – révision et édition, et visualisation. JY : conceptualisation, méthodologie, et rédaction-révision et édition. IK et SS : enquête. J-SC : visualisation et analyse formelle. DR et MM : rédaction-révision et édition. SM : rédaction-révision et édition, conceptualisation et méthodologie. MA : rédaction-révision et édition, et supervision. Tous les auteurs ont contribué à l’article et ont approuvé la version soumise.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Le réviseur BB a déclaré une coaudition passée avec les auteurs DR, MM et SM au rédacteur en chef de traitement.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. Rapport statistique CBTRUS : tumeurs cérébrales primaires et autres tumeurs du système nerveux central diagnostiquées aux États-Unis en 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi : 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Gestion médicale des méningiomes. Current status, failed treatments, and promising horizons. Neurosurg Clin N Am. (2016) 27:249-60. doi : 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi : 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. La classification 2016 de l’Organisation mondiale de la santé des tumeurs du système nerveux central : un résumé. Acta Neuropathol. (2016) 131:803-20. doi : 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Long-term 25-year follow-up of surgically treated parasagittal meningiomas. World Neurosurg. (2011) 76:564-71. doi : 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Altération de la survie et problèmes neurologiques à long terme dans le méningiome bénin. Neuro Oncol. (2012) 14:658-66. doi : 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. Un aperçu des méningiomes. Futur Oncol. (2018) 14:2161-77. doi : 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Méningiomes : base de connaissances, résultats du traitement et incertitudes. A RANO review. J Neurosurg. (2015) 122:4-23. doi : 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Benign meningiomas (WHO Grade I) with atypical histological features : correlation of histopathological features with clinical outcomes. J Neurosurg. (2016) 124:106-14. doi : 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Brain invasion in otherwise benign meningiomas does not predict tumor recurrence. Acta Neuropathol. (2016) 132:479-81. doi : 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited : aggressive surgery and its place in modern meningioma management. J Neurosurg. (2016) 125:551-60. doi : 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Analyse clinique et histopathologique des potentiels prolifératifs des méningiomes récurrents et non récurrents. Acta Neuropathol. (1996) 91:504-10. doi : 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Significance of Simpson grading system in modern meningioma surgery : integration of the grade with MIB-1 labeling index as a key to predict the recurrence of WHO Grade I meningiomas – clinical article. J Neurosurg. (2012) 117:121-8. doi : 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Genetic landscape of meningioma. Brain Tumor Pathol. (2016) 33:237-47. doi : 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Potentiel clinique des connaissances génomiques sur les méningiomes : un examen pratique pour les neurochirurgiens. Neurosurg Focus. (2018) 44:E10. doi : 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molecular profiling predicts meningioma recurrence and reveals loss of DREAM complex repression in aggressive tumors. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi : 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion in meningiomas : incidence and correlations with clinical variables and prognosis. World Neurosurg. (2016) 93:346-54. doi : 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. L’évaluabilité de l’invasion cérébrale dans les méningiomes est liée à la taille et au grade du méningiome, et peut être améliorée par un échantillonnage étendu de la pièce de méningiome enlevée chirurgicalement. Clin Neuropathol. (2014) 33:354-63. doi : 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Early recurrences in histologically benign/grade I meningiomas are associated with large tumors and coexistence of monosomy 14 and del(1p36) in the ancestral tumor cell clone. Neuro Oncol. (2007) 9:438-46. doi : 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlations between genomic subgroup and clinical features in a cohort of more than 3000 meningiomas. J Neurosurg. (2019). doi : 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopathological features predictive of local control of atypical meningioma after surgery and adjuvant radiotherapy. J Neurosurg. (2019) 130:443-50. doi : 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. La signification pronostique de la cytométrie de flux de MIB-1, p53 et ADN dans les méningiomes primaires complètement réséqués. Cancer. (1998) 82:2262-9. doi : 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Long-term surgical outcome and biological prognostic factors in patients with skull base meningiomas : clinical article. J Neurosurg. (2011) 114:1278-87. doi : 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Radiotherapy after surgery for benign cerebral meningioma. Radiother Oncol. (2004) 71:85-90. doi : 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Risk group-adapted adjuvant radiotherapy for WHO grade I and II skull base meningioma. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi : 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predictors of early progression of surgically treated atypical meningiomas. Acta Neurochir. (2018) 160:1813-22. doi : 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Caractéristiques histopathologiques prédisant la récurrence des méningiomes après une résection subtotale. Am J Surg Pathol. (1986) 10:836-43. doi : 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. Le spectre histopathologique des méningiomes humains. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. Méthodes de comptage du MIB-1 dans les méningiomes et accord entre les pathologistes. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Altérations génétiques associées à la progression et à la récurrence des méningiomes. J Neuropathol Exp Neurol. (2012) 71:882-93. doi : 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Déterminations biologiques moléculaires de la progression et de la récurrence des méningiomes. PLoS ONE. (2014) 9:e94987. doi : 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Changements génétiques avec valeur pronostique dans les méningiomes histologiquement bénins. Clin Neuropathol. (2013) 32:311-7. doi : 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. DNA methylation in the malignant transformation of meningiomas. PLoS ONE. (2013) 8:e54114. doi : 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Methylation markers of malignant potential in meningiomas. J Neurosurg. (2013) 119:899-906. doi : 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. La signification pronostique des mutations du promoteur TERT dans le méningiome : une revue systématique et une méta-analyse. J Neurooncol. (2019) 142:1-10. doi : 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar
.