L’encéphalopathie traumatique chronique (ETC) est une maladie neurodégénérative distincte associée à la protéine tau. On constate une augmentation du nombre de diagnostics de CTE chez les athlètes, en particulier les joueurs de football américain, ainsi que chez les vétérans militaires en situation de combat (1, 2). Bien que le CTE ait été reconnu publiquement relativement récemment, il a été décrit pour la première fois comme le syndrome de l' »ivresse du punch » dans un article classique de Martland et al. (3). Le rapport portait sur un certain nombre de boxeurs qui avaient subi des coups répétés à la tête tout au long de leur carrière et qui présentaient à la fois des symptômes psychiatriques et de graves déficits de mémoire et neurocognitifs, analogues à ceux des patients atteints de démence typique (3). La nomenclature de la maladie a évolué en « dementia pugilistica » (4), et finalement en CTE en 1949 (5).
La CTE présente une caractéristique neuropathologique unique, composée d’une accumulation de tau phosphorylée (p-tau) dans les sillons et les régions péri-vasculaires, d’une microgliose et d’une astrocytose. Ces changements pathologiques entraînent une neurodégénérescence débilitante progressive. Sur la base du schéma de progression pathologique, le TCE est divisé en quatre stades respectifs (figure 1). Au stade I du TCE, le cerveau semble normal, mais on trouve du p-tau dans un nombre limité de sites, souvent dans les cortex latéraux et frontaux, ainsi qu’à proximité de petits vaisseaux sanguins dans la profondeur des sillons. Il peut y avoir un petit nombre d’enchevêtrements neurofibrillaires (ENF) et de neurites dans le locus coeruleus. Au stade II, on peut noter des anomalies macroscopiques localisées. Sur les coupes anatomiques macroscopiques et la neuro-imagerie, on observe un élargissement des ventricules latéraux, un cavum septum pellucidum avec ou sans fenestration, ainsi qu’une pâleur du locus coeruleus et de la substantia nigra. Il y a de multiples foyers de p-tau dans la profondeur des sillons, et il y a un modèle de propagation émergent. Au stade III, la plupart des coupes pathologiques montrent des anomalies macroscopiques. On observe une perte de poids globale du cerveau, une légère atrophie du lobe frontal et du lobe temporal, et une dilatation des ventricules. La moitié des patients atteints de TCE présentent des anomalies septales, notamment un cavum septum pellucidum. La pathologie du P-tau s’étend, impliquant les cortex frontal, temporal, pariétal et insulaire. Au stade IV, la réduction du poids du cerveau est spectaculaire, et des poids cérébraux de 1 000 g (contre 1 300-1 400 g pour les cerveaux normaux) ont été signalés. On observe une atrophie profonde des lobes frontal et temporal médian, ainsi que du thalamus antérieur. On observe également une atrophie des voies de la substance blanche. La majorité des patients du stade quatre présentent des anomalies septales. La propagation du p-tau touche la plupart des régions, y compris le cortex calcarin (7, 8). Des anomalies de la protéine de liaison à l’ADN TAR 43 kDa phosphorylée (TDP-43) sont également observées chez la plupart des patients atteints de TCE. La pathologie parenchymateuse de la TDP-43 est également de nature progressive, comme le modèle anatomique de propagation du p-tau. L’immunoréactivité du TDP-43 est trouvée dans presque tous les cas de maladie de stade IV (7).

Figure 1. Les images ci-dessus sont la représentation des quatre stades de McKee de l’ETC .
Le phénotype clinique de l’ETC n’est pas encore clairement défini. Les paragraphes suivants décrivent les tentatives de caractérisation des symptômes de l’ETC aux différents stades du processus pathologique (tableau 1). Selon la classification de McKee, au stade I, le patient typique du TCE est asymptomatique, ou peut se plaindre de légers déficits de mémoire à court terme et de symptômes dépressifs. Une légère agressivité peut être observée. Au stade II, les symptômes d’humeur et de comportement peuvent inclure des accès de colère et des symptômes dépressifs plus graves. Au stade III, les patients présentent généralement des déficits cognitifs plus importants, notamment des pertes de mémoire, des déficits des fonctions exécutives, un dysfonctionnement visuospatial et une apathie. Au stade IV, les patients présentent des déficits avancés du langage, des symptômes psychotiques dont la paranoïa, des déficits moteurs et du parkinsonisme.
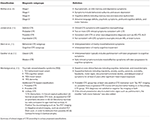
Tableau 1. Classifications cliniques proposées pour le TEC.
Jordan et al. (10) ont été l’un des premiers à caractériser cliniquement la maladie. Ils ont divisé les présentations cliniques de l’ETC en trois domaines : comportemental/psychiatrique, cognitif et moteur. Le domaine comportemental et psychiatrique comprend l’agression, la dépression, l’apathie, l’impulsivité, les délires, y compris la paranoïa, et la suicidalité. Le domaine cognitif comprend la diminution de l’attention et de la concentration, les déficits de mémoire, les déficits des fonctions exécutives, les dysfonctionnements visuospatiaux, les déficits de langage et la démence. Enfin, les caractéristiques motrices comprenaient la dysarthrie, les anomalies de la démarche, l’ataxie et l’incoordination, la spasticité et les caractéristiques du parkinsonisme telles que les tremblements. Sur la base de ces caractéristiques cliniques, ainsi que des informations neuropathologiques existantes, quatre sous-types de diagnostic ont été définis, à savoir l’ETC « certain », l’ETC « probable », l’ETC « possible » et l’ETC « improbable ».
Stern et al. (11), et des rapports de cas connexes (14, 15), diffèrent dans leur description d’un patient ETC typique, en conceptualisant la présentation clinique en deux sous-types distincts. Le premier sous-type présentait principalement des changements de comportement et d’humeur, tandis que l’autre présentait principalement des troubles cognitifs. La grande majorité des patients du sous-type humeur/comportement ont développé des déficits cognitifs à mesure que la maladie progressait. Cependant, relativement peu de patients du groupe cognitif ont présenté des altérations de l’humeur ou du comportement au cours de leur maladie. Dans l’étude de Stern et al. (11), les patients du groupe cognitif avaient une probabilité significativement plus élevée de développer une démence. Ils étaient également beaucoup plus âgés au moment du diagnostic que les patients du groupe humeur/comportement. Le sous-groupe comportemental des patients atteints de TCE peut ressembler aux patients souffrant de la variante comportementale de la démence frontotemporale (bvFTD), ce qui rend le diagnostic clinique plus difficile. Cependant, les manifestations comportementales typiques de la variante frontotemporale de la démence, telles que l’apathie et la désinhibition, ne sont souvent pas observées chez les patients atteints de TCE (11, 16). Compte tenu de l’hétérogénéité inhérente à la bvFTD, ainsi que de la nature tauopathique similaire des deux maladies, distinguer la bvFTD de la CTE pose un défi diagnostique.
Parmi les symptômes comportementaux de la CTE, l’association entre le suicide et la CTE reste un sujet examiné de près dans la littérature. Des études antérieures, comme la série de cinq athlètes professionnels avec un diagnostic confirmé de CTE rapportée par Omalu et al. (17), avaient suggéré une forte relation entre CTE et suicide. Les auteurs ont également suggéré que l’étiologie du comportement suicidaire/parasuicidaire dans la population CTE pourrait être en partie due à la tauopathie sous la forme d’enchevêtrements neurofibrillaires et de fils neuritiques dans les noyaux stratégiques du cerveau limbique tels que le locus ceruleus. Maroon et al. (18) ont examiné 153 cas d’ETC confirmés par des examens pathologiques et publiés entre 1954 et 2013. Ils ont rapporté que la prévalence du suicide dans la population TCE et des décès accidentels était de 11,7 et 17,5 %, ce qui est significativement plus élevé que les niveaux de la population générale de 1,5 et 4,8 %, respectivement (18). Les partisans de l’opinion opposée suggèrent que les suicides ont été principalement rapportés dans les stades précoces de l’ETC, et que l’association entre la progression de la maladie et le suicide reste peu claire à l’heure actuelle (19).
Dans une méta-analyse de 158 études de cas par Gardner et al. (12), les symptômes cliniques de l’ETC ont été divisés en symptômes d’ETC « classiques » et « modernes », afin d’établir une distinction entre une description plus ancienne des cas d’ETC centrée principalement sur les boxeurs par rapport à une description clinique plus évoluée qui s’applique également aux joueurs de football américain professionnels. Alors que les symptômes « classiques » de l’ETC comprenaient généralement la dysarthrie, les difficultés de mouvement et, plus tard, des déficits de mémoire, le tableau « moderne » de l’ETC comprend également des symptômes neuropsychiatriques, tels que des symptômes dépressifs, la paranoïa, le retrait et l’isolement social, l’altération du jugement et l’agressivité. Les déficits cognitifs tels que le déclin de la mémoire, le dysfonctionnement exécutif, le langage et les déficits de traitement de l’information apparaissent plus tard au cours du processus pathologique (12).
Comme la définition du TCE dépend principalement des caractéristiques pathologiques, il existe un terme clinique alternatif proposé de syndrome d’encéphalopathie traumatique (SET) par Montenigro et al. (13), décrivant les séquelles cliniques des TBI répétitifs. Les auteurs ont basé cette classification sur une revue de 202 cas publiés. Le TES est un diagnostic plus global et peut être subdivisé en quatre sous-catégories, dont la variante comportementale/de l’humeur du TES, la variante cognitive du TES, la variante mixte du TES et la démence du TES. Le diagnostic de TES proposé est basé sur l’existence de cinq critères généraux, trois caractéristiques cliniques essentielles et neuf caractéristiques de soutien. En utilisant les biomarqueurs* existants (tableau 1), des qualificatifs diagnostiques supplémentaires ont été proposés, notamment « Probable », « Possible » et « Improbable » (9, 13). Le diagnostic de TES proposé contenait également des qualificatifs temporels et comprenait « évolution progressive », « évolution stable » et « évolution inconnue/inconsistante ». Si la présentation clinique incluait également des signes moteurs tels que le parkinsonisme, le modificateur « avec des caractéristiques motrices » était également ajouté.
Alors que notre compréhension du TCE s’accroît, il existe un certain nombre de défis et de critiques qui doivent être abordés. Une hypothèse alternative au phénomène du TCE est la théorie de la diminution de la « réserve cognitive ». Selon cette théorie, les neurotraumatismes répétés entraînent une réduction de la réserve cognitive et une accélération du développement d’un trouble neurodégénératif sous-jacent (20, 21). Si cette théorie se vérifiait, elle impliquerait que le TCE et la MA se situent sur le même spectre neuropathologique. Cette affirmation mérite une analyse plus approfondie. Comme dans le cas de la maladie d’Alzheimer, les isoformes Tau dans le TCE consistent également en un mélange d’isoformes à trois répétitions (3R) et à quatre répétitions (4R). Cependant, selon un rapport récent de Falcon et al. (22), les filaments de tau extraits du cerveau des patients atteints du TCE contiennent également une région unique d’hélice ß avec une cavité hydrophobe, qui n’est pas présente dans le cerveau des patients atteints de la MA. Cette cavité contient un cofacteur supplémentaire qui jouerait un rôle fonctionnel dans la propagation de la protéine tau. Falcon et al. (22) suggèrent que la localisation des inclusions de tau à proximité des vaisseaux sanguins, suggère que les cofacteurs nécessaires à l’assemblage de tau peuvent traverser la barrière hémato-encéphalique après un traumatisme crânien. Les auteurs affirment en outre que le fait que le traumatisme cérébral ne conduise à l’ETC que dans un sous-groupe de la population blessée pourrait être lié à un niveau plus élevé de cofacteurs chez les individus les plus sensibles. Ces cofacteurs pourraient constituer une cible thérapeutique pour la prévention de l’assemblage de la protéine tau et le développement de l’ETC après une blessure (22).
Une autre théorie propose que les symptômes psychiatriques tels que la dépression et la colère rapportés chez les patients atteints d’ETC sont indépendants du processus pathologique de l’ETC et sont rapportés de manière cofondée. Les partisans de cette hypothèse ont cité des études antérieures telles que celle rapportée par Weir et al. (23), dans laquelle on a demandé à 1 063 anciens joueurs de la NFL s’ils avaient connu des accès de colère. Il a été rapporté que 30,7 % des joueurs âgés de 30 à 49 ans et 29,3 % des joueurs âgés de 50 ans ou plus ont signalé des accès de colère. Cependant, les auteurs ont également noté que les mesures de colère rapportées étaient effectivement inférieures à celles rapportées pour la population générale des États-Unis, qui étaient de 54,8 % pour les hommes âgés de 30 à 49 ans et de 47,2 % pour les hommes âgés de plus de 50 ans (23). Bien que les arguments relatifs à la comorbidité des symptômes psychiatriques et des maladies neurodégénératives telles que le CTE, soient difficiles à vérifier sur la base des résultats de la neuroimagerie et de la neuropathologie, on peut appliquer des arguments similaires aux symptômes psychiatriques de toute maladie neurodégénérative telle que la MA, la bvFTD, la maladie de Parkinson (PD) ou la sclérose latérale amyotrophique (SLA).
Une autre source importante de confusion diagnostique est la délimitation clinique entre le CTE et le syndrome post-commotionnel prolongé (PCS), en particulier compte tenu des rapports antérieurs indiquant que ~10-20% des individus qui souffrent de commotions cérébrales, présentent des symptômes prolongés. Le syndrome post-commotionnel chronique (SPC) désigne la persistance des symptômes du SPC entraînant une altération des performances fonctionnelles et souvent sportives pendant plus d’un an. Les symptômes du SCPC comprennent des maux de tête, des vertiges, des troubles de l’attention, de la mémoire et des fonctions exécutives, ainsi que des symptômes de dépression et d’irritabilité (10). King et Kirkwilliam ont inventé le terme « PCS permanent » pour désigner les personnes dont les symptômes de PCS persistent en moyenne 6,9 ans après la commotion initiale. De plus, ils ont rapporté qu’un nombre significatif de patients atteints de SCP permanent (40-59%) présentaient également des conditions neuropsychiatriques prémorbides ou postmorbides telles que la dépression, l’anxiété, le PTSD, et/ou la douleur (24). Comme le soutiennent Jordan et al. (10), le SCPC se distingue cliniquement du TCE par sa relation temporelle avec la commotion aiguë. Une histoire temporelle complète et précise reste essentielle dans l’évaluation neurologique. En outre, la céphalée est une caractéristique essentielle du syndrome de Creutzfeldt-Jakob, mais elle n’est pas souvent signalée dans le cas du TCE. Bien que cela soit discutable, les patients des stades I et II de McKee pourraient présenter des céphalées, ce qui ajoute encore à la complexité du chevauchement possible de la CTE & CPCS (9). Le diagnostic du CPCS reste controversé, car il n’est pas clair s’il est de nature tauopathique. Par conséquent, les lignes de démarcation entre le CPCS et les caractéristiques cliniques des stades I et II de McKee ne sont pas totalement solidifiées.
Des prédispositions génétiques claires au TCE n’ont pas été rapportées. Cependant, le gène ApoE4, le facteur de risque le plus connu de la maladie d’Alzheimer (25), a été associé à des déficits cognitifs plus importants et à une période de récupération plus longue après une lésion cérébrale traumatique (TBI) (11). Une étude sur un groupe de boxeurs a rapporté des résultats plus graves chez les individus porteurs d’au moins un allèle ApoE4 (26). À l’inverse, l’ApoE3 pourrait conférer une neuroprotection, même en présence d’une pathologie progressive du TCE (15). Un autre facteur de protection proposé, associé à une récupération post-TBI plus favorable, est la réserve cognitive, mesurée par le QI prémorbide et le volume intracrânien total (27). D’autres candidats génétiques à étudier plus avant comprennent le gène de la protéine tau associée aux microtubules (MAPT), le gène de la progranuline (GRN) et le gène du cadre de lecture ouvert 72 du chromosome neuf (C9ORF72) (11).
La synergie pathologique de la tauopathie et de la neuroinflammation est de plus en plus reconnue. On pense que la sécrétion extracellulaire de tau hyperphosphorylée active la microglie et les astrocytes, entraînant la production de cytokines pro-inflammatoires telles que l’IL1ß, et le TNFa, entraînant à son tour l’activation de tau kinases telles que p38 et cdk5, et une nouvelle phosphorylation de tau. Ce processus crée un cycle vicieux perpétuel de tauopathie et de neuroinflammaion (28). Étant donné la forte association entre les lésions cérébrales traumatiques répétées et le risque de TCE (1), un traitement opportun des TBI pourrait diminuer le développement de la TCE. La nature pro-inflammatoire du TBI a déjà été signalée (13), et des agents anti-inflammatoires tels que la minocycline associée à la N-acétylcystéine, un puissant antioxydant, administrés dans des fenêtres temporelles aiguës à subaiguës après le TBI, offrent un régime thérapeutique prometteur (29, 30). Le développement d’un protocole sensible au temps, ressemblant à l’algorithme de traitement de l’accident vasculaire cérébral ischémique, permettrait potentiellement de mesurer les résultats à long terme dans la récupération post-TBI et la prévention du développement de la pathologie CTE ultérieure (29).
Il n’existe actuellement aucun médicament modifiant la maladie pour le CTE, ce qui fait de la prévention le moyen le plus efficace de lutter contre cette maladie neurodégénérative débilitante (31). Compte tenu de la fréquence des chocs à la tête dans les sports de contact comme le football américain, la prévention des traumatismes crâniens nécessitera un changement culturel dans la façon dont ce sport est enseigné et pratiqué. La formation à des techniques de pratique sûres, telles que le plaquage et la frappe en toute sécurité, tout en pénalisant les coups imprudents, offrira des avantages mesurables. D’autres changements doivent inclure la création d’un environnement de sécurité, dans lequel les joueurs sont encouragés à signaler leurs symptômes aux arbitres, aux entraîneurs ainsi qu’aux médecins de l’équipe. En outre, l’établissement d’un profil neurocognitif de base pourrait servir de marqueur de référence clinique pour suivre l’évolution de la présentation neuropsychiatrique des joueurs. Il incombe aux médecins d’équipe de retirer du terrain les joueurs qui ont subi un TBI, même léger et non compliqué, afin de procéder à une évaluation plus approfondie (32).
Il existe un certain nombre de défis liés au TCE à relever. Bien que l’incidence des commotions cérébrales liées au sport soit comprise entre 1,6 et 3,8 millions, l’incidence et la prévalence du TCE restent largement inconnues (33). Cette méconnaissance s’explique peut-être par le fait que les athlètes exposés à des chocs subconcussifs cumulatifs, qui exercent une force suffisante pour provoquer des lésions neuronales mais ne présentent pas de symptômes cliniques manifestes au départ, ne sont souvent pas évalués ou diagnostiqués à temps (34). Des études prospectives à grande échelle, telles que le suivi d’athlètes ayant subi plusieurs TBI sur une période prédéfinie, permettraient de mieux comprendre l’évolution naturelle et la phénoménologie de la maladie. L’ETC est de plus en plus sous les feux de la rampe dans les médias. Des efforts continus sont nécessaires pour diagnostiquer, évaluer et traiter cette maladie dévastatrice. L’avancement exponentiel des techniques de neuro-imagerie et la compréhension des mécanismes neuropathologiques de la maladie conduiront à un diagnostic plus précoce et à des interventions thérapeutiques opportunes.
Contributions de l’auteur
L’auteur confirme être le seul contributeur de ce travail et l’a approuvé pour publication.
Déclaration de conflit d’intérêts
L’auteur déclare que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
L’auteur reconnaît le grand soutien, les conseils et le mentorat du Dr Stephen Strittmatter.
1. McKee AC, Cantu RC, Nowinski CJ, Hedley-Whyte ET, Gavett BE, Budson AE, et al. Chronic traumatic encephalopathy in athletes : progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. (2009) 68:709-35. doi : 10.1097/NEN.0b013e3181a9d503
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Goldstein LE, Fisher AM, Tagge CA, Zhang XL, Velisek L, Sullivan JA, et al. Encéphalopathie traumatique chronique chez les vétérans militaires exposés aux explosions et un modèle de souris neurotraumatisées par les explosions. Sci Transl Med. (2012) 4:134ra60. doi : 10.1126/scitranslmed.3003716
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Martland H. Dementia pugilistica. JAMA. (1928) 91:364-65. doi : 10.1001/jama.1928.02700150029009
CrossRef Full Text | Google Scholar
4. Millspaugh J. Dementia pugilistica. US Naval Med Bull. (1937) 35:303.
Google Scholar
5. Critchley M. Hommage à Clovis Vincent. Paris : Maloine (1949).
Google Scholar
6. Mez J, Daneshvar DH, Kiernan PT, Abdolmohammadi B, Alvarez VE, Huber BR, et al. Évaluation clinicopathologique de l’encéphalopathie traumatique chronique chez les joueurs de football américain. JAMA. (2017) 318:360-70. doi : 10.1001/jama.2017.8334
PubMed Abstract | CrossRef Full Text | Google Scholar
7. McKee AC, Stein TD, Kiernan PT, Alvarez VE. La neuropathologie de l’encéphalopathie traumatique chronique. Brain Pathol. (2015) 25:350-64. doi : 10.1111/bpa.12248
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKee AC, Cairns NJ, Dickson DW, Folkerth RD, Keene CD, Litvan I, et al. La première réunion de consensus NINDS/NIBIB pour définir les critères neuropathologiques pour le diagnostic de l’encéphalopathie traumatique chronique. Acta Neuropathol. (2016) 131:75-86. doi : 10.1007/s00401-015-1515-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKee AC, Stern RA, Nowinski CJ, Stein TD, Alvarez VE, Daneshvar DH, et al. The spectrum of disease in chronic traumatic encephalopathy. Cerveau. (2013) 136:43-64. doi : 10.1093/brain/aws307
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Jordan BD. Le spectre clinique des lésions cérébrales traumatiques liées au sport. Nat Rev Neurol. (2013) 9:222-30. doi : 10.1038/nrneurol.2013.33
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stern RA, Daneshvar DH, Baugh CM, Seichepine DR, Montenigro PH, Riley DO, et al. Présentation clinique de l’encéphalopathie traumatique chronique. Neurologie. (2013) 81:1122-9. doi : 10.1212/WNL.0b013e3182a55f7f
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gardner A, Iverson GL, McCrory P. Chronic traumatic encephalopathy in sport : a systematic review. Br J Sports Med. (2014) 48:84-90. doi : 10.1136/bjsports-2013-092646
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Montenigro PH, Baugh CM, Daneshvar DH, Mez J, Budson AE, Au R, et al. Sous-types cliniques de l’encéphalopathie traumatique chronique : examen de la littérature et critères de diagnostic de recherche proposés pour le syndrome d’encéphalopathie traumatique. Alzheim Res Ther. (2014) 6:68. doi : 10.1186/s13195-014-0068-z
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Mawdsley C, Ferguson F. Neurological disease in boxers. Lancet. (1963) 282:795-801. doi : 10.1016/S0140-6736(63)90498-7
CrossRef Full Text | Google Scholar
15. Omalu BI, DeKosky ST, Minster RL, Kamboh MI, Hamilton RL, Wecht CH. Encéphalopathie traumatique chronique chez un joueur de la National Football League. Neurosurgery. (2005) 57:128-34. doi : 10.1227/01.NEU.0000163407.92769.ED
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Rascovsky K, Hodges JR, Knopman D, Mendez MF, Kramer JH, Neuhaus J, et al. Sensibilité des critères diagnostiques révisés pour la variante comportementale de la démence frontotemporale. Brain. (2011) 134:2456-77. doi : 10.1093/brain/awr179
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Omalu BI, Bailes J, Hammers JL, Fitzsimmons RP. Encéphalopathie traumatique chronique, suicides et parasuicides chez les athlètes professionnels américains : le rôle du pathologiste médico-légal. Am J Forensic Med Pathol. (2010) 31:130-2. doi : 10.1097/PAF.0b013e3181ca7f35
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Maroon JC, Winkelman R, Bost J, Amos A, Mathyssek C, Miele V. Encéphalopathie traumatique chronique dans les sports de contact : une revue systématique de tous les cas pathologiques rapportés. PLoS ONE. (2015) 10:e0117338. doi : 10.1371/journal.pone.0117338
CrossRef Full Text | Google Scholar
19. Iverson GL. Encéphalopathie traumatique chronique et risque de suicide chez les anciens athlètes. Br J Sports Med. (2014) 48:162-4. doi : 10.1136/bjsports-2013-092935
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Iverson GL, Gardner AJ, McCrory P, Zafonte R, Castellani RJ.Iverson A critical review of chronic traumatic encephalopathy. Neurosci Biobehav Rev. (2015) 56:276-93. doi : 10.1016/j.neubiorev.2015.05.008
CrossRef Full Text | Google Scholar
21. Randolph C. L’encéphalopathie traumatique chronique n’est pas une vraie maladie. Arch Clin Neuropsychol. (2018) 33:644-8. doi : 10.1093/arclin/acy063
CrossRef Full Text | Google Scholar
22. Falcon B, Zivanov J, Zhang W, Murzin AG, Garringer HJ, Vidal R, et al. Novel tau filament folds in chronic traumatic encephalopathy encloses hydrophobic molecules. Nature. (2019) 568:420-3. doi : 10.1038/s41586-019-1026-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Weir DR, Jackson JS, Sonnega A, et al. National Football League Player Care Foundation Study of Retired NFL Players. Ann Arbor : University of Michigan Institute for Social Research (2009).
Google Scholar
24. King NS, Kirwilliam S. Permanent post-concussion symptoms after mild head injury. Blessure au cerveau. (2011) 25:462-70. doi : 10.3109/02699052.2011.558042
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Ward A, Crean S, Mercaldi CJ, Collins JM, Boyd D, Cook MN, et al. Prévalence du génotype de l’apolipoprotéine E4 et des homozygotes (APOE e4/4) chez les patients diagnostiqués avec la maladie d’Alzheimer : une revue systématique et une méta-analyse. Neuroépidémiologie. (2012) 38:1-17. doi : 10.1159/000334607
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Jordan BD, Relkin NR, Ravdin LD, Jacobs AR, Bennett A, Gandy S. Apolipoprotein Eε4 associated with chronic traumatic brain injury in boxing. (1997) 278:136-40. doi : 10.1001/jama.278.2.136
CrossRef Full Text | Google Scholar
27. Stern Y. La réserve cognitive dans le vieillissement et la maladie d’Alzheimer. Lancet Neurol. (2012) 11:1006-12. doi : 10.1016/S1474-4422(12)70191-6
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Laurent CL, Buée L, Blum D. Tau et neuroinflammation : Quel impact pour la maladie d’Alzheimer et les tauopathies ? Biomed J. (2018) 41:21-33. doi : 10.1016/j.bj.2018.01.003
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Sangobowale MA, Grin’kina NM, Whitney K, Nikulina E, St. Laurent-Ariot K, Ho JS, et al. Minocycline plus N-acétylcystéine réduisent les déficits comportementaux et améliorent l’histologie avec une fenêtre de temps cliniquement utile. J Neurotrauma. (2018) 35:907-17. doi : 10.1089/neu.2017.5348
CrossRef Full Text | Google Scholar
30. Haber M, James J, Kim J, Sangobowale M, Irizarry R, Ho J, et al. Minocycline plus N-acteylcysteine induit une remyélinisation, protège de manière synergique les oligodendrocytes et modifie la neuroinflammation dans un modèle de rat de lésion cérébrale traumatique légère. J Cereb Blood Flow Metab. (2018) 38:1312-6. doi : 10.1177/0271678X17718106
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D, et al. Dementia prevention, intervention and care. Lancet. (2017) 390 : 2673-734. doi : 10.1016/S0140-6736(17)31363-6
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Saulle M, Greenwald BD. L’encéphalopathie traumatique chronique : une revue. Rehabil Res Pract. (2012). 2012 : 816069. doi : 10.1155/2012/816069
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Langlois JA, Rutland-Brown W, Wald MM. L’épidémiologie et l’impact des lésions cérébrales traumatiques. J Head Trauma Rehabil. (2006) 21:375-8. doi : 10.1097/00001199-200609000-00001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Martini D, Eckner J, Kutcher J, Broglio SP. Biomécanique de l’impact subconcussif de la tête : comparaison de différents schémas offensifs. Med Sci Sports Exerc. (2013) 45:755-61. doi : 10.1249/MSS.0b013e3182798758
PubMed Abstract | CrossRef Full Text | Google Scholar
.