Introduction
Le riz possède une architecture racinaire complexe avec un mélange de racines embryonnaires et post-embryonnaires. La radicule émerge en premier lors de la germination, suivie peu après par les racines coronaires embryonnaires (Rebouillat et al., 2009 ; Coudert et al., 2010). Les premières racines adventives post-embryonnaires résultant de l’activité du méristème apical des pousses apparaissent quelques jours après la germination des semis. Les racines adventives sont également appelées racines coronaires ou couronnes et sont produites tout au long de la vie de la plante.
L’anatomie interne des racines de riz est bien décrite, notamment aux stades de semis (Rebouillat et al., 2009). Plusieurs tissus concentriques (de la périphérie à la stèle) sont situés entre l’épiderme et les tissus vasculaires (Figure 1). Ces tissus, appelés collectivement » tissu de fond « , sont parfois aussi appelés » cortex » (Lux et al., 2004). Ici, nous conservons le terme générique, c’est-à-dire le tissu de fond, pour décrire les tissus exodermiques, sclérenchymes, corticaux et endodermiques. Nous désignons par » cortex » le tissu situé entre l’endoderme et le sclérenchyme.
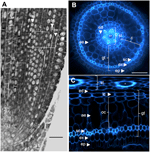
Figure 1. Anatomie d’une radicule de Nipponbare âgée de 6 jours. (A) Coupe longitudinale d’une radicule fixée et enrobée de paraplastes. Barre = 100 μm. (B) Coupe transversale d’une radicule fraîche observée sous lumière UV. Barre = 50 μm. (C) Vue transformée polaire de B. Les couches de tissus sont étiquetées comme suit : stèle (st), tissu de fond (gt) composé de plusieurs couches cellulaires : une couche d’endoderme (ed), plusieurs couches de cortex (c), une couche de sclérenchyme (sc), et une couche d’exoderme (ex). Les couches endodermiques (ed) et exodermiques (ex) sont facilement identifiées par l’absence/la réduction de la fluorescence dans les centres de la paroi cellulaire de ces cellules. La radicule est protégée par une couche d’épiderme (ep). Deux types de couches corticales peuvent être identifiés : le cortex interne (ic), qui se trouve à côté de l’endoderme (ed), et le cortex externe (oc), qui formera éventuellement l’aérenchyme (ae). Dans la stèle, notez la présence d’un grand métaxylème central (cx) entouré de 6 vaisseaux du métaxylème (x).
Le tissu superficiel est composé de plusieurs couches de tissus ayant la même origine parenchymateuse mais des caractéristiques spécifiques différentes qui jouent des rôles structurels et fonctionnels variés et importants dans les racines. Par exemple, l’exoderme et l’endoderme sont des barrières apoplastiques qui contrôlent le transport radial de l’eau et des nutriments du sol vers les organes photosynthétiques, une caractéristique principalement assurée par le dépôt de lamelles de subérine et la différenciation de la paroi cellulaire secondaire (Gregory, 2006). Les sclérenchymes sont des cellules lignifiées qui représentent une barrière critique pour certains métaux et jouent peut-être un rôle de support mécanique (Huang et al., 2012). Contrairement à ces trois tissus monocouches, le tissu cortical de la radicule de riz est composé de quatre ou cinq couches. Ce tissu, également appelé cortex moyen ou mésoderme, est caractérisé par la formation schizogène d’espaces, conduisant à la formation d’aérenchyme dans le riz (Justin et Armstrong, 1991 ; Kawai et al., 1998). L’aérenchyme joue un rôle majeur dans la tolérance aux conditions d’inondation et assure un flux continu d’oxygène de la pousse vers la racine, permettant la croissance des racines dans des conditions anoxiques. Le cortex a une fonction importante mais variable dans la physiologie des racines de nombreuses espèces et est impliqué dans le stockage, la tolérance à l’inondation ou les interactions symbiotiques (Lux et al., 2004).
La radicule et les racines du collet produisent trois types de racines latérales : les petites racines latérales (SLR) et deux types de grandes racines latérales (Kawata et Shibayama, 1965 ; Kono et al., 1972 ; Rebouillat et al., 2009). Cette division est basée sur (i) le diamètre des racines : Les SLR sont les plus petites (50-60 μm) et les L-LLR sont les plus grandes (120-150 μm), (ii) les ramifications, qui ne sont observées que sur les LLR, (iii) la présence d’un vaisseau central du métaxylème uniquement dans les LLR, et (iv) la présence d’une couche de sclérenchyme uniquement dans les L-LLR (Kono et al., 1972 ; Kawata et al., 1977 ; Rebouillat et al., 2009). Malgré cette classification, l’identité des tissus radiculaires internes dans les racines latérales, notamment les SLR, reste incertaine. En effet, Rebouillat et al. (2009) et Kawata et al. (1977) ont tous deux affirmé que le tissu racinaire des SLR était composé de l’endoderme, du sclérenchyme et de l’exoderme (de l’intérieur vers l’extérieur), alors que chez Kono et al. (1972), la couche cellulaire sclérenchymeuse du cortex interne a été décrite comme absente dans les SLR et les T-LLR.
Pour résoudre ce dilemme, et pour étudier le développement et la fonction de tissus particuliers en général, l’utilisation de marqueurs d’identité est nécessaire. La plupart des marqueurs tissulaires utilisés jusqu’à présent sont des marqueurs morphologiques ou des colorants histochimiques, qui ont fourni un moyen utile de caractériser l’identité des cellules. La berbérine révèle la présence de subérine dans les parois cellulaires, qui se trouve presque exclusivement dans les bandes caspiennes qui entourent chaque cellule individuelle de l’endoderme et constitue donc un bon marqueur indirect de l’identité endodermique (Brundett et al., 1988). Chez A. thaliana, des marqueurs spécifiques des tissus ont également été développés en utilisant des promoteurs spécifiques des tissus fusionnés à des gènes rapporteurs (GUS et/ou GFP) dans des plantes génétiquement modifiées. Par exemple, le promoteur SCARECROW est utilisé comme marqueur d’identité endodermique (Sugimoto et al., 2010). Les lignées QC25 et QC46 enhancer trap GUS (Sabatini et al., 2003) et QHB chez le riz (Kamiya et al., 2003) ont également été identifiées comme des marqueurs de centre quiescent (QC) en raison de leur expression spécifique au QC. Malgré l’intérêt porté à ces marqueurs, seuls quelques-uns sont disponibles et presque exclusivement chez A. thaliana. Ils présentent également des inconvénients. Par exemple, la pertinence de l’utilisation du promoteur SCARECROW (SCR) comme marqueur de l’endoderme est discutable lorsque des questions spécifiques sur les rôles de SCR et SHORT ROOT (SHR) dans la différenciation des tissus du sol sont abordées. En effet, les gènes SCR et SHR sont impliqués en soi dans la formation de l’endoderme/cortex (Wu et Gallagher, 2014). Chez A. thaliana, les seuls marqueurs du cortex racinaire disponibles sont les promoteurs Co2 et Co3 (Heidstra et al., 2004 ; Ten Hove et al., 2010). Chez le riz, ces marqueurs de cortex ne sont pas encore utilisés car il n’y a pas d’orthologues clairs pour les gènes Co2 et Co3. Seuls des marqueurs morphologiques indirects ont été utilisés à ce jour chez le riz, comme la formation d’aérenchyme pour l’identité corticale (Rebouillat et al., 2009).
Une autre classe de marqueurs est constituée d’anticorps disponibles dans le commerce dirigés contre les parois cellulaires végétales (http://www.plantprobes.net/index.php). Ces marqueurs ont été peu utilisés dans le passé, mais leur efficacité a été démontrée. Par exemple, les anticorps de paroi cellulaire CCRC-M2 et JIM13 ont été utilisés chez A. thaliana pour montrer que la couche unique de tissu interne présente chez le mutant shr avait une identité corticale alors que la couche de tissu de fond du mutant scr présentait des identités multiples (Di Laurenzio et al., 1996 ; Helariutta et al., 2000). Ces marqueurs présentent de nombreux avantages : leur simplicité et la possibilité de combiner des anticorps secondaires couplés à différents fluorochromes pour limiter le chevauchement avec l’auto-fluorescence, ils ne nécessitent pas de transformation génétique et ils peuvent être utilisés en complément d’autres classes de marqueurs.
Dans cet article, nous décrivons d’abord un protocole simple à débit moyen pour l’immunomarquage de coupes de tissus frais de vibratome. En utilisant ce protocole, nous avons criblé des sections radiales de radicelles de riz avec une grande bibliothèque de 174 anticorps de paroi cellulaire. Parmi ceux-ci, nous avons identifié huit marqueurs spécifiques du cortex et démontré que le riz possède deux types de tissus corticaux à l’identité distincte. Nous avons appelé ces couches le cortex interne et externe en fonction de leur position anatomique respective dans les sections de racine. Pour démontrer l’utilité de ces marqueurs spécifiques du cortex, nous avons clarifié les identités des tissus du sol des racines latérales en utilisant trois de ces anticorps. Dans les SLR en particulier, nous montrons que la couche de tissu interne a une identité corticale externe. Notre protocole est suffisamment générique pour être utilisé pour le développement de marqueurs tissulaires dans n’importe quelle espèce sans avoir besoin de générer des plantes transgéniques. Ce protocole peut être facilement adapté avec des pousses fraîches, des feuilles, des racines ou tout autre tissu d’autres plantes et représente un moyen simple et facile d’identifier des marqueurs spécifiques aux tissus. En outre, ces marqueurs peuvent être utilisés en conjonction avec d’autres marqueurs moléculaires.
Résultats
Le profilage immunologique des anticorps de la paroi cellulaire dans les sections radiales de racine de riz révèle des anticorps spécifiques pour les couches du cortex
Dans le but d’identifier des marqueurs à base d’anticorps pour les cellules corticales, nous avons d’abord établi un protocole pour l’immunomarquage à débit moyen de sections radiales de racines de riz fraîches (voir Matériaux et méthodes et Figure supplémentaire 1 pour plus de détails). Ensuite, nous avons effectué un tri avec des anticorps monoclonaux dirigés contre les composants de la paroi cellulaire (du Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) et du Paul Knox Cell Wall lab (université de Leeds, UK), voir Matériaux et Méthodes pour plus de détails) afin d’identifier les marqueurs du cortex. Parmi les 174 anticorps testés, seuls 12 ont été retenus comme étant putativement spécifiques du cortex. Nous avons testé leur répétabilité en réalisant deux expériences supplémentaires et avons conclu que huit anticorps présentaient des profils similaires et robustes parmi les trois répliques (Figure 2). Cinq anticorps (JIM7, M14, M38, M130 et M131) présentaient le même profil d’immunomarquage dans le cortex. Seules les parois cellulaires non adjacentes ont été marquées, ce qui a donné lieu à un marquage singulier en forme de « diamant » de toutes les cellules corticales. Pour les trois autres anticorps (LM5, M133, et M107), le marquage a été détecté dans le cortex et parfois dans les cellules du sclérenchyme, en particulier avec les anticorps LM5 et M107. Le signal était homogène sur la paroi cellulaire du cortex, mais était beaucoup plus faible dans les couches internes du cortex (la couche du cortex adjacente à la couche endodermique) que dans les couches externes du cortex. Ainsi, tous ces anticorps dont les profils sont complémentaires aux tissus corticaux sont des marqueurs spécifiques qui peuvent être utilisés pour analyser l’identité des cellules corticales. De plus, les deux étiquettes corticales différentes, définissant deux zones sous-corticales, suggèrent que les couches externes et internes ont une identité moléculaire distincte qui a été révélée par ces anticorps.
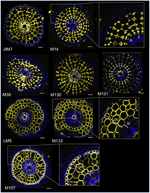
Figure 2. Identification de huit anticorps spécifiques du cortex (JIM7, M14, M38, M130, M131, LM5, M133 et M107) parmi les 174 criblés de la bibliothèque d’anticorps monoclonaux de la paroi cellulaire. Pour chaque anticorps, des images fusionnées de coupes transversales ont été obtenues sous un microscope confocal après marquage immunohistologique : en jaune, motif de l’anticorps à 561 nm, et en bleu, autofluorescence de la paroi cellulaire sous lumière UV. Cinq anticorps (JIM7, M14, M38, M130, et M131) montrent un profil similaire dans toutes les couches de cellules corticales colorées (formes de diamant). Trois anticorps (LM5, M133, et M107) ont marqué de façon homogène les parois des cellules corticales. Notez que pour ces anticorps, les couches corticales internes (ic) ne sont pas colorées par rapport aux couches corticales externes (oc). Les encarts sont des gros plans des images correspondantes. Barres = 20 μm.
Certaines caractéristiques spécifiques de ces deux couches sous-corticales ont été mises en évidence lorsque le plugin » polar transformer » du logiciel ImageJ (http://imagej.nih.gov/ij/) a été utilisé pour visualiser les images des sections de racines (figures 1B,C ; Schneider et al., 2012 ; Lartaud et al., 2014). Les cellules internes étaient caractérisées par une paroi cellulaire épaisse par rapport aux cellules externes, qui présentaient diverses cavités contenant de l’air résultant de la fusion de la paroi cellulaire. Les cellules corticales internes présentaient également une forme aplatie ressemblant aux cellules endodermiques, contrairement aux cellules externes, qui étaient plus rondes. Dans cette image transformée, la paroi cellulaire radiale, c’est-à-dire la paroi qui s’étend du côté interne de la cellule au côté externe, l’autofluorescence des cellules endodermiques et exodermiques ne sont pas visibles, vraisemblablement en raison de la présence de bandes caspiennes. De même, mais dans une moindre mesure, de petits trous exempts d’autofluorescence étaient également visibles sur les parois cellulaires radiales des cellules corticales internes.
Tous les types de racines latérales ne possèdent que du tissu cortical externe
Pour démontrer l’utilité des marqueurs de cortex et caractériser les identités cellulaires, nous avons marqué les trois types de racines latérales de riz (L-LLR, T-LLR et SLR) avec trois de ces anticorps (M107, M133 et M14). Pour cette expérience, comme les L-LLR ne se développent pas souvent sur des boîtes de Petri, les racines latérales ont été collectées à partir de semis de riz cultivés en conditions hydroponiques pendant 2 semaines. Nous avons d’abord analysé l’organisation du tissu de fond de chaque type de racine latérale en observant l’autofluorescence des parois cellulaires dans les vues transversales et polaires des sections de racines (Figure 3). Cette première analyse a révélé une anatomie radiale interne légèrement distincte pour les trois types de racines latérales. Comme pour les sections de radicules vues sous lumière UV, les tissus endodermiques et exodermiques peuvent être identifiés par l’extinction de la fluorescence au centre des parois cellulaires radiales. Ces deux tissus étaient présents dans toutes les racines latérales. Entre l’endoderme et l’exoderme, plusieurs couches de tissus étaient présentes dans les L-LLR et T-LLR tandis que les SLR ne possédaient qu’une seule couche cellulaire (non identifiée). L’anatomie des L-LLR ressemblait à des racines séminales et, à l’extérieur de l’endoderme, plusieurs couches de tissu cortical étaient facilement identifiables lors de la formation de l’aérenchyme. En outre, une couche de sclérenchyme formée de cellules serrées avec des parois cellulaires larges a également été observée. Selon l’expérience, cette couche cellulaire n’était pas toujours complètement développée. Dans les sections du T-LLR, la couche externe ressemblait au tissu cortical et la couche interne ressemblait à la couche unique (non identifiée) du SLR.
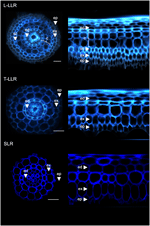
Figure 3. Composition tissulaire des types de grandes racines latérales (Large-LLR et Thin-LLR) et des petites racines latérales (SLR). Les semis ont été cultivés dans des conditions hydroponiques pendant 2 semaines. Autofluorescence de la paroi cellulaire des sections transversales et vue transformée polaire sous lumière UV. Les tissus sont étiquetés comme suit : épiderme (ep), exoderme (ex), cortex (c), endoderme (ed). Notez que l’épiderme (ep) a souvent été fragmenté au cours de l’expérience. Barres = 20 μm.
Pour identifier les couches cellulaires présentes dans les tissus du sol des SLR et des T-LLR et pour confirmer l’identité corticale dans les L-LLR, nous avons immunomarqué des sections de racines latérales avec trois anticorps spécifiques du cortex (M107, M133 et M14 ; figure 4). Les anticorps M107 et M133 ont marqué toutes les couches cellulaires situées entre l’endoderme et l’exoderme dans toutes les racines latérales. D’après la coloration des radicelles pour ces anticorps, cette observation indique que ces couches cellulaires pourraient avoir une identité sclérenchyme ou corticale. Cependant, le fait que M14 immunomarquait également ces couches, en particulier dans les sections SLR, démontre clairement que ces couches avaient une identité corticale externe.

Figure 4. Images fusionnées des types de grandes racines latérales (Large-LLR et Thin-LLR) et des sections de petites racines latérales (SLR) immunomarquées avec M107, M133 et M14. Les semis ont été cultivés dans des conditions hydroponiques pendant 2 semaines. En jaune, marquage des anticorps à 561 nm, et en bleu, autofluorescence sous lumière UV. Les tissus sont étiquetés comme suit : épiderme (ep), exoderme (ex), cortex (c), endoderme (ed). Notez que l’épiderme (ep) a souvent été fragmenté au cours de l’expérience. Barres = 20 μm.
Les variations du nombre de couches de cellules corticales externes (une dans les SLR, deux dans les T-LLR, trois dans les L-LLR et quatre à cinq dans la radicule) jouent un rôle majeur dans le diamètre des racines de riz (figure 5).
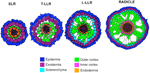
Figure 5. Représentation schématique des tissus de la racine latérale et de la radicule.
Conclusions
Différents termes ont déjà été utilisés pour qualifier les zones sous-corticales des plantes. Par exemple, la présence d’une couche corticale lignifiée » interne « , comparable à celle étudiée ici, a déjà été décrite chez le riz sauvage (Yang et al., 2014). Chez le maïs, les deux domaines corticaux sont définis différemment (Baluška et al., 1993). Le domaine « interne » forme l’aérenchyme, correspondant ici au cortex externe, et le cortex « moyen-externe » est un tissu de soutien lignifié, qui pourrait être le sclérenchyme. Chez Arabidopsis, une couche cellulaire de « cortex moyen », située entre la monocouche corticale et l’endoderme, a également été décrite (Baum et al., 2002 ; Paquette et Benfey, 2005). Des résultats récents suggèrent que cette couche corticale, dont la formation est régulée par GA, le stress oxydatif, et SHR et SCR entre autres, joue un rôle dans la tolérance abiotique (Paquette et Benfey, 2005 ; Cui et Benfey, 2009 ; Pauluzzi et al., 2012 ; Wu et Gallagher, 2014). Il est intéressant de noter que cette couche est également décrite comme une couche en forme d’hélice avec une forme typique (Baum et al., 2002). Cette couche de » cortex moyen » d’Arabidopsis pourrait-elle être fonctionnellement et structurellement similaire à la couche de cortex interne de la radicule du riz ? Dans les coupes longitudinales et transversales du riz, la couche corticale interne forme aussi généralement une hélice, ce qui suggère que ces deux couches tissulaires pourraient être comparables. Chez Arabidopsis, la couche de « cortex moyen » est dérivée d’une division périclinale de l’endoderme, qui apparaît à l’écart du QC entre 7 et 14 jours après la germination (Paquette et Benfey, 2005). De nouveaux outils seront nécessaires pour vérifier ces paramètres importants chez le riz. Par exemple, aucun mutant affectant le moment de la formation de cette couche n’a été décrit jusqu’à présent. De plus, des progrès techniques dans l’imagerie du QC du riz sont également nécessaires. Néanmoins, nos marqueurs spécifiques du cortex offrent un nouvel outil pour comparer la fonction et le réseau moléculaire impliqués dans la formation du cortex interne (riz) par rapport au « cortex moyen » (Arabidopsis). Des travaux sont en cours dans notre laboratoire pour identifier les déterminants moléculaires de la formation du cortex interne et externe, les orthologues du riz SCR et SHR étant les premiers candidats pour la régulation de la formation du cortex dans les racines du riz (Pauluzzi et al, 2012).
Matériaux et méthodes
Matériau végétal
Semences de six jours
Semences de l’Oryza sativa L. ssp. japonica Nipponbare ont été cultivées verticalement dans des boîtes de Pétri stériles (Corning, 431301 ; 20 × 20 cm) dans des conditions contrôlées (rythme jour/nuit : 12/12 h, 28/25°C, intensité lumineuse : 500 μE m-2 s-1). Tout d’abord, les graines ont été stérilisées en surface par rinçage dans de l’éthanol à 70 % pendant ~1 min. Ensuite, l’éthanol a été remplacé par une solution composée de 40% d’eau de javel dans de l’eau distillée contenant trois gouttes de tween 80 (Sigma-Aldrich P4780-500 mL). Les graines ont été trempées dans cette solution pendant 30 min sous agitation douce, puis rincées au moins quatre fois avec de l’eau distillée stérile. Du milieu Murashige et Skoog (MS/2) demi-puissant (250 mL) stérilisé à chaud (~50°C) par autoclave est versé dans des boîtes de Pétri, et laissé se solidifier pendant ~45 min. Le milieu solide MS/2 est composé de 2,15 g.L-1 de mélange de sel basal de milieu MS (Duchefa Biochemie, M0221), 75 mg.L-1 de mélange de vitamines MS (Duchefa Biochemie, M0409), et 8 g.L-1 d’agarose type II (Sigma-Aldrich, A6877). Les graines stériles sont ensuite poussées dans le milieu MS/2 solidifié avec la radicule orientée vers le bas. Les racines ont été récoltées après 6 jours de croissance.
Plantes de quatre semaines
Après 3 jours de germination dans l’eau, les plantules ont été transférées dans un système hydroponique en conditions contrôlées (rythme jour/nuit : 12/12 h, 28/25°C, intensité lumineuse : 500 μE m-2 s-1, humidité relative : 55%). Le système hydroponique est constitué d’une boîte en plastique de 50 L contenant 30 L de solution hydroponique sur laquelle est posé un matelas en mousse de 1 cm d’épaisseur. Le matelas de mousse est percé d’interstices pour maintenir les bases des tiges des plantules. Le milieu hydroponique est composé de (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) et KH2PO4 (0,6 mM). La solution est aérée par une pompe placée au fond de la boîte en plastique et changée tous les 10 jours. Le pH a été ajusté et maintenu à 5,4 ± 0,2.
Sectionnement de racines fraîches
Les extrémités des radicelles en croissance ou des racines latérales (2 cm) ont été coupées à l’aide d’une lame tranchante et placées parallèlement les unes aux autres pour aligner les extrémités des racines (Figures supplémentaires 1A,B). Elles ont été incorporées dans une goutte d’agarose fondu à 3% (50°C ; figure supplémentaire 1C). Les plaques contenant les extrémités des racines ont été insérées dans un puits de 3 × 1 × 1 cm rempli d’agarose fondu à 3 % (figure supplémentaire 1D). Après solidification, les blocs ont été redimensionnés et collés sur une plaque de vibratome pour être tranchés. Les paramètres du vibratome (Hm650v (Thermo Scientific Microm)) étaient les suivants : vitesse 30, fréquence 70, amplitude 0,8 et épaisseur 60 μm (figure supplémentaire 1E). Les sections ont été transférées soit sur des lames de chambre (Lab-teak 177402) pour l’immunocoloration (figure supplémentaire 1F), soit sur des lames humidifiées avec un tampon phosphate alcalin 1X (PBS, Sigma-Aldrich P3813) pour l’observation.
Immunolocalisation
Les sections placées sur les lames de chambre (trois par chambre) ont d’abord été rincées dans de la glycine 0,1 M complétée par du PBS 1X, puis deux fois dans du PBS 1X, chacune pendant 10 min. Les tissus ont ensuite été immergés dans une solution PBS contenant 5% de sérum fœtal bovin (solution de blocage, Thermo Fisher 37520) à 4°C pendant une nuit sous agitation. Les anticorps primaires, dilués au 1/10 dans cette solution de blocage, ont été appliqués pendant la nuit à 4°C sous agitation. Les sections ont ensuite été rincées 3 fois dans du PBS 1X pendant 10 min. Les sections de racines ont été incubées pendant 2 h avec l’anticorps secondaire dilué 500 fois dans la solution de blocage, sous agitation. Ces anticorps étaient couplés à un fluorophore, l’anticorps anti-rat Alexa 546 (Invitrogen A11081) ou l’anticorps anti-souris Alexa 546 (Invitrogen A11060). Ensuite, les sections ont été rincées à nouveau trois fois dans du PBS 1X sous agitation, pendant 10 min chacune. Les chambres ont été retirées et quelques gouttes de milieu de montage mowiol (Sigma-Aldrich 81381) ont été ajoutées. Un couvre-objet a été placé sur les sections de racines, qui ont été laissées à sécher pendant 36 h à 4°C dans l’obscurité.
Fixation des paraplastes
Les radicelles cultivées sur des boîtes de Pétri pendant 6 jours ont été fixées dans du paraformaldéhyde à 4% (dans du PBS 1X) pendant une nuit à 4°C et rincées deux fois avec du PBS 1X (Jackson, 1991). Les tissus fixés ont été déshydratés dans de l’éthanol, blanchis dans l’agent de blanchiment Histochoice (HistoClear, Sigma Aldrich) et inclus dans du Paraplast (Fisher). Les tissus ont été sectionnés (6 μm d’épaisseur) sur un microtome Leica RM2255 et montés sur des lames SuperfrostPlus (Fisher).
Microscopie
Les observations en champ clair et en autofluorescence ont été réalisées à l’aide d’un microscope Leica DM4500. Pour l’autofluorescence, les images ont été prises avec le cube de filtres « A » (plage d’excitation : UV ; filtre d’excitation : BP 340-380 ; filtre de suppression : LP 425). Les sections immunocolorées ont été observées avec des microscopes confocaux : Zeiss LSM 510 ou Leica SP8. Les parois cellulaires ont d’abord été visualisées par autofluorescence . L’anticorps secondaire a été visualisé en utilisant un laser Hélium/Néon à 543 ou 561 nm respectivement. Les images ont été prises avec une caméra couleur Retiga 2000R (QIMAGING, Canada) utilisant le logiciel d’acquisition d’images Volocity (Improvision, UK).
Contributions des auteurs
SH, FD, MB, CB : acquisition des données ; SH, CP, AD analyse des données ; SH, EG, CP, AD : rédaction du manuscrit.
Déclaration de conflit d’intérêt
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêt potentiel.
Remerciements
Nous remercions l’IRM (Plateforme d’imagerie Montpellier RIO), les Plateformes PHIV et La Gaillarde pour leur soutien technique pour l’immunolocalisation et/ou l’imagerie confocale et multiphotonique. SH est soutenu par une bourse de doctorat du CIRAD.
Matériel supplémentaire
Le matériel supplémentaire de cet article est disponible en ligne à l’adresse suivante : https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abréviations
ae, aérenchyme ; c, cortex ; ed, endoderme ; ep, épiderme ; ex, exoderme ; gt, tissu de fond ; ic, cortex interne ; L-LLR, Large-type Large Lateral Root ; oc, cortex externe ; sc, sclérenchyme ; SLR, Small Lateral Root ; st, stèle ; T-LLR, Thin-type Large Lateral Root ; x, xylème.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., et Barlow, P. W. (1993). Le dimorphisme cellulaire dans le cortex racinaire du maïs : implication des microtubules, de l’éthylène et de la gibbérelline dans la différenciation du comportement cellulaire dans les zones de croissance postmitotiques. Bot. Acta 106, 394-403. doi : 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., et Rost, T. L. (2002). Organisation apicale et maturation du cortex et du cylindre vasculaire dans les racines d’Arabidopsis thaliana (Brassicaceae). Am. J. Bot. 89, 908-920. doi : 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., et Peterson, C. A. (1988). Une procédure de coloration fluorescente bleu berbérine-aniline pour la subérine, la lignine et la callose dans les tissus végétaux. Protoplasma 146, 133-142. doi : 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., and Gantet, P. (2010). Contrôle génétique du développement racinaire chez le riz, la céréale modèle. Trends Plant Sci. 15, 219-226. doi : 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., et Benfey, P. N. (2009). Interaction entre SCARECROW, GA et LIKE HETEROCHROMATIN PROTEIN 1 dans le modelage des tissus du sol dans la racine d’Arabidopsis. Plant J. 58, 1016-1027. doi : 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). Le gène SCARECROW régule une division cellulaire asymétrique qui est essentielle pour générer l’organisation radiale de la racine d’Arabidopsis. Cell 86, 423-433. doi : 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Plant Roots : Growth, Activity, and Interaction with Soils. Oxford ; Ames, IA : Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., et Scheres, B. (2004). Des analyses en mosaïque utilisant des clones d’activation et de délétion marqués dissèquent l’action de Arabidopsis SCARECROW dans la division cellulaire asymétrique. Genes Dev. 18, 1964-1969. doi : 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). Le gène SHORT-ROOT contrôle le modelage radial de la racine d’Arabidopsis par la signalisation radiale. Cell 101, 555-567. doi : 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., et Ma, J. F. (2012). Un gène de kinase de type récepteur à répétition riche en leucine est impliqué dans la spécification des couches cellulaires externes dans les racines du riz. Plant J. 69, 565-576. doi : 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). « L’hybridation in situ dans les plantes » dans Molecular Plant Pathology : A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ : Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Preuve de l’implication de l’éthylène dans la formation des aérenchymes dans les racines adventives du riz (Oryza sativa L.). New Phytol. 118, 49-62. doi : 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., et Matsuoka, M. (2003). Isolation et caractérisation d’un gène homeobox de type WUSCHEL de riz qui est spécifiquement exprimé dans les cellules centrales d’un centre quiescent dans le méristème apical de la racine. Plant J. 35, 429-441. doi : 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., et Uchimiya, H. (1998). Dissection cellulaire du modèle de dégradation de la mort des cellules corticales pendant la formation de l’aérenchyme des racines de riz. Planta 204, 277-287. doi : 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., et Yamazaki, K. (1977). Sur la structure de la racine couronne et de la racine latérale, et la connexion des vaisseaux entre eux, chez les plantes de riz. Jpn. J. Crop. Sci. 46, 569-579. doi : 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., et Shibayama, B. (1965). Sur la formation des primordia de racines latérales dans les racines de la couronne du plant de riz. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi : 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., et Yamada, N. (1972). Études sur la physiologie du développement des racines latérales dans les racines séminales du riz. Jpn. J. Crop. Sci. 41, 192-204. doi : 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell : un outil d’analyse d’image supervisée pour la quantification des paramètres anatomiques des racines de riz. Front. Plant Sci. 5:790. doi : 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., et Morita, S. (2004). Cortex racinaire : variabilité structurelle et fonctionnelle et réponses au stress environnemental. Root Res. 13, 117-131. doi : 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., et Benfey, P. N. (2005). La maturation du tissu souterrain de la racine est régulée par la gibbérelline et SCARECROW et nécessite SHORT-ROOT. Plant Physiol. 138, 636-640. doi : 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., et Périn, C. (2012). Surfant le long du réseau de gènes des tissus du sol des racines. Dev. Biol. 365, 14-22. doi : 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Génétique moléculaire du développement des racines de riz. Rice 2, 15-34. doi : 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW est impliqué dans le positionnement de la niche des cellules souches dans le méristème racinaire d’Arabidopsis. Genes Dev. 17, 354-358. doi : 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., et Eliceiri, K. W. (2012). NIH Image à ImageJ : 25 ans d’analyse d’images. Nat. Methods 9, 671-675. doi : 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., et Meyerowitz, E. M. (2010). La régénération d’Arabidopsis à partir de multiples tissus se produit via une voie de développement racinaire. Dev. Cell 18, 463-471. doi : 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., and Heidstra, R. (2010). SCHIZORIZA encode un facteur nucléaire régulant l’asymétrie des divisions des cellules souches dans la racine d’Arabidopsis. Curr. Biol. 20, 452-457. doi : 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., et Gallagher, K. L. (2014). Le mouvement du facteur de transcription non cellulaire autonome, SHORT-ROOT repose sur le système endomembranaire. Plant J. 80, 396-409. doi : 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., et Seago, J. L. (2014). Anatomie et histochimie des racines et des pousses du riz sauvage (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi : 10.1155/2014/181727
CrossRef Full Text | Google Scholar
.