A Exelead, nous abordons la fabrication à façon avec une expertise ciblée sur les formulations liposomales et PEGylées pour traiter les maladies rares et les populations petites ou mal desservies. Nous sommes spécialisés dans le développement et la fabrication de médicaments parentéraux à base de lipides, et notre équipe a plus de 20 ans d’expérience de travail avec un large éventail de clients de fabrication sous contrat préclinique, clinique et commercial.
Qu’est-ce que les liposomes, et comment sont-ils utilisés dans l’administration de médicaments ?
Les liposomes sont des véhicules de livraison spécialisés qui jouent plusieurs rôles dans l’amélioration des capacités des ingrédients pharmaceutiques actifs (API). Premièrement, ils peuvent protéger un médicament de la détection par le système immunitaire de l’organisme, en imitant les membranes biologiques et en donnant au médicament plus de temps pour atteindre sa destination prévue. Deuxièmement, ils servent à aider à solubiliser les molécules médicamenteuses hautement lipophiles ou à moduler la pharmacocinétique et la biodistribution de l’IPA – contribuant ainsi à minimiser les effets secondaires et à améliorer le profil de sécurité du produit.
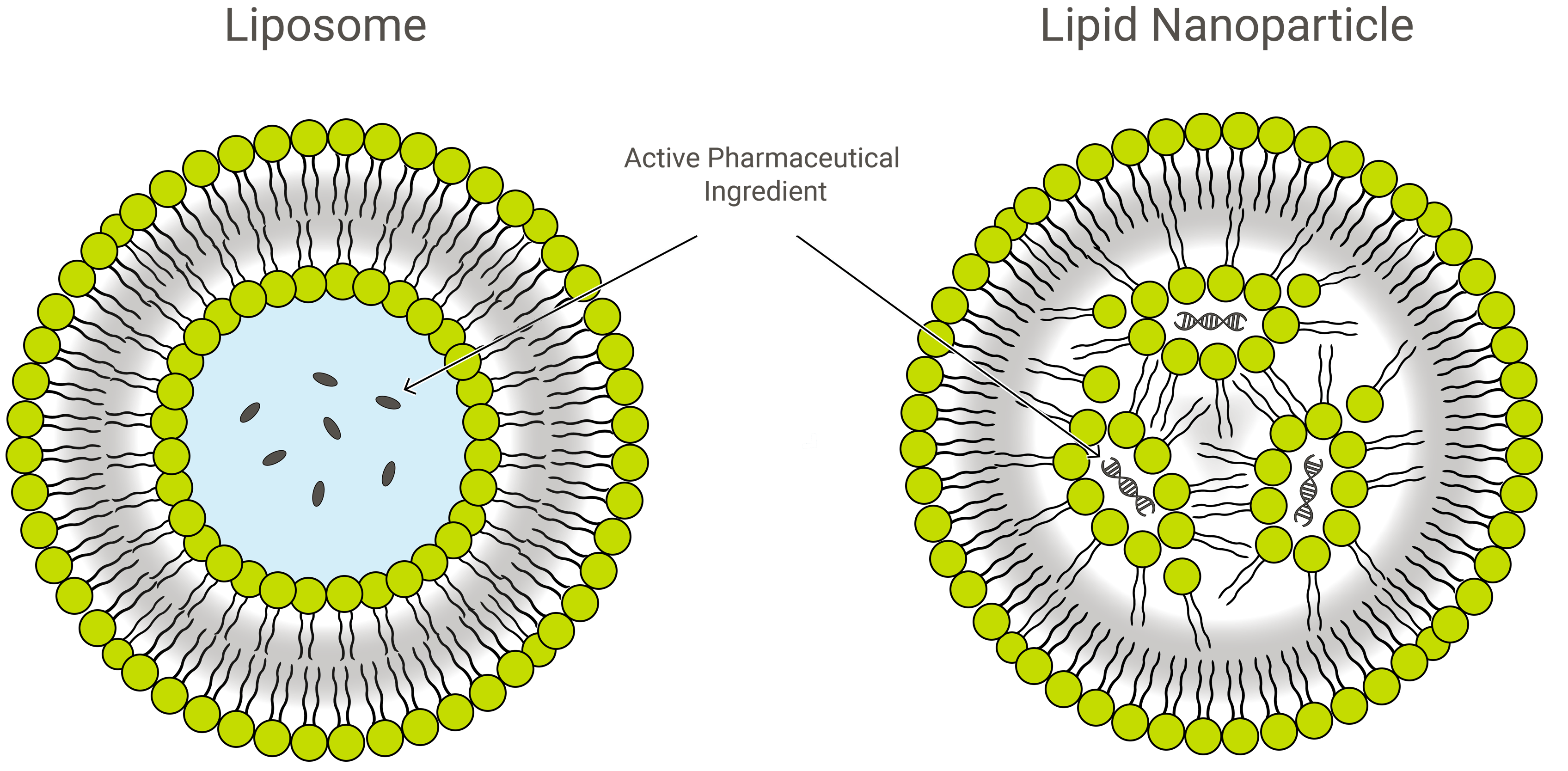
Les liposomes possèdent une structure vésiculaire unique. Ces vésicules sont composées d’une bicouche lipidique qui prend la forme d’une sphère creuse englobant une phase aqueuse. Ainsi, toute cargaison d’intérêt peut être encapsulée dans les liposomes, soit dans le compartiment aqueux (si elle est soluble dans l’eau/hydrophile), soit dans la bicouche lipidique (si elle est soluble dans les graisses/lipophile).
Certains des principaux lipides utilisés pour fabriquer des liposomes sont les phospholipides et les sphingolipides. Ces deux catégories de lipides ont la particularité d’avoir un groupe de tête qui aime l’eau/hydrophile et un groupe de queue qui déteste l’eau/lipophile. En raison de leur nature amphiphile, ces molécules s’assemblent spontanément pour former des liposomes et d’autres structures 3D uniques lorsqu’elles sont ajoutées à des solutions aqueuses. La forme ou la morphologie des structures 3D dépend d’une variété de facteurs différents-par exemple, la composition des lipides, la température, le pH ou la présence d’autres tampons, de sels et de sucres dans l’eau.

Source de l’image : Chem Libre Texts
Comment un médicament interagit-il avec le corps et devient-il disponible pour être utilisé lorsqu’il est formulé comme un produit pharmaceutique liposomal ?
Ces dernières années, les liposomes ont attiré une attention significative en tant que classe fiable de véhicules d’administration de médicaments. Leurs structures auto-fermées peuvent encapsuler plusieurs médicaments à la fois, protégeant la cargaison enfermée de l’hydrolyse et de la dégradation. En outre, les protéines de ciblage et les ligands fonctionnels de surface sur l’enveloppe extérieure de la bicouche lipidique peuvent ajouter une nouvelle fonctionnalité – permettant l’entrée ciblée des liposomes dans les cellules, par le biais d’anticorps ou de ligands ciblés sur les récepteurs. Ces ligands se fixent aux récepteurs cellulaires qui sont surexprimés dans certaines cellules malades, permettant l’entrée du médicament à travers la membrane cellulaire.
« Les liposomes protègent les molécules médicamenteuses chargées de la dégradation externe, et leur similitude avec les membranes biologiques offre des opportunités uniques pour délivrer des molécules médicamenteuses dans les cellules ou les compartiments subcellulaires…. En outre, diverses propriétés physicochimiques des liposomes – y compris leur taille, leur charge et les ligands fonctionnels de surface – peuvent être modifiées, ce qui permet d’obtenir des fonctionnalités favorisant des tâches spécifiques d’administration de médicaments. Ces avantages ont fait des liposomes une plate-forme d’administration de médicaments de premier plan avec un large éventail d’utilisations dans la clinique. »
– Nanostructures de type liposome pour l’administration de médicaments | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Typiquement, les liposomes sont fabriqués comme des injectables stériles pour être administrés dans la circulation sanguine, et la libération du médicament a lieu lorsque les enveloppes lipidiques se brisent – ce qui peut se produire dans des environnements extracellulaires ou intracellulaires.
Diverses stratégies ont été employées pour concevoir des liposomes conventionnels avec des capacités de libération déclenchée, améliorant l’efficacité thérapeutique en amenant les liposomes à libérer l’API encapsulé ou « cargo » en fonction d’une réponse à un stimulus. Cette libération est soit entraînée par la dégradation classique des liposomes, soit entraînée par des stimuli actifs et des signaux environnementaux, notamment l’énergie thermique, le gradient de pH et la contrainte de cisaillement.1
Les formulations destinées à être libérées dans des environnements intracellulaires peuvent inclure des lipides sensibles au pH qui modifient la structure des liposomes ou se dégradent dans les compartiments acides, permettant la libération du médicament encapsulé. Alternativement, des composants thermosensibles ou photosensibles sont parfois inclus pour permettre la dégradation et la modulation de la structure en raison des changements de température ou de la réaction à la lumière de certaines longueurs d’onde.
Les transporteurs de médicaments de type liposome peuvent se présenter sous de nombreuses variétés différentes, présentant un large éventail de propriétés biochimiques et biophysiques. Si cela est avantageux et permet à ces particules à base de lipides d’assumer des applications utiles dans des centaines de contextes différents, le nombre de variations potentielles rend impératif un contrôle rigoureux de la fabrication.2
Exelead fabrique des médicaments à base de lipides depuis le début des années 1990, en commençant par Abelcet. L’amphotéricine B, le principe actif d’Abelcet, est maintenue dans un complexe lipidique et fusionne sélectivement avec les membranes fongiques pour cibler les cellules malades.
Liposomes vs nanoparticules lipidiques
Les liposomes et les nanoparticules lipidiques (LNP) sont similaires par leur conception, mais légèrement différents par leur composition et leur fonction. Les deux sont des nanoformulations lipidiques et d’excellents véhicules d’administration de médicaments, transportant la cargaison d’intérêt dans une couche extérieure protectrice de lipides. En application, cependant, les LNP peuvent prendre une variété de formes.
Les LNP sont des structures de type liposome spécialement orientées vers l’encapsulation d’une grande variété d’acides nucléiques (ARN et ADN) ; et à ce titre, elles constituent le système d’administration de gènes non viraux le plus populaire. Exelead développe et fabrique des LNP pour encapsuler différents types de charges utiles génétiques, notamment le siRNA, le mRNA et le saRNA.
Les liposomes traditionnels comprennent un ou plusieurs anneaux de bicouche lipidique entourant une poche aqueuse, mais tous les LNP ne présentent pas une bicouche contiguë qui les qualifierait de vésicules lipidiques ou de liposomes. Certains LNP assument une structure de type micelle, encapsulant des molécules de médicament dans un noyau non aqueux.
PEGylation des LNP et des structures d’administration de médicaments de type liposome
Les LNP sont composés principalement de lipides cationiques (voir thérapie génique ci-dessous) avec d’autres ingrédients lipidiques. Ceux-ci comprennent généralement des molécules phospholipidiques neutres appartenant à la classe de la phosphatidylcholine (PC) et des stérols, tels que le cholestérol. Un autre ingrédient lipidique commun est ce que l’on appelle un phospholipide PEGylé – un polymère de polyéthylène glycol (PEG) attaché de manière covalente au groupe de tête d’un phospholipide.

Les phospholipides PEGylé sont utilisés dans de nombreux supports médicamenteux à base de lipides principalement parce qu’ils offrent ce que l’on appelle un effet furtif au produit médicamenteux lorsqu’il circule dans le corps. Le système immunitaire humain est poussé à protéger le corps de tout corps étranger, et les nanoparticules médicinales ne font pas exception. Pour aider à l’efficacité de la livraison et pour permettre plus de temps de circulation pour les molécules cargo pour atteindre les sites de maladies prévues, le PEG est ajouté pour protéger ces nanoparticules en empêchant les protéines du plasma sanguin d’absorber dans la surface du liposome, augmentant la durée de vie de la circulation sanguine.1
Le deuxième avantage de la PEGylation est une augmentation de la stabilité pour les nanostructures de type liposome. Les liposomes conventionnels, en particulier ceux dont la taille est inférieure à 200 nm, peuvent être instables par eux-mêmes et ont tendance à fusionner entre eux pour réduire la tension de surface. Cela peut entraîner une perte du médicament encapsulé ou un mélange défavorable de la cargaison des différentes vésicules. Les fabricants de médicaments ont appris à surmonter ce problème en recouvrant l’extérieur des liposomes de polymères comme le PEG.
Ces nanoparticules équipées de manière furtive ont donné lieu à une nouvelle génération de formulations liposomales et à de multiples produits cliniquement approuvés. Les liposomes PEGylés et les LNP sont actuellement le nouveau paradigme pour la plupart des thérapies contre le cancer.
LNP dans la thérapie génique
Pendant longtemps, la façon la plus efficace de délivrer des thérapies géniques aux cellules humaines était d’utiliser un virus qui avait été modifié pour porter une cargaison médicinale plutôt que des gènes nocifs et auto-réplicatifs. Cette méthode est encore utilisée de temps en temps aujourd’hui et est appelée « transfert de gène viral ». Cependant, l’administration de gènes non viraux est devenue populaire au cours des 20 dernières années en raison des profils de sécurité améliorés, des taux plus faibles de réactions immunogènes indésirables et de la facilité de fabrication. L’un des principaux moteurs de ce mouvement a été le développement de supports à base de lipides et de polymères, dont les LNP sont les plus populaires.
Les LNP utilisés pour délivrer des gènes sont principalement synthétisés en utilisant des lipides cationiques, ou chargés positivement, qui s’associent à des acides nucléiques anioniques, ou chargés négativement. D’autres composants à base de lipides peuvent également être ajoutés pour moduler l’efficacité de la libération et la localisation de la cargaison génétique. Les LNP offrent également une stabilité mécanique, une morphologie contrôlée et une distribution de taille étroite.1
Les matériaux inorganiques, les matériaux organiques et les hydrogels ont tous été explorés en tant que noyaux pour les nanoparticules liposomales, encapsulées dans un nombre variable de couches lipidiques qui forment l’enveloppe. L’une des variantes les plus réussies de ces nanoparticules hybrides intègre des polymères PLA ou PGLA dans une monocouche lipidique. Ces deux biopolymères de base sont particulièrement utiles pour l’administration de médicaments, car ils facilitent la libération contrôlée des médicaments1.

La formulation de nanoparticules présentée ci-dessus est un hybride lipide-polymère avec un noyau PGLA hydrophobe et une enveloppe lipide-PEG hydrophile.
Un domaine en expansion
« Les liposomes ont parcouru un long chemin pour devenir une classe de transporteurs de médicaments validés… Une variété croissante de nanostructures de type liposome est en cours de développement, chacune ayant des forces uniques adaptées à des tâches spécifiques de livraison de médicaments. Parallèlement, la compréhension des interactions entre ces nanostructures et les systèmes biologiques progresse rapidement. Une quantité importante d’informations sur leur temps de circulation, leur accumulation dans les tissus et leur toxicité potentielle a été obtenue. Il est certain que les nanocarriers de type liposome joueront un rôle plus important pour l’administration de médicaments dans un avenir prévisible. »
– Nanostructures de type liposome pour l’administration de médicaments | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Alors que des travaux importants sont en cours dans le développement d’agents médicinaux à libération contrôlée et nanocompartimentés, les liposomes et les LNP sont des options particulièrement prometteuses. Ces structures offrent une morphologie unique, naturellement stable et semblable à celle des cellules pour les nanomédicaments, et sont prêtes à progresser vers des stratégies thérapeutiques plus avancées. Exelead relève de tels défis, y compris le développement de nanogels qui incorporent un éventail de produits biologiques et de petites molécules.
Depuis que les liposomes ont été proposés pour la première fois comme système d’administration de médicaments à la fin des années 1960, des variations de structure et de fonctionnalité ont émergé, offrant des avancées précieuses en termes de ciblage des maladies. Les médicaments LNP ont fait leur apparition dans l’industrie pharmaceutique comme thérapies conçues pour délivrer des agents anticancéreux, des antibiotiques, des médicaments génétiques, des anesthésiques et des anti-inflammatoires3.
« Dans les applications cliniques, les médicaments liposomaux se sont avérés être les plus utiles pour leur capacité à s’accumuler « passivement » aux sites de perméabilité accrue du système vasculaire, lorsque leur diamètre moyen se situe dans la gamme ultrafiltrable (<200 nm de diamètre), et pour leur capacité à réduire les effets secondaires des médicaments encapsulés par rapport aux médicaments libres. Il en résulte une augmentation globale de l’indice thérapeutique, qui mesure l’efficacité par rapport à la toxicité. »
– Systèmes d’administration de médicaments liposomaux : du concept aux applications cliniques | Allen TM, Cullis PR 3
Applications en médecine personnalisée – une nouvelle ère dans les stratégies thérapeutiques
Contrairement aux approches traditionnelles, de type big-pharma, du traitement des maladies, la médecine personnalisée tient compte des différences individuelles dans le mode de vie, l’environnement et la biologie – y compris la génétique d’un patient.
Ceci est extrêmement applicable à des maladies comme le cancer. Même au sein d’un même type de cancer, les types de tumeurs diffèrent d’un patient à l’autre, et comprendre la mutation génétique particulière qu’un patient a développée permet aux médecins d’employer des traitements plus spécifiques et plus précis.4
Avec l’avènement des thérapies génétiques personnalisées, les médecins et les scientifiques peuvent adapter efficacement un ingrédient pharmaceutique actif – souvent de l’ARN ou de l’ADN – pour qu’il corresponde au profil de maladie spécifique d’un patient particulier ou d’un petit groupe de patients. Cette approche du ciblage hyper-spécifique de la maladie augmente l’efficacité et diminue les effets secondaires indésirables pour des groupes de patients similaires.
LNPs comme véhicules de livraison pour les oligonucléotides
Parce qu’une grande partie du domaine croissant de la médecine personnalisée se concentre sur les thérapies génétiques, les LNPs sont devenus particulièrement utiles comme plateforme de livraison de médicaments. Tout oligonucléotide pourrait théoriquement être encapsulé dans un liposome ou un LNP, mais les siRNA sont actuellement la cargaison la plus courante dans ces types de produits pharmaceutiques.
En théorie, les segments de siRNA peuvent être conçus pour réduire au silence n’importe quel gène, ce qui est un concept passionnant pour les médecins et les chercheurs. Malheureusement, la livraison d’ARN libre et non encapsulé dans les cellules humaines est difficile, car ils sont gros, instables dans le sérum et enclins à la dégradation par les nucléases.5
Bien que les chercheurs aient fait des tentatives pour stabiliser l’ARNsi dans le sérum en ajoutant des liaisons phosphorothioate, des doses élevées sont nécessaires pour réduire efficacement les gènes au silence chez les humains. Les LNPs ont apporté une solution à ce problème en fournissant des moyens d’encapsulation flexibles et faciles, protégeant les segments de siRNA jusqu’à ce qu’ils atteignent leur destination prévue et facilitant leur livraison dans les cellules cibles.5
« Les LNPs contenant des lipides cationiques ionisables ont un certain nombre de caractéristiques nécessaires pour la livraison systémique d’acides polynucléiques, y compris de petites tailles, une stabilité sérique, de faibles potentiels zéta de surface à un pH physiologique, et une charge cationique à des valeurs de pH acides (par exemple, dans les endosomes). En outre, en tirant parti des processus de ciblage « endogènes » dus à l’association avec l’ApoE après l’administration, il est possible d’obtenir une absorption très efficace dans les hépatocytes après une administration i.v., ce qui permet d’obtenir d’excellentes capacités d’extinction des gènes. »
– Systèmes de délivrance de nanoparticules lipidiques pour les thérapeutiques à base de siRNA | Wan C, Allen TM, Cullis PR 5
Petites tailles de lots
Les produits pharmaceutiques personnalisés sont souvent fabriqués en petites tailles de lots pour des patients uniques ou de petites populations et peuvent fréquemment donner lieu à moins d’un litre de produit. En revanche, les lots de fabrication traditionnels des produits pharmaceutiques courants produisent souvent des milliers de litres de produit médicamenteux à l’échelle. La médecine personnalisée nécessite une approche unique, et chaque lot doit être fabriqué dans des conditions cGMP strictes.
Alors que la médecine personnalisée est devenue une préoccupation majeure dans le développement de médicaments, de nombreuses entreprises de l’industrie de la fabrication pharmaceutique ont adapté leurs pipelines pour accueillir de plus petits lots destinés à de petits groupes de patients en plus de la production traditionnelle de médicaments à grande échelle.
A Exelead, des efforts considérables ont été déployés pour accueillir ces produits thérapeutiques en petits lots, qui nécessitent souvent des API coûteux et des délais d’exécution rapides. Les médicaments spécifiques à un patient ou à un antigène ne laissent pas beaucoup de temps entre le moment où l’oligonucléotide est séquencé et le moment où le produit doit être formulé sur notre site. Ces prévisions à court terme, parfois seulement six semaines, présentent des défis que nous avons pu surmonter en affinant nos systèmes existants et en incorporant des techniques de formulation innovantes.
Applications répandues
Bien que la médecine personnalisée ait le potentiel de traiter presque toutes les maladies, la recherche actuelle s’est principalement concentrée sur 1) les immunothérapies, 2) les thérapies conventionnelles augmentées via la pharmacogénomique et 3) les traitements du cancer liés aux biomarqueurs. Les liposomes et les LNP ont une application en tant que véhicules de livraison pour chacune de ces catégories de médicaments, ce qui en fait un atout indispensable dans ce nouveau domaine du développement pharmaceutique.

Articles de référence
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal de la chimie des matériaux B, matériaux pour la biologie et la médecine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Tendances émergentes en matière de recherche et de développement clinique des systèmes de délivrance de médicaments à base de liposomes et de nanoparticules lipidiques. Journal des sciences pharmaceutiques. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Systèmes d’administration de médicaments liposomaux : Du concept aux applications cliniques. Revues avancées de livraison de médicaments. 2013 Jan;65(1):36-48
- Esposito L. Que signifie vraiment la médecine personnalisée ? US News : Soins de santé. 2018 Jan ;
- Wan C, Allen TM, Cullis PR. Systèmes d’administration de nanoparticules lipidiques pour les thérapeutiques à base de siRNA. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi : 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Médecine personnalisée : Partie 1 : évolution et développement en théranostique. Pharmacie et thérapeutique. 2010;35(10):560-576.