Introduction
L’infection par le virus de l’hépatite B (VHB) est la cause la plus fréquente de cirrhose du foie et de carcinome hépatocellulaire dans la plupart des régions d’Asie1,2. La pathogenèse de l’hépatite chronique est médiée par l’interaction entre la réaction immunitaire de l’hôte et les hépatocytes qui présentent les antigènes du VHB.3,4 Des études antérieures ont démontré que l’expression des antigènes du VHB par les hépatocytes est étroitement liée au stade et à l’activité de la maladie hépatique chronique. Dans la phase de tolérance immunitaire, les antigènes centraux de l’hépatite B (HBcAg) se trouvent principalement dans le noyau et sont en corrélation avec la réplication du VHB, tandis que dans la phase de clairance immunitaire qui suit, un déplacement intrahépatique des HBcAg du noyau vers le cytoplasme se produit et est associé aux activités histologiques de l’hépatite chronique5,6. Dans les cas d’expression intrahépatique de l’antigène de surface de l’hépatite B (HBsAg), trois modèles – le type homogène, l’hépatocyte en verre dépoli (GGH) de type I et le GGH de type II – ont été signalés. Les schémas homogènes de présentation groupée, discrète ou faible ont été observés chez les patients présentant une virémie élevée ou une hépatite active. Les GGH de type I sont typiquement dispersés de manière isolée dans les lobules hépatiques avec une expression homogène dense de type inclusion, tandis que les GGH de type II expriment des antigènes de surface à la périphérie des hépatocytes, qui se regroupent en groupes, et sont généralement présents pendant la phase de faible réplication et deviennent prévalents de l’hépatite active à la cirrhose du foie et au carcinome hépatocellulaire.7-10 Par conséquent, les expressions intrahépatiques de l’Ag HBc et de l’Ag HBs sont étroitement liées à l’évolution naturelle de l’infection et à la réplication du VHB.
Parmi les phases de l’hépatite B chronique, la phase de clairance immunitaire ou nommée hépatite B chronique AgHBe positive se produit souvent dans une population plus jeune, présente des activités histologiques moins sévères et abrite moins de taux de mutation précore A1896 et de mutations T1762/A1764 du promoteur basal core (BCP) que l’hépatite B chronique AgHBe négative11.-L’évolution de l’hépatite B chronique est dynamique et résulte de l’interaction entre la réplication virale et le système immunitaire de l’hôte. Par conséquent, la diversité des caractéristiques cliniques ou des activités histologiques est couramment observée chez les patients AgHBe positifs. Par exemple, 34 à 55% des patients présentent une fibrose de transition ou une cirrhose dans l’histologie du foie, tandis que les autres patients présentent une fibrose légère.15,16 Il a été démontré que l’accumulation de l’HBsAg dans les hépatocytes est associée à des mutations virales spécifiques et liée aux activités de la maladie.8,9 Il est intéressant d’étudier les caractéristiques de l’expression intrahépatique de l’HBsAg chez les patients présentant une gravité différente de l’histologie du foie.
Les mutants viraux évoluent généralement sous la pression de la surveillance immunitaire de l’hôte. Parmi les mutants naturels du VHB, les mutations BCP T1762/A1764 sont devenues prévalentes au fur et à mesure de la progression de la maladie et il a été fréquemment constaté qu’elles étaient associées à une maladie hépatique avancée et à un carcinome hépatocellulaire17,18. Les modèles d’expression intrahépatique de l’HBsAg ont également changé au cours de l’évolution naturelle de l’hépatite B chronique. L’association des mutations BCP T1762/A1764 et de l’expression intrahépatique de l’HBsAg est encore inconnue et reste à étudier.
C’est pourquoi le but de cette étude était d’évaluer les caractéristiques de l’expression intrahépatique de l’Ag HBs et d’analyser l’association avec l’histologie du foie, les marqueurs de réplication virale et les mutants du VHB dans l’hépatite B chronique positive à l’Ag HBe.
Matériel et méthodesPatients
Un total de 181 patients positifs à l’antigène e de l’hépatite B (Ag HBe) n’ayant jamais été traités et répondant aux critères d’inclusion ont été inscrits rétrospectivement dans cette étude. Les critères d’inclusion étaient les suivants : un âge supérieur à 18 ans et inférieur à 70 ans, un taux sérique d’AgHBs positif depuis plus de 6 mois et un taux sérique d’ADN du VHB ≥ 100 000 copies/mL, un taux sérique anormal d’alanine aminotransférase, aucune autre étiologie explicable d’hépatite chronique, y compris l’alcool, une hépatite auto-immune ou des marqueurs d’une infection par le virus de l’hépatite C, le virus de l’hépatite D ou le virus de l’immunodéficience humaine, et l’absence d’antécédents de traitement anti-VHB et de spécimen de biopsie du foie disponible pour une évaluation histologique. Le sérum et la biopsie du foie de tous les patients ont été prélevés avant les traitements antiviraux, et les échantillons ont été conservés à -70 oC jusqu’au moment des tests. Cette étude a été approuvée par le conseil d’examen institutionnel de l’hôpital universitaire national Cheng Kung (n° ER-99-398). Le consentement éclairé a été obtenu, conformément à la Déclaration d’Helsinki.
Tests virologiques du VHB
Le génotypage du VHB a été effectué par la réaction en chaîne par polymérase multiplex, comme décrit ailleurs.19 Le niveau d’ADN du VHB sérique a été mesuré à l’aide du test COBAS Amplicor HBV Monitor (test COBAS-AM, Roche Diagnostics, Branchburg, NJ). Le taux sérique d’Ag HBs a été quantifié par le test Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, France) avec une plage dynamique de 0,05-250,0 UI/mL. Les échantillons présentant des taux d’Ag HBs > 250 UI/mL ont été retestés à des dilutions de 1:20 et 1:1000.
Réaction en chaîne par polymérase et séquençage des régions précore et BCP
L’ADN du VHB a été extrait de 50 μL de sérum à l’aide du kit Mini génomique pour le sang et les tissus (VIOGENE, Taipei, Taïwan). La PCR de premier tour a été réalisée dans les conditions suivantes : 96 oC pendant 2 min, 94 oC pendant 1 min, 54 oC pendant 1 min et 72 oC pendant 2 min avec les amorces 5′-ACCTCTGCACGTAGCATGG (avant) et 3′-GGATTAAAGACAGGTACAGTAGAAG (arrière). Une PCR de deuxième tour a été réalisée dans les mêmes conditions avec les amorces 5′-ATGTCAACGACCGACCTTGA (sens direct) et 3′-TTCCCACCTTATGAGTCCAAG (sens inverse). Les produits PCR purifiés ont ensuite été séquencés directement à l’aide d’un séquenceur d’ADN automatisé ABI 310 et du kit ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction (Applied Biosystems) avec l’amorce directe qui a été utilisée lors de la PCR de deuxième tour.
L’histologie du foie
L’histologie du foie a été évaluée par un seul pathologiste qui ne connaissait pas les antécédents des patients. La nécro-inflammation et la fibrose ont été évaluées sur la base du grade de nécro-inflammation de Knodell (allant de 0 à 18)20 et du stade de fibrose d’Ishak (allant de 0 à 6),21 respectivement.
La coloration immunohistochimique a été réalisée comme décrit ailleurs22. Brièvement, des sections déparaffinées de 5 μm d’épaisseur ont été incubées avec des anticorps monoclonaux de souris anti-HBsAg (Clone 3E7, Dako Corp, Carpinteria,USA) et anti-HBcAg (Novocastra Laboratories, Newcastle, UK) pendant une nuit à 4°C. La dilution optimale de l’anti-HBsAg ou de l’anti-HBcAg a été déterminée en utilisant le tissu hépatique d’un porteur du VHB comme contrôle positif. Le kit StrAviGen Super Sensitive MultiLink Kit (BioGenex) a été utilisé pour détecter le complexe immunitaire résultant. L’activité de la peroxydase a été visualisée par un kit de substrat aminoéthylcarbazole (Zymed Laboratory, Inc, San Francisco, CA). Enfin, les sections ont été contre-colorées avec de l’hématoxyline. Comme contrôle négatif, de l’immunoglobuline de souris non immunisée a été substituée à l’anticorps primaire dans l’incubation. Les profils d’expression de l’Ag HBc dans le noyau, le cytoplasme, ou les deux, ont été enregistrés. Les profils d’expression de l’Ag HBs ont été classés comme homogènes, GGH de type I, GGH de type II.22 Les hépatocytes colorés de façon homogène ont été identifiés comme étant des hépatocytes avec une coloration cytoplasmique homogène modérée à forte ; les GGH de type I ont été identifiés comme étant des hépatocytes avec une coloration globulaire dense ou de type « inclusion », et les GGH de type II ont été identifiés comme étant des hépatocytes avec une coloration de l’antigène de surface sur les bords de la cellule ou à la périphérie.6,22 Les GGH de type I se dispersent isolément ou se regroupent dans les lobules hépatiques tandis que les GGH de type II se regroupent systématiquement dans les nodules. Les niveaux d’expression de l’AgHBc et de l’AgHBs ont été notés de façon semi-quantitative en fonction de la proportion de cellules immunomarquées, sur une échelle de 0 à 4+, correspondant à une positivité dans 0, 1-10, 11-25, 25-50% et plus de 50% des hépatocytes examinés.
Analyses statistiques
Les données ont été exprimées en moyenne ± écart-type. Les variables continues ont été comparées en utilisant le test U de Mann-Whitney ou l’ANOVA de Kruskal-Wallis pour l’analyse univariée. Les variables catégorielles ont été analysées à l’aide du test χ2 ou du test exact de Fisher. Les facteurs indépendants qui étaient associés aux niveaux d’expression intrahépatique de l’Ag HBs ont été réalisés à l’aide d’une analyse de régression logistique multivariée. Le traitement des données et les analyses statistiques ont été effectués à l’aide du logiciel SPSS pour Windows, version 17.0 (SPSS Inc., Chicago, IL).
RésultatsCaractéristiques des patients inscrits
Le tableau 1 présente les caractéristiques démographiques des 181 patients inscrits. La plupart des patients étaient des hommes (69,1 %) et 63,0 % d’entre eux présentaient le génotype C du VHB. La mutation précore A1896 a été détectée chez 20 patients (11,0 %) et les mutations BCP T1762/A1764 ont été détectées chez 38 patients (21,0 %). Sur les 181 patients, une coloration positive de l’AgHBs a été détectée chez 105 patients (58,0 %). Les patients présentant une coloration de l’AgHBs présentaient un taux sérique d’AgHBs significativement plus élevé (P
Caractéristiques cliniques, virologiques et histologiques des 181 patients.
| Caractéristiques | Valeur | |||
|---|---|---|---|---|
| Expression de HBsAg | Valeur P | |||
| Tous les patients (n = 181) | Négatifs (n = 76) | Positifs (n = 105) | ||
| Age (ans) ± SD | 36.4 ± 10.5 | 34,2 ± 9,2 | 38,0 ± 11,2 | 0,009 |
| Genre (homme/femme) | 125/56 | 50/26 | 75/30 | 0.418 |
| Niveau moyen d’AST (U/L) ± SD | 59,7 ± 51,2 | 58,7 ± 42,5 | 60,5 ± 56.8 | 0,634 |
| Niveau moyen d’ALT (U/L) ± SD | 116,3 ± 124,2 | 120,2 ± 100,8 | 113,5 ± 139.1 | 0,282 |
| Génotype HBV (B/C) | 114/67 | 66/10 | 48/57 | |
| Précore : G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutant/sauvage | 38/143 | 12/64 | 26/79 | 0,144 |
| ADN du VHB (log copies/mL) | 8,4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | |
| Niveau d’AgHBs ((log UI/mL) | 4,2 ± 0.7 | 8,1 ± 1,0 | 8,6 ± 1,1 | 0,003 |
| Grade moyen de nécro-inflammation de Knodell ± SD | 5.0 ± 3,0 | 5,3 ± 2,8 | 4,7 ± 3,0 | 0,128 |
| Stade moyen de fibrose d’Ishak ± SD | 1,8 ± 1,6 | 1,7 ± 1,2 | 1,9 ± 1,7 | 0.703 |
Mutant, T1762 et A1764 ; sauvage, A1762 et T1764. Le test du χ2 a été utilisé pour les variables du sexe, du génotype du VHB, des mutations du promoteur du noyau précore et basal, tandis que le test U de Mann-Whitney a été utilisé pour les autres variables. AST : aspartate aminotransférase. ALT : alanine aminotransférase. BCP : promoteur central basal. VHB : virus de l’hépatite B.
Types de distribution de l’expression de l’Ag HBs
Par rapport aux 105 patients qui ont présenté une expression de l’Ag HBs, un modèle homogène (figure 1A) a été détecté chez 34 (32.4 %), une GGH de type I (figure 1B) a été détectée chez 50 (47,6 %), une GGH de type II (figure 1C) a été détectée chez sept (6,7 %), et un schéma mixte a été détecté chez 14 (13,3 %). Comme indiqué dans le tableau 2, une prévalence plus élevée de mutations BCP T1762/A1764 a été observée dans le GGH de type II (P =0,001) par rapport aux autres schémas. Il y avait une relation réciproque entre l’expression de l’Ag HBs et les marqueurs de réplication virale sériques. La figure 1D montre que les patients présentant une expression de la GGH de type II avaient des niveaux d’ADN du VHB et des titres d’AgHBs plus faibles, mais des niveaux d’expression de l’AgHBs intrahépatique plus élevés (figure 1D). En outre, l’histologie du foie a montré que le type II GGH présentait des activités de nécro-inflammation et de fibrose du foie significativement plus sévères, et un niveau plus élevé d’expression intrahépatique de l’HBsAg (Figure 1E).
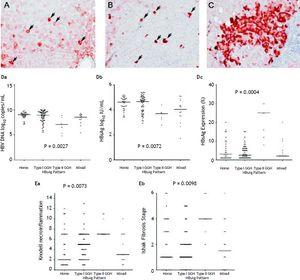
Modèles de rétention de l’Ag HBs. A. Quelques hépatocytes modérément à fortement colorés par l’Ag HBs de façon homogène au niveau du cytoplasme (flèches) dans un fond d’hépatocytes faiblement colorés. Le noyau de chaque hépatocyte coloré de façon homogène était situé au centre de la cellule. B. L’hépatocyte en verre dépoli de type I (GGH) avec une coloration dense de l’HBsAg sous forme de globules ou d’inclusions (flèches) est dispersé dans le parenchyme hépatique. C. Un groupe de GGH de type II présentait une coloration de l’AgHBs à la marge ou à la périphérie de la cellule. Corrélations entre les profils d’expression de l’Ag HBs et le niveau d’ADN du VHB sérique (Da), le niveau d’Ag HBs sérique (Db) et le niveau d’expression de l’Ag HBs intrahépatique (Dc). L’association des profils d’expression de l’Ag HBs et du grade de nécro-inflammation de Knodell (Ea) et du stade de fibrose d’Ishake (Eb). Les comparaisons entre les groupes ont été analysées par ANOVA de Kruskal-Wallis.
Caractéristiques démographiques selon les schémas de distribution f expression de l’Ag HBs.
| Type d’AgHBs (n = 105) | |||||
|---|---|---|---|---|---|
| Mélangé (n = 14) | Homogène | Type I GGH | Type II GGH | Valeur P | |
| (n = 34) | (n = 50) | (n = 7) | |||
| Age (ans) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 |
| Sexe (homme/femme) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 |
| Niveau moyen d’AST (U/L) ± SD | 64,9 ± 56,5 | 61,1 ± 38,6 | 49,9 ± 28,3 | 122.4 ± 168,7 | 0,474 |
| Niveau moyen d’ALT (U/L) ± SD | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0,651 |
| Génotype HBV (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 |
| Précoeur : G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 |
| BCP:* mutant/sauvage | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 |
| ADN du VHB (log copies/mL) | 3,9 ± 1,0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 |
| Taux d’AgHBs ((log UI/mL) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | |
| Nécro-inflammation des knodelles grade ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 |
| Stade de fibrose d’Ishak ± SD | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutant, T1762 et A1764 ; sauvage, A1762 et T1764. Le test du χ2 a été utilisé pour les variables du sexe, du génotype du VHB, des mutations du promoteur du noyau précore et basal, tandis que le test U de Mann-Whitney a été utilisé pour les autres variables. AST : aspartate aminotransférase. ALT : alanine aminotransférase. BCP : promoteur central basal. VHB : virus de l’hépatite B.
Niveau d’expression de l’AgHBs
Les figures 2A à 2D illustrent la mesure semi-quantitative de l’expression de l’AgHBs. Aucun patient n’avait une échelle 4+ d’expression de l’Ag HBs dans cette étude. Une relation réciproque entre la réplication virale et l’histologie du foie a été observée. Les patients présentant des échelles 2+/3+ d’expression de l’Ag HBs avaient des niveaux plus faibles de titres d’Ag HBs et de niveaux d’ADN du VHB, mais un grade de nécro-inflammation et un stade de fibrose significativement plus sévères que les patients présentant une échelle 1+ d’expression de l’Ag HBs et une coloration négative de l’Ag HBs (Figure 2E). Les patients présentant un score de nécro-inflammation de Knodell ≥ 5 ou un stade de fibrose d’Ishake ≥ 1 présentaient des pourcentages significativement plus élevés d’expression de l’Ag HBs (Figure 3).
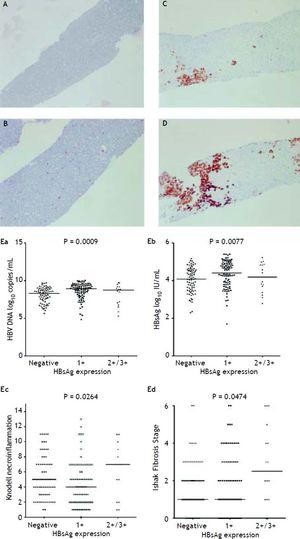
Expression de l’AgHBs mesurée de façon semi-quantitative selon la proportion de cellules immunomarquées, sur une échelle de 0 à 3+, correspondant à une positivité dans (A) 0% (0), (B) 1-10% (C) 11-25% (2+), et (D) 25-50% (3+) des hépatocytes examinés. Corrélations entre le niveau d’expression de l’Ag HBs et les taux sériques d’ADN du VHB (Ea) et d’Ag HBs (Eb), ainsi que le grade de nécro-inflammation de Knodell (Ec) et le stade de fibrose d’Ishak (Ed). Les comparaisons entre les groupes ont été analysées par ANOVA de Kruskal-Wallis.

Corrélation de l’expression de l’Ag HBs intrahépatique avec le grade de nécro-inflammation de Knodell (A) et le stade de fibrose d’Ishak (B). Les comparaisons entre les groupes ont été analysées par le test U de Mann-Whitney.
Caractéristiques cliniques de l’expression de l’Ag HBs
En premier lieu, nous avons examiné l’association des facteurs viraux et de l’expression de l’Ag HBc/Ag HBs. L’expression de l’AgHBs, et non celle de l’AgHBc, a montré un niveau significativement plus faible en présence d’une mutation précore (P = 0,001). Les patients de génotype C présentaient un stade de fibrose hépatique plus important (P = 0,004). Chez les patients présentant les mutations BCP T1762/A1764, le degré de nécro-inflammation et le stade de fibrose étaient significativement plus élevés, et l’expression de l’HBcAg était plus faible, que ce soit dans le cytoplasme ou dans le noyau. Toutes ces observations indiquent une lésion hépatique active. De plus, les patients présentant les mutations BCP T1762/A1764 présentaient une expression intrahépatique de l’AgHBs plus élevée (9,3 ± 8,0 % contre 4,3 ± 5,0 %, P = 0,008) (tableau 3). De plus, nous avons examiné les facteurs qui peuvent être associés aux niveaux d’expression de l’Ag HBs. Dans le tableau 4, 16 patients présentaient des niveaux 2+/3+ d’expression de l’Ag HBs et 1+ dans celui des 89 patients. Une analyse univariée a montré que les niveaux 2+/3+ d’expression de l’AgHBs étaient associés aux mutations BCP T1762/A1764 et à une nécro-inflammation et une fibrose hépatiques plus sévères. Une analyse de régression multivariée a révélé que les mutations BCP T1762/A1764 était le facteur indépendant qui était associé aux échelles 2+/3+ de l’expression intrahépatique de l’AgHBs.
Cliniques, virologiques et histologiques des patients avec ou sans mutants viraux.
| Mutation Précoeur | P valeur | Mutations BCP | P valeur | |||
|---|---|---|---|---|---|---|
| Non (n = 98) | Oui (n = 7) | Non (n = 79) | Oui (n = 26) | |||
| Age (ans) ± SD | 37.8 ±11.0 | 40.0 ± 13.7 | 0.541 | 36,0 ± 10,6 | 43,8 ±11,1 | 0,005 |
| Sexe (homme/femme) | 70/28 | 5/2 | 1,000 | 54/25 | 21/5 | 0.318 |
| Taux moyen d’AST (U/L) ± SD | 60.0 ± 58.3 | 71.3 ± 30.5 | 0.072 | 51.5 ± 32.1 | 87.3 ± 95.6 | 0,007 |
| Niveau moyen d’ALT (U/L) ±SD | 112,2 ± 143,6 | 131,6 ± 39,1 | 0,031 | 98,2 ± 77,9 | 160,0 ± 242.0 | 0,080 |
| Génotype HBV (B/C) | 45/53 | 3/4 | 1,000 | 44/35 | 4/22 | |
| Précoeur : G1896/A1896 | 6/73 | 1/25 | 0,678 | |||
| BCP:* mutant/sauvage | 25/73 | 1/6 | 0.678 | |||
| ADN du VHB (log copies/mL) | 3,9 ± 1,0 | 4,5 ± 0.5 | 0,959 | 4,5 ± 0,6 | 3,7 ± 0,6 | |
| Taux d’AgHBs ((log UI/mL) | 8.2 ± 1,1 | 8,9 ± 0,7 | 0,892 | 8,8 ± 0,9 | 7,7 ± 1,4 | |
| Nécro-inflammation des nodules grade ± SD | 4,6 ± 3,0 | 6.1 ± 3,1 | 0,142 | 3,9 ± 2,7 | 7,2 ± 2,7 | |
| Stade de fibrose d’Ishak ± SD | 1,8 ± 1,8 | 2,1 ± 0,9 | 0.286 | 1,3 ± 1,4 | 3,4 ± 1,6 | |
| Expression cytoplasmique de l’HBcAg (%) | 53,6 ± 25,8 | 44,3 ± 30,5 | 0,402 | 56,3 ± 25.4 | 42,7 ± 25,8 | 0,018 |
| Expression nucléaire de l’HBcAg (%) | 13,5 ± 17,3 | 17,6 ± 31,6 | 0,800 | 17,6 ± 20,0 | 2,3 ±4.1 | |
| Expression de HBsAg (%) | 5,8 ± 6,5 | 2,4 ± 1,5 | 0,274 | 4,3 ± 5,0 | 9,3 ± 8,0 | 0.003 |
Mutant, T1762 et A1764 ; sauvage, A1762 et T1764. Le test χ2 a été utilisé pour les variables de sexe, de génotype VHB, de mutations du promoteur du noyau précore et basal, tandis que le test U de Mann-Whitney a été utilisé pour les autres variables. AST : aspartate aminotransférase. ALT : alanine aminotransférase. BCP : promoteur central basal. VHB : virus de l’hépatite B.
L’association des caractéristiques démographiques et des degrés d’expression de l’Ag HBs.
| Univariée | Multivariée | ||||
|---|---|---|---|---|---|
| Expression de l’AgHBs, échelle | 1+ (n = 89) | 2+/3+ (n = 16) | P value | Odds ratio (95% CI) | P value |
| Age | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0,963 (0,903-1,026) | 0,242 |
| Sexe (homme/femme) | 63/26 | 12/4 | 1.000 | ||
| Niveau d’EST (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0,142 |
| Niveau d’ALT (U/L) | 103,3 ± 84,4 | 170,1 ± 297,2 | 0,386 | 0,991 (0,978∼1.005) | 0,216 |
| Génotype HBV (B/C) | 42/47 | 6/10 | 0,589 | 0,994 (0,234∼4,231) | 0.994 |
| Mutation A1896 (+/-) | 7/82 | 0/16 | 0.592 | 0.000 (0.000∼) | 0.999 |
| BCP:*mutant/Sauvage | 17/72 | 9/7 | 0.003 | 6.356 (1.204∼33.356) | 0.029 |
| Niveau d’HBsAg (log10IU/mL) | 4,3 ± 0,7 | 4,2 ± 0,8 | 0,180 | 2,096 (0,598∼7,349) | 0.247 |
| ADN du VHB sérique (log10 copies/mL) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0,386∼1,383) | 0.335 |
| Gradation de la nécro-inflammation de Knodell | 4,4 ± 2,9 | 6,3 ± 3,3 | 0,027 | ||
| Stade de fibrose d’Ishak | 1.7 ± 1,6 | 2,9 ± 2,1 | 0,041 | ||
| Expression cytoplasmique de l’HBcAg (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | ||
| HBcAg expression nucléaire (%) | 14,4 ± 18,3 | 10.1 ± 19,3 | 0,389 | ||
Mutant, T1762 et A1764 ; sauvage, A1762 et T1764. Analyse univariée : le test du χ2 a été utilisé pour les variables du sexe, du génotype du VHB, des mutations du promoteur du noyau précore et du noyau basal, tandis que le test U de Mann-Whitney a été utilisé pour les autres variables. Analyse multivariée : Analyse de régression logistique exprimée en Odds ratio avec intervalle de confiance à 95 % et valeurs P. AST : aspartate aminotransférase. ALT : alanine aminotransférase. BCP : promoteur central basal. VHB : virus de l’hépatite B.
Discussions
L’expression intrahépatique de l’AgHBs est associée à différents stades de réplication et à l’évolution de la maladie au cours de l’évolution naturelle de l’hépatite B chronique.7,10,23 La GGH de type I se présente principalement au stade de l’hépatite active tandis que la GGH de type II se présente principalement au stade de l’hépatite inactive ou de la cirrhose.8 Dans cette étude, nous avons démontré que la GGH de type II était associée à une histologie hépatique plus sévère, accompagnée de niveaux sériques d’ADN du VHB et de titres d’AgHBs significativement plus faibles, et de niveaux relativement plus élevés d’expression intra-hépatique de l’AgHBs. Cette relation réciproque entre l’histologie du foie et la réplication du VHB indique que la présence de l’HGH de type II pourrait être un marqueur d’une maladie hépatique avancée au cours de l’évolution de la maladie dans l’hépatite B chronique AgHBe positive. On a signalé que les modèles d’expression de l’AgHBs sont liés à des mutations virales distinctes qui ont des impacts sur la régulation de la réplication du VHB et sur le défaut de sécrétion de l’antigène de surface par les hépatocytes9,24. La GGH de type II héberge systématiquement des mutations de délétion Pre-S2 qui diminuent la synthèse des protéines de surface moyennes et entraînent ensuite une accumulation de grandes protéines de surface dans les hépatocytes et un défaut de sécrétion de l’HBsAg.25 Dans cette étude, nous avons effectué une corrélation entre l’HBsAg sérique et l’ADN du VHB chez les patients avec ou sans GGH de type II. Une corrélation modérée entre les deux indicateurs de réplication du VHB a été observée chez les patients sans GGH de type II (r = 0,686, P 26,27 La délétion de Pre-S pourrait entraîner un stress du RE et activer la transduction du signal lié au stress. Les dommages oxydatifs de l’ADN des hépatocytes et la stimulation des mécanismes de réparation de l’ADN pourraient entraîner une instabilité génomique qui aggrave les lésions hépatiques et prédispose à la carcinogenèse.28
En plus des profils d’expression de l’Ag HBs, nous avons constaté que des niveaux d’expression plus élevés s’accompagnaient d’activités histologiques hépatiques plus graves et d’un taux plus élevé de mutations BCP T1762/A1764. Les mutations BCP T1762/A1764 sont fortement associées à des activités histologiques hépatiques sévères et au cancer du foie.29,30 A notre connaissance, il existe un lien fort entre le génotype C et la présence de mutations BCP T1762/A1764.30 Dans cette étude, le génotype C ne semble pas jouer de rôle dans le niveau d’expression de l’Ag HBs. En revanche, les mutations BCP T1762/A1764 se sont révélées fortement liées à l’expression de l’Ag HBs. En ce qui concerne la mutation virale, les mutations BCP T1762/A1764 peuvent servir de base à d’autres mutations du VHB, notamment la délétion pré-S et les mutants complexes fréquemment rencontrés en présence de mutations BCP T1762/ A1764. Les mutants complexes du VHB présentaient des défauts partiels ou complets dans l’expression et la sécrétion des protéines de surface, du noyau et de l’e.31 La sécrétion réduite de l’antigène de surface de l’hépatite B était en corrélation avec la localisation aberrante des protéines de surface dans l’ER et entraînait une expression élevée de l’Ag HBs. En outre, la mutation BCP T1762/A1764 est considérée comme une conséquence de l’aptitude virale en raison de la pression de sélection de la surveillance immunitaire de l’hôte. De même, les mutations pré-S2, logées dans les GGH de type II, coïncident avec les épitopes des cellules T et B restreintes par l’antigène leucocytaire humain.32 Il n’y a généralement pas de nécrose cellulaire ou d’infiltration de lymphocytes T autour des GGH de type II, ce qui suggère que le VHB avec l’émergence de la mutation de délétion pré-S2 est également un mutant d’échappement possiblement nouveau.33 Cependant, l’accumulation de l’antigène de surface dans les hépatocytes pourrait se produire sans porter aucune des mutations virales connues dans les génomes pré-S ou S ou dans les promoteurs de surface.31,34 Par conséquent, l’expression de l’Ag HBs pourrait être une séquence en association avec ou sans mutations virales.
Cette étude avait plusieurs limitations potentielles. Les observations de cette étude étaient basées sur une conception transversale rétrospective, mais aucun suivi longitudinal n’a été effectué. Le niveau d’expression de l’HBsAg dans les hépatocytes et la sévérité histologique peuvent varier entre les différentes parties du foie d’un même patient ; la biopsie du foie en elle-même ne peut représenter exactement aucun tissu hépatique à l’exception du noyau de la biopsie.
En résumé, les patients présentant un modèle GGH de type II ou des niveaux plus élevés d’expression intrahépatique de l’HBsAg ont montré la relation réciproque entre des activités histologiques hépatiques plus sévères et une capacité de réplication du VHB plus faible. La forte association entre l’expression intrahépatique de l’Ag HBs et les mutations BCP T1762/A1764 a indiqué que l’expression de l’Ag HBs pourrait éventuellement être considérée comme la manifestation histologique pendant l’évolution génomique du VHB sous la pression immunitaire de l’hôte.
Abréviations
- –
BCP : promoteur central basal.
- –
GGH : hépatocyte en verre dépoli.
- –
HBcAg : antigène central de l’hépatite B.
- –
HBeAg : antigène e de l’hépatite B.
- –
HBsAg : antigène de surface de l’hépatite B.
- –
HBV : virus de l’hépatite B.
Conflits d’intérêts
T.-.T. C. a reçu des fonds de recherche de Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation et Pfizer Inc. Il n’y a pas de conflit d’intérêts pour les autres auteurs.