
Les diurétiques sont un peu comme des vasopresseurs. Nous les utilisons tout le temps, donc nous avons l’impression de les connaître assez bien. Cependant, la quantité de preuves au niveau des ECR sur eux est scandaleusement faible. Ainsi, chaque fois qu’un ECR sur les diurétiques apparaît, cela vaut la peine de l’examiner attentivement.
L’essai 3T : les bases
Il s’agit d’un essai monocentrique en double aveugle impliquant 60 patients admis pour une insuffisance cardiaque aiguë et jugés résistants au furosémide IV à forte dose.1 Les patients ont été randomisés en trois groupes : métolazone orale, chlorothiazide intraveineux ou tolvaptan oral. Tous les patients ont continué à recevoir une perfusion titrée de furosémide. Le principal résultat était la perte de poids à 48 heures. L’étude a été financée par Otsuka Pharmaceuticals, fabricants du tolvaptan.
caractéristiques de base
Les critères d’inclusion nécessitaient une insuffisance cardiaque avec surcharge volumique, déterminée par l’un de ces deux critères :
- Cathétérisme de Swan-Ganz avec pression cunéiforme >19 mm plus hypervolémie à l’examen physique (œdème périphérique, ascite ou râles à l’auscultation)
- – ou-
- Au moins deux des éléments suivants :
- Odème périphérique
- Ascite
- Pression veineuse jugulaire >10 mm
- Odème pulmonaire à la radiographie pulmonaire
En outre, les patients devaient être résistants aux diurétiques. Ceci était défini comme ayant un débit urinaire de <2 litres sur 12 heures, alors qu’ils recevaient une dose de furosémide >240 mg/jour (ou une dose équivalente de bumétanide).
Les critères d’exclusion comprenaient :
- Nécessité d’une dialyse ou d’une ultrafiltration
- Débit de filtration glomérulaire <15 ml/min
- Tension artérielle systolique <85 mm
- Potassium<3 mEq/L
- Sodiumhors de l’intervalle 130-145 mEq/L
- Maladie hépatique avancée
- Utilisation d’inducteurs ou d’inhibiteurs puissants du CYP3A4 (qui peuvent interagir avec le tolvaptan)

Les caractéristiques de base sont indiquées ci-dessus. Les patients étaient en effet très résistants aux diurétiques (produisant en moyenne 1 litre d’urine dans les 12 heures précédant l’inclusion, malgré une dose énorme de ~600 mg/jour de furosémide). La plupart des patients présentaient une insuffisance cardiaque systolique sévère, souvent due à une maladie coronarienne. 93% des patients étaient sous diurétiques de l’anse avant leur admission, ce qui peut expliquer en partie leur degré de résistance aux diurétiques.
traitements
Les patients ont été randomisés pour recevoir de la métolazone par voie orale (5 mg PO BID), du chlorothiazide par voie IV (500 mg IV BID) ou du tolvaptan (30 mg par jour). L’utilisation de comprimés et de perfusions placebo a permis à l’étude de se dérouler en double aveugle (malgré l’utilisation de médicaments par voie orale et intraveineuse).
En plus des médicaments de l’étude, les patients ont reçu des doses agressives de furosémide, selon le protocole ci-dessous. L’objectif de débit urinaire était de 3 à 5 litres sur 24 heures.

primaryendpoint : perte de poids sur 48 heures
Le principal critère d’évaluation était la perte de poids sur 48 heures (mesurée à l’aide d’une balance debout). Celle-ci était équivalente dans tous les groupes, avec une perte moyenne d’environ 5 kg (figure ci-dessous, panneau de gauche).
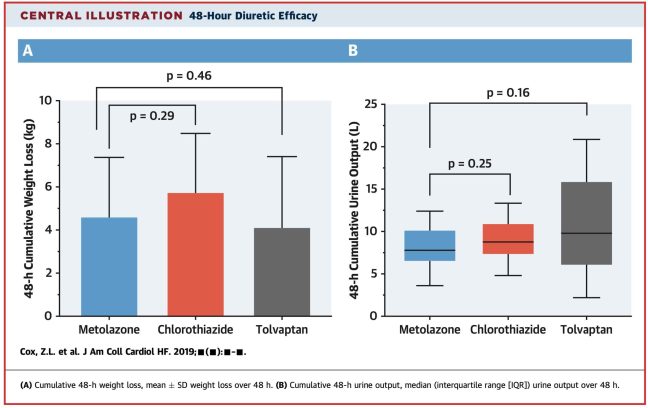
Ce critère d’évaluation primaire a cependant des limites massives. Il existe des façons extrêmement différentes pour les patients de perdre du poids, et celles-ci ont des conséquences cliniques différentes.
À titre d’expérience de pensée, imaginons que l’on commence avec un patient de 80 kg, qui pourrait avoir les volumes de fluide suivants :

D’abord, imaginons que nous retirons cinq litres d’eau sans électrolyte (panneau supérieur, ci-dessous). L’eau est librement distribuée dans les trois compartiments, elle sera donc retirée proportionnellement des trois composants. Le retrait de l’eau sans électrolyte réduit donc principalement le volume du compartiment intracellulaire, avec une diminution relativement faible du liquide interstitiel et du plasma (le volume du plasma ne diminue que de 400 ml).

Maintenant, imaginons que l’on retire cinq litres de liquide isotonique de l’organisme (par exemple, par hémodialyse). Le retrait du liquide isotonique drainera le liquide de l’espace extracellulaire (panneau du bas). Cela entraînera des réductions beaucoup plus importantes des volumes interstitiels et plasmatiques.
Donc, il est clair que le retrait d’un même volume de liquide peut avoir des conséquences cliniques différentes, selon la manière dont il est retiré. Dans l’insuffisance cardiaque, le vrai problème est un volume interstitiel et plasmatique excessif – donc ce que nous voulons vraiment faire, c’est retirer le liquide isotonique. Alternativement, l’élimination de l’eau libre entraînera une réduction relativement faible des volumes plasmatiques et interstitiels, donc cela entraînera une décongestion clinique beaucoup moins importante.
En bref, l’utilisation du changement de poids total comme critère d’évaluation primaire permettra au tolvaptan de paraître plus facilement bon. Les vaptans sont excellents pour provoquer une perte d’eau, ils peuvent donc réussir à induire une forte réduction de volume due à l’excrétion d’eau libre. Cependant, il y a deux problèmes cliniques majeurs avec ceci :
- L’élimination d’eau libre peut entraîner une moindre décongestion (comme expliqué ci-dessus).
- Dès que le traitement par vaptan est interrompu, il peut y avoir une rétention d’eau, qui effacera toute perte de volume due à l’élimination de l’eau libre (plus de détails à ce sujet ci-dessous).
perte d’eau non contrôlée due au tolvaptan

Regardons de plus près la partie droite de ce panneau, qui montre le débit urinaire cumulé sur 48 heures. Il y a une énorme variation dans le débit urinaire parmi les patients traités par les vaptans (avec un écart inter-quartile s’étendant de 8 litres à 15 litres).
Bien sûr, c’est ce à quoi on s’attend avec un traitement par vaptans. Les vaptans induisent un état de diabète insipide néphrogénique, entraînant une perte d’eau incontrôlée. Les résultats sont imprévisibles. Certains patients ont perdu des quantités modérées d’eau, mais d’autres ont perdu près d’un tiers de leur eau corporelle totale.
Les déplacements massifs d’eau ne sont pas sans danger. Si l’on n’y prête pas attention, cela peut provoquer une hypernatrémie et potentiellement même une démyélinisation cérébrale. Dans cette étude, il semble que les cliniciens traitants aient redonné la plupart de l’eau perdue (de sorte que le changement net de liquide dans le groupe vaptan était de ~5 litres). Ou peut-être que les patients ont eu une soif insensée et ont triché sur leur restriction de liquide en buvant de l’eau subrepticement. Alors ces patients s’en sont bien sortis. Mais dans une situation où l’eau gratuite n’était pas rendue aux patients, perdre soudainement 15 litres d’eau ne serait pas génial.
Points finaux secondaires cliniques
Les points finaux secondaires étaient généralement similaires entre la métolazone orale et le chlorothiazide intraveineux (tableau ci-dessous). Le chlorothiazide intraveineux aurait pu être un peu plus puissant, avec une plus grande atteinte de la décongestion et des taux plus élevés d’hyponatrémie. Cependant, dans l’ensemble, les résultats des groupes thétolazone et chlorothiazide étaient très similaires.

Les patients ont eu besoin de suppléments de potassium et de magnésium, mais ces besoins n’étaient pas très élevés. En moyenne, la supplémentation cumulée était de ~80 mEq de potassium et de ~1 gramme de magnésium. Ces chiffres sont quelque peu rassurants, car ils indiquent qu’un blocage néphronique combiné à un diurétique de l’anse et à un thiazide peut être utilisé sans provoquer d’énormes pertes d’électrolytes. Cependant, 45% des patients étaient sous inhibiteur d’aldostérone, ce qui a probablement minimisé ces pertes.
Passons maintenant en revue les différences entre les thiazides et le tolvaptan. Tout d’abord, rappelez-vous les différents effets physiologiques de ces médicaments :
- Le tolvaptan provoque une excrétion d’eau libre, qui élimine le volume principalement du volume intracellulaire.
- Les diurétiques thiazidiques favorisent la perte de NaCl et d’eau, ce qui élimine le volume principalement de l’espace extracellulaire.
Ceci explique parfaitement les différences observées :
- Leolvaptan augmente le sodium sérique en raison de la perte d’eau libre. Les thiazidiques ne le font pas.
- Les thiazidiques provoquent une alcalose de contraction plus importante (due à la perte préférentielle de NaCl).
- Les thiazidiques entraînent une augmentation plus importante de la créatinine et de l’azote uréique sanguin, avec une réduction plus importante du débit de filtration glomérulaire (car ils diminuent davantage le volume intravasculaire).
A première vue, il pourrait sembler qu’une augmentation de la créatinine et de l’azote uréique sanguin dans le groupe thiazidique soit une mauvaise chose (ils font du mal aux reins !). Cependant, cela pourrait simplement être un signal que les thiazidiques provoquent une décongestion vasculaire plus efficace. Certaines études ont trouvé que l’augmentation de la créatinine est corrélée à une amélioration des résultats, peut-être parce que cela reflète une diurèse efficace.2

Il y a une autre information clé qui se cache ici. Après l’arrêt du tolvaptan, le sodium sérique chute brusquement en dessous de la ligne de base (flèche aqua ci-dessus). Dans l’insuffisance cardiaque, cela ne peut signifier qu’une seule chose – après l’arrêt du tolvaptan, les patients ont avidement retenu l’eau libre (reprenant rapidement tout le poids perdu suite à l’utilisation du tolvaptan). Malheureusement, l’étude n’a pas rapporté la perte de poids au moment de la sortie de l’hôpital (ma supposition est que ceux-ci seraient supérieurs pour les thiazides que pour le tolvaptan).
points finaux de sécurité

Les taux d’événements indésirables globaux étaient similaires. Deux patients du groupe tolvaptan ont connu une augmentation du sodium d’au moins 12 mM sur 24 heures, entraînant un risque potentiel de démyélinisation osmotique. Ce chiffre peut toutefois être artificiellement bas,car la plupart des études actuelles utilisent >10 mM ou même >8 mM comme seuil du risque de démyélinisation osmotique.
limites de l’étude

Cette étude n’était pas techniquement alimentée pour une analyse de non-infériorité (elle a été conçue comme un essai de supériorité). Les marges d’erreur sont larges, ce qui aurait pu faire manquer à l’étude de petites différences entre les diurétiques. Cependant, il est douteux que l’étude ait manqué des différences cliniquement pertinentes.
Environ la moitié des patients de l’étude étaient sous un antagoniste des récepteurs minéralocorticoïdes (par exemple, la spironolactone). Il n’est pas clair dans quelle mesure cela peut avoir affecté les résultats.
conclusions sur le tolvaptan comme diurétique
Les tolvaptans sont des médicaments en quête d’une indication. Ils sont extrêmement coûteux, ce qui conduit à un soutien vigoureux de l’industrie (y compris le financement de cet essai). Ils ont fait l’objet d’une promotion agressive pour leur utilisation dans l’hyponatrémie, mais ils ne fonctionnent vraiment pas bien pour cela (certainement pas dans les soins intensifs). Peut-être qu’ils pourraient mieux fonctionner dans l’insuffisance cardiaque ?
Cette étude redémontre la physiologie des vaptans : ils induisent une perte agressive et souvent incontrôlée d’eau libre. Cette action n’est probablement pas bénéfique dans l’insuffisance cardiaque, pour trois raisons :
- L’excrétion incontrôlée d’eau peut provoquer une élévation rapide du taux de sodium sérique, créant un risque de démyélinisation osmotique.
- L’élimination de l’eau libre provoque principalement une déshydratation intracellulaire, plutôt qu’une décongestion extracellulaire.
- Dès l’arrêt du traitement par vaptan, les patients vont rapidement retenir l’eau et regagner le volume perdu.
réflexions partielles sur la métolazone vs le chlorothiazide
Le chlorothiazide est plus cher que la métolazone et il est administré par voie intraveineuse, donc le chlorothiazide semble être une intervention plus dramatique. Cela conduit souvent à l’hypothèse que le chlorothiazide doit être supérieur.
Bien sûr, ce n’est pas nécessairement vrai. La métolazone a un as dans sa propre manche – une demi-vie plus longue (~14 heures, par rapport aux maigres 2 heures du chlorothiazide). La métolazone est la glargine des diurétiques : elle reste discrètement sur place et combat la rétention de sodium après le départ de tous les autres diurétiques. La longue demi-vie de la métolazone pourrait être particulièrement utile chez les patients traités par des bolus intermittents de furosémide. Par exemple :
- Un régime de bolus IV de furosémide plus chlorothiazide IV ensemble Q12hr pourrait exposer les patients à plusieurs heures sans aucun diurétique à bord.
- Un régime de bolus de furosémide IV plus métolazone orale Q12hr n’exposerait les patients à aucune période sans diurétique.
En définitive, le chlorothiazide IV et la métolazone orale sont tous deux des diurétiques formidables, mais ils peuvent être mieux adaptés à des fins différentes. Le chlorothiazide IV est excellent dans les situations d’urgence où une action immédiate est nécessaire (par exemple, une hyperkaliémie émergente, dans le cadre de la bombe néphronique). La métolazone est peut-être plus adaptée à la réanimation, si votre objectif est d’éliminer en douceur plusieurs litres de liquide sur une période de 24 heures. La bonne nouvelle de cette étude est que les deux semblent être sûrs et efficaces.

- Les diurétiques thiazidiques sont efficaces pour soulager la résistance aux diurétiques de l’anse. Ceci conforte la place traditionnelle des thiazidiques comme agents de seconde ligne pour les patients réfractaires aux diurétiques de l’anse.
- La métolazone par voie orale semble être aussi efficace que le chlorothiazide par voie intraveineuse. En pratique, la métolazone peut avoir un avantage en raison de son coût réduit et de sa demi-vie plus longue.
- Une diurèse combinée agressive avec un thiazide plus un diurétique de l’anse a été bien tolérée (sans modifications durables de la fonction rénale ou de modifications majeures des électrolytes). Une supplémentation en potassium et magnésium a été nécessaire, mais pas en quantités énormes.
- Le Tolvaptan entraîne effectivement l’excrétion de grands volumes d’eau. En se basant étroitement sur cette seule métrique, le tolvaptan pourrait être considéré comme un succès. Cependant, le tolvaptan ne semble pas prêt pour une utilisation clinique de routine pour plusieurs raisons (par exemple, l’élimination non contrôlée de l’eau et la rétention d’eau de rebond rapide après l’arrêt du traitement).
-
Cox ZL, Hung R, Lenihan DJ, Testani JM. Stratégies diurétiques pour la résistance aux diurétiques de l’anse dans l’insuffisance cardiaque aiguë. JACC : Heart Failure. Décembre 2019. doi:10.1016/j.jchf.2019.09.012
-
Griffin M, Rao VS, Fleming J, et al. Effet sur la survie de l’hémoconcentration et de l’augmentation de la créatinine concomitantes pendant le traitement de l’insuffisance cardiaque aiguë décompensée. The American Journal of Cardiology. Décembre 2019:1707-1711. doi:10.1016/j.amjcard.2019..08.034
- Auteur
- Postes récents
- PulmCrit Wee – MENDS2 :Fentanyl ou fentanyl pour la sédation chez les adultes sous ventilation mécanique atteints de sepsis – 2 février 2021
- PulmCrit Wee – Une étude de suivi sur le Bamlanivimab démasque une chicanerie statistique – 26 janvier 2021
- IBCC – Chapitre COVID remanié axé sur la gestion de l’étape de l’USI & – 25 janvier 2021
.