Types d’amiante, propriétés et utilisations
L’amiante est divisé en 2 grands sous-groupes : les amphiboles et les serpentines, chacun ayant ses caractéristiques physiques et chimiques distinctes. Les fibres de serpentine sont caractérisées par leur forme incurvée au microscope électronique, et le chrysotile ou amiante blanc est le seul membre de ce sous-groupe. Les autres formes sont des amphiboles, qui sont composées de fibres rigides droites de longueur variable, généralement inférieure à 5μm.1
L’amiante se caractérise par sa résistance aux températures élevées et aux produits chimiques, ainsi que par sa grande résistance à la traction. Il est utilisé dans plus de 3000 applications différentes dans de nombreux secteurs industriels, et même dans d’autres produits largement distribués comme les jouets, les grille-pain, les séchoirs, les articles pour fumeurs, etc. L’amiante se présente sous différentes formes : a) en vrac, b) en feuilles ou en plaques, c) en fils ou en tissus, d) en fibres de ciment, et e) en tant que composant du mortier. Ces formes très variées rendent souvent difficile l’identification de l’amiante comme matériau utilisé par les travailleurs lors de l’enregistrement de leur historique d’emploi. En 2002, la directive communautaire 1999/77 est entrée en vigueur, interdisant l’utilisation de tous les types d’amiante dans l’Union européenne.2 Aujourd’hui, l’exposition professionnelle à l’amiante continue de représenter un risque pour les travailleurs impliqués dans la démolition, l’entretien, la réparation et le transport de structures dans lesquelles l’amiante était précédemment utilisé. En Espagne, le décret royal (RD) 396/20063 fixe toutes les dispositions nécessaires à la prise en charge de la santé de ces travailleurs.
Les maladies malignes et non malignes liées à l’amiante et leur pathogénie (dans ces recommandations, nous utiliserons le mot bénin au lieu de non-malin) sont listées dans le matériel supplémentaire, disponible en ligne.
Tests diagnostiques pour l’évaluation des maladies liées à l’amianteAnalyse de l’emploi
Un historique complet de l’emploi doit être recueilli (recommandation cohérente, qualité de preuve élevée). Le patient doit être interrogé sur son emploi, sa catégorie professionnelle, son degré de protection, son degré d’exposition et les visites médicales d’entreprise au cours de sa vie professionnelle.
En cas d’exposition connue à l’amiante, les données suivantes seront également recueillies :
- –
année de première exposition, durée et fin de l’exposition
- –
Type d’exposition : professionnelle, par le travail direct avec l’amiante ; domestique, par l’isolation des bâtiments ou d’autres contaminants ou par le lavage des vêtements de travail ; environnementale, par l’utilisation d’amiante dans les espaces publics, la démolition de bâtiments ou la proximité d’usines polluantes.
- –
Intensité. Une exposition intense est considérée comme un contact direct pendant plus de 6 mois (8h par jour, 40h par semaine) ou une forte concentration de fibres d’amiante dans l’air respiré (Arrêté ministériel 31 octobre 1984. Bulletin d’Etat (BOE) 7 novembre 1984). Le risque d’exposition couvre une zone dans un rayon de 300 à 2200 m autour de la source selon la direction du vent, et l’exposition professionnelle est généralement significative après 6 mois de travail4 (recommandation cohérente, qualité de preuve très faible).
- –
Type d’amiante utilisé. Selon la profession.
- –
Indice de tabagisme concomitant.
Tests d’imagerieRadiographie thoracique standard et tomodensitométrie
La radiographie thoracique (Rx) est l’outil de base pour identifier les maladies liées à l’amiante (recommandation cohérente, qualité de preuve modérée).
La classification Rx thoracique du Bureau international du travail (BIT) est utile pour décrire et enregistrer systématiquement les anomalies radiographiques du thorax observées non seulement dans l’asbestose, mais dans tout type de pneumoconiose. La dernière édition révise également les critères de classification de l’épaississement pleural5. Ces critères sont donc utiles pour décrire les anomalies radiologiques, bien qu’ils ne soient pas une condition préalable au diagnostic.
La tomographie par ordinateur (CT) est un outil diagnostique plus sensible (tableau 1).
Caractéristiques radiologiques des maladies pleuropulmonaires liées à l’amiante.
| Asbestose | Opacités réticulaires irrégulières prédominant dans les bases. Bandes parenchymateuses. Modèle en nid d’abeille |
|---|---|
| Plaques pleurales | Les longues lésions denses ou linéaires dans la plèvre diaphragmatique, respectant les sinus et les sommets phrénicocostaux. Le plus souvent bilatérales. Peut être calcifiée |
| Epaississement pleural diffus | Augmentation de la largeur pleurale s’étendant à au moins un quart de la paroi thoracique. Le plus souvent unilatéral, affectant la plèvre postérieure dans les bases. Peut être calcifiée. Peut être associé à des bandes parenchymateuses et à des atélectasies arrondies |
| Effusion pleurale bénigne | Unilatérale, à prédominance gauche, de quantité faible à modérée. Indiscernable des autres causes d’épanchement d’un point de vue radiologique |
| Atelectasie arrondie | Opacité arrondie de la base pleurale avec courbure des vaisseaux sanguins et des bronches adjacentes (signe de la queue de comète). Unilatérale, prédominant dans les lobes inférieurs |
| Mésothéliome pleural | Épaississement pleural nodulaire diffus touchant la plèvre médiastinale associé à un épanchement pleural et à une perte de volume dans l’hémithorax affecté. hémithorax |
| Cancer du poumon | Indiscernable des autres cas |
Tomographie par émission de positons (TEP) et TEP combinée à la tomodensitométrie (TEP-TDM).CT)
Bénard6 a démontré l’utilité de cette technique pour distinguer les lésions pleurales bénignes du mésothéliome pleural, grâce à sa sensibilité, sa spécificité et sa précision diagnostique élevées, en plus de sa valeur prédictive positive élevée, et surtout, de sa valeur prédictive négative élevée (92 % ; 75% ; 89% ; 94.3 % et 92 %, respectivement). Des études ultérieures ont confirmé ces résultats.7 La TEP double est également utile dans le processus de diagnostic (l’indice SUV augmente dans la phase tardive par rapport à la phase précoce dans les mésothéliomes, et diminue dans les lésions bénignes). Des valeurs similaires sont obtenues avec la TEP-TDM. La valeur du SUV varie selon les différentes études. En cas de forte suspicion clinique de mésothéliome, ou si la TEP ou la TEP-TDM est positive, le diagnostic doit être confirmé par une étude anatomopathologique d’une biopsie de tissu pleural obtenue de préférence par chirurgie (recommandation cohérente, qualité de preuve élevée).
La TEP-TDM est également une technique d’imagerie utile dans la stadification du mésothéliome et dans l’étude des lésions du parenchyme pulmonaire, car, contrairement au cancer du poumon, il n’y a pas de captation du radiotraceur dans les atélectasies arrondies. Un résultat positif nécessite une confirmation histologique.8
Résonance magnétique et autres techniques d’imagerie
Le rôle de l’imagerie par résonance magnétique (IRM) dans les maladies liées à l’amiante est très limité.
Elle peut être utile pour distinguer les tumeurs pleurales malignes des lésions bénignes, en se basant sur les changements morphologiques et l’intensité du signal.9 En cas d’atélectasie arrondie, l’IRM montre la plèvre viscérale se repliant dans la lésion (recommandation cohérente, qualité de preuve modérée).
Elle définit également plus clairement la graisse extrapleurale, et elle est plus précise pour établir l’invasion de la paroi thoracique et du diaphragme dans la stadification du mésothéliome, bien qu’elle ne soit pas utile pour détecter l’invasion sous-diaphragmatique.10
L’échographie pleurale est utile dans l’étude de l’épanchement pleural et des masses périphériques comme outil d’imagerie pour guider les procédures telles que la thoracocentèse, la biopsie pleurale, etc. Aucune étude n’est disponible pour soutenir son utilisation dans d’autres maladies liées à l’amiante (recommandation cohérente, qualité de preuve élevée).
Tests de la fonction pulmonaire
Les tests de la fonction pulmonaire sont obligatoires dans le diagnostic et le suivi des maladies liées à l’amiante. Utilisée dans le cadre de la surveillance sanitaire, elle contribue au diagnostic précoce des personnes exposées, et elle est indispensable pour évaluer la capacité de travail d’un patient (recommandation constante, haute qualité de preuve).
La spirométrie est la procédure initiale ; le volume expiratoire forcé en 1 seconde (VEMS), la capacité vitale forcée (CVF) et le VEMS/CVF peuvent être utilisés pour détecter et quantifier les défauts ventilatoires obstructifs, et alerter sur un défaut restrictif. La mesure des volumes pulmonaires est obligatoire pour diagnostiquer un défaut ventilatoire restrictif. La mesure de la capacité de diffusion (DLCO) est un test sensible, mais il manque de spécificité dans la détection des pneumopathies interstitielles et son coefficient de variation est plus élevé que celui de la spirométrie.11 Dans l’asbestose, le changement fonctionnel caractéristique est un schéma ventilatoire restrictif (capacité pulmonaire totale réduite), et la DLCO est généralement réduite, les deux étant le résultat de la fibrose du parenchyme pulmonaire. Une capacité de diffusion réduite est l’un des tests les plus sensibles pour détecter une asbestose à un stade précoce, bien que la spécificité soit faible. Un épaississement diffus de la plèvre viscérale sans atteinte interstitielle peut également être à l’origine d’un défaut ventilatoire restrictif.12 Après de nombreux débats, les plaques pleurales n’ont pas été considérées comme responsables des modifications de la fonction pulmonaire qui, lorsqu’elles surviennent, sont dues à d’autres causes concomitantes, comme l’apparition d’une atteinte interstitielle ou le tabagisme13.
Analyse minéralogique
L’amiante peut être détecté dans les échantillons respiratoires en microscopie optique, sous la forme de corps d’amiante (AB), également appelés corps ferrugineux, formés après l’enrobage des fibres par un matériau protéique au sein des macrophages. L’observation des AB dans des échantillons pathologiques standard à l’aide de la coloration histologique de routine (hématoxyline-éosine) est très spécifique, mais la sensibilité est très faible. Pour cette raison, un traitement spécifique des échantillons est nécessaire pour l’évaluation de la teneur pulmonaire en amiante par la numération des AB dans le tissu pulmonaire ou le lavage broncho-alvéolaire14 (recommandation cohérente, qualité de preuve élevée). Des échantillons de tissu pulmonaire pesant au moins 0,5 g sont nécessaires, et ceux-ci sont digérés dans de l’hypochlorite de sodium, filtrés et lavés. La quantification de l’AB est effectuée à l’aide d’un microscope optique 400×. La taille des échantillons requis signifie qu’ils sont généralement obtenus à partir de lobectomies, de pneumonectomies ou d’échantillons d’autopsie. Des valeurs dans une biopsie pulmonaire ou un lavage broncho-alvéolaire supérieures à 1000AB/g de tissu pulmonaire sec ou à 1 AB par millilitre de lavage broncho-alvéolaire indiquent une exposition. Un microscope électronique est nécessaire pour la détection des fibres d’amiante. Si l’objectif est d’identifier la composition chimique de la fibre afin de déterminer son type, diverses méthodes d’analyse d’échantillons sont disponibles, notamment la spectroscopie à rayons X à dispersion d’énergie. Un laboratoire bien équipé et un personnel formé sont nécessaires pour ces procédures, et chaque laboratoire doit établir des valeurs de référence en fonction de la population locale. La première étape requise pour la validation du laboratoire dans cette technique est la normalisation, car des différences notables ont été constatées entre les groupes de différents pays. En Espagne, les valeurs de référence pour l’AB pulmonaire dans la population non exposée ont récemment été publiées.15 Selon les valeurs obtenues, il a été confirmé que le seuil international de 1000 AB est approprié dans notre contexte pour classer les valeurs potentiellement pathogènes.
Biomarqueurs
Plusieurs marqueurs sanguins et du liquide pleural du mésothéliome pleural malin ont été étudiés, comme l’acide hyaluronique, l’antigène carcinoembryonnaire ou le CA 125, mais aucun ne s’est avéré utile. L’ostéopontine est produite par le mésothéliome pleural malin, et les niveaux dans le sérum sont directement associés aux années d’exposition et à l’intensité des lésions. Le manque de spécificité limite l’utilité diagnostique de ce marqueur.
L’inconvénient de la mésothéline soluble est qu’elle n’est pas exprimée dans le sous-type sarcomateux. Les niveaux dans le sérum et dans le liquide pleural sont en corrélation très étroite. Une récente méta-analyse étudiant l’efficacité de la mésothéline soluble dans le diagnostic du mésothéliome pleural malin a conclu que pour un seuil de 2ng/ml dans le plasma, l’aire sous la courbe est de 0,77 (IC 95 % : 0,73-0,81) avec une spécificité de 95 %, mais une sensibilité très faible de 32 %.16 Étant donné la spécificité élevée de ce marqueur, les valeurs positives dans les populations à risque nécessitent un examen plus approfondi du patient. Cependant, sa faible spécificité signifie qu’un résultat négatif n’exclut pas le diagnostic. Ainsi, la détermination systématique de la mésothéline soluble dans la population exposée n’est pas recommandée comme méthode de diagnostic précoce (recommandation cohérente, qualité de preuve élevée).
La fibuline-3, un nouveau biomarqueur décrit dans les cellules de gliome, est impliquée dans l’invasion et la croissance tumorale. Des études sur le mésothéliome pleural malin ont montré que les taux de fibuline-3 dans le plasma ont une sensibilité de 96% et une spécificité de 95%, et lorsqu’elle est retrouvée dans le liquide pleural, la sensibilité est de 84% et la spécificité de 93%. Contrairement à la mésothéline soluble, il n’y a pas de corrélation entre les niveaux dans le sérum et les niveaux dans le liquide pleural. Les niveaux de fibuline-3 dans le plasma peuvent aider à distinguer les personnes exposées à l’amiante des patients atteints de mésothéliome pleural malin, et dans ce dernier groupe, les niveaux sont associés au pronostic. Cependant, il a été démontré que la mésothéline soluble était supérieure à la fibuline-3 en tant que marqueur diagnostique.17 Malgré sa faible sensibilité, qui la rend moins utile en tant que méthode de dépistage de la population exposée, la mésothéline soluble reste le biomarqueur le plus efficace pour diagnostiquer le mésothéliome (recommandation cohérente, faible qualité de preuve).
Législation et protocole spécifique de surveillance sanitaire de l’amiante
Le cadre juridique actuel repose sur le RD 1299/2006 (matériel supplémentaire, disponible en ligne, annexe I). La classification des maladies professionnelles a été mise à jour dans ce RD, et une liste des activités susceptibles de provoquer une maladie professionnelle a été fournie. Les maladies liées à l’amiante sont énumérées à l’annexe II (matériel supplémentaire, disponible en ligne), récemment élargie pour inclure le cancer du larynx.18 Six groupes de maladies professionnelles sont spécifiés. L’exposition à l’amiante apparaît dans le groupe 4 (maladies non tumorales) et dans le groupe 6 (maladies tumorales).
En outre, la loi rend obligatoire pour tout médecin du système national de santé de déclarer toute maladie causée par une exposition professionnelle à l’une de ces substances comme une maladie professionnelle présumée. Un formulaire de déclaration standard est disponible à cet effet, qui est évalué par l’organisme gestionnaire, généralement l’Institut national de sécurité sociale espagnol, et accepté ou rejeté. Cette déclaration est importante pour les litiges ultérieurs et détermine le délai de prescription, généralement un an après le rejet.
La loi exige également que les entreprises fournissent des informations, ce qui a conduit chaque communauté autonome à établir des listes d’entreprises dans lesquelles l’amiante a été utilisé.
Depuis que ce RD a été promulgué, seul 1 règlement associé à cette question est apparu : RD 843/2011, réglementant les services de prévention des risques sur le lieu de travail.
Dans ce cadre, les communautés autonomes ont mis en place des programmes de prévention des risques sur le lieu de travail et d’assistance aux personnes exposées.
Application du protocole de surveillance sanitaire spécifique : Première visite et intervalles de visite. Recommandations du groupe EROM
L’article 16 du RD 396/2006, du 31 mars 2006, fixant les dispositions minimales de santé et de sécurité applicables aux emplois présentant un risque d’exposition à l’amiante, stipule que » compte tenu de la longue période de latence des manifestations pathologiques de l’exposition à l’amiante, tout travailleur ayant des antécédents d’exposition à l’amiante qui cesse sa relation de travail avec l’entreprise dans laquelle la situation d’exposition s’est produite, que ce soit en raison d’un départ à la retraite, d’un changement d’entreprise ou pour toute autre raison, continuera à bénéficier d’un contrôle médical préventif, par le biais d’examens réguliers effectués par le système national de santé dans les services de médecine respiratoire dotés des moyens appropriés pour l’examen de la fonction respiratoire, ou dans d’autres services associés aux maladies liées à l’amiante ».
En Espagne, comme dans d’autres pays, un programme de dépistage et de surveillance est disponible pour les travailleurs exposés à l’amiante. Il s’agit de programmes médico-légaux qui sont très importants pour l’identification et le diagnostic des différentes maladies, mais il existe peu de preuves scientifiques qu’il s’agit d’une stratégie efficace pour améliorer l’évolution de ces maladies.
De ce fait, le groupe SEPAR EROM recommande que les tests effectués lors de la première visite et des visites successives ainsi que les intervalles entre les visites soient les suivants :
1) Première visite d’un patient consultant avec une histoire d’exposition possible à l’amiante :
- –
Analyse de l’emploi : comme indiqué ci-dessus.
- –
Analyse du tabagisme : si fumeur actif, conseil ou traitement anti-tabac (recommandation cohérente, qualité de preuve élevée).
- –
Analyse médicale et anamnèse : le patient sera interrogé en particulier sur les symptômes respiratoires (dyspnée, toux et expectoration, douleurs thoraciques, hémoptysie) et sur l’asthénie, l’anorexie et la perte de poids.
- –
Examen physique : évaluer la présence de crépitants et d’ongles cagneux.
- –
Examens complémentaires :
- –
Rx thorax.
- –
Examen complet de la fonction respiratoire avec spirométrie forcée, volumes pulmonaires et DLCO dans un laboratoire équipé pour les tests fonctionnels, en suivant les recommandations de la SEPAR.
Si la probabilité d’exposition est nulle ou peu claire d’après l’historique professionnel du patient (son emploi ne figure pas sur la liste des activités à risque d’exposition à l’amiante http://www.msssi.gob.es/ciudadanos/saludAmbLaboral/docs/ProtoVigiAmianto1.pdf) et que les résultats des tests sont normaux, le suivi s’arrête à ce stade.
Un HRCT doit être réalisé si des changements sont observés sur la Rx thoracique, si les tests de la fonction pulmonaire sont anormaux ou si une discordance clinique/fonctionnelle est observée (recommandations cohérentes, faible qualité de preuve).
S’il est vrai que la TDM est plus sensible que la Rx thoracique pour le diagnostic des plaques pleurales non calcifiées, son utilisation pour le diagnostic chez un patient ayant une Rx thoracique normale, des tests fonctionnels normaux et aucun symptôme est discutable et non soutenue par des preuves scientifiques (le rapport risque-bénéfice dû aux radiations doit également être pris en compte).
Un autre problème est l’utilisation de la TDM comme outil de dépistage du cancer du poumon aux stades précoces de la maladie. À cet égard, une méta-analyse récemment publiée dans Chest19 portant sur plus de 5 000 travailleurs au total a révélé une prévalence du cancer du poumon chez les personnes exposées à l’amiante de 1,1 %, similaire à celle rapportée dans l’étude sur le dépistage du cancer du poumon chez les gros fumeurs (1 % : IC 95 % : 0,09-1,1 %).20 Pour cette raison, l’étude conclut que le dépistage par tomodensitométrie chez les travailleurs exposés à l’amiante peut être efficace pour détecter le cancer du poumon asymptomatique à un stade précoce, de sorte qu’il peut réduire la mortalité par cancer du poumon dans ce groupe de travailleurs.
Le dépistage du cancer du poumon chez les travailleurs exposés à l’amiante est une question urgente qui nécessite un vaste essai randomisé pour établir des recommandations cohérentes basées sur des preuves scientifiques de haute qualité.
2) Des visites régulières auront lieu aux intervalles établis, en fonction des résultats du diagnostic, et à condition que le patient soit asymptomatique et ne présente pas de changements dans ses symptômes (recommandation cohérente, faible qualité de preuve) :
- –
Pas de maladie : contrôle avec spirométrie forcée et Rx thoracique tous les 3 ans.
- –
Maladie avec plaques pleurales : contrôle tous les 1-3 ans avec Rx thoracique et spirométrie forcée. En cas de pathologie, compléter l’étude par une étude fonctionnelle pulmonaire complète incluant volumes et DLCO.
- –
Maladie pleurale avec épaississement pleural diffus : contrôle annuel avec Rx thoracique et étude fonctionnelle complète avec volumes et DLCO.
- –
Maladie pleurale due à l’amiante avec atélectasie arrondie : si des signes radiologiques typiques sont observés, surveiller la stabilité dans le temps par des techniques d’imagerie, de préférence le scanner tous les 6 mois pendant 2 ans. Suivi ultérieur similaire à celui de l’épaississement pleural diffus (recommandation cohérente, faible qualité de preuve). En l’absence de signes radiologiques typiques ou si des symptômes sont observés, envisager d’autres techniques (TEP, TEP-TDM, FNAB guidée par scanner) pour exclure une malignité (recommandation cohérente, qualité de preuve élevée).
- –
Asbestose : contrôle annuel avec Rx thoracique et étude fonctionnelle complète. En cas de détérioration des tests de la fonction pulmonaire ou de changements radiologiques sur la Rx thoracique, envisager de répéter le CT à haute résolution.
- –
Traitement antitabac si le patient continue à fumer.
Des changements dans les symptômes, dans les tests de la fonction pulmonaire ou dans les études radiologiques peuvent nécessiter une répétition du CT.
Ni la détermination des biomarqueurs ni les CT réguliers ne sont actuellement indiqués pour la détection précoce du mésothéliome (Fig. 1).
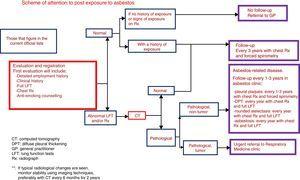
Calendrier de visite des patients précédemment exposés à l’amiante.
Critères d’attribution des maladies à l’amiante
L’attribution d’une maladie à l’amiante a une portée diagnostique qui influencera la surveillance ultérieure et peut également avoir des implications juridiques et économiques, puisque le mésothéliome, l’asbestose, le cancer du poumon et la fibrose pleurale associée à une restriction ventilatoire sont reconnus comme des maladies professionnelles. Le fait que l’amiante puisse causer toute une série de maladies respiratoires ne facilite pas l’attribution dans chaque cas spécifique. En effet, les données épidémiologiques et expérimentales disponibles montrent que l’exposition doit répondre à certains critères en termes d’intensité et de durée pour être considérée comme un facteur causal d’une maladie spécifique.
Comme pour les autres maladies causées par l’inhalation de substances, le diagnostic des processus causés par l’amiante nécessite une exposition, un tableau clinique et radiologique cohérent et l’exclusion de toute autre cause raisonnable. Ainsi, le diagnostic de mésothéliome implique généralement une attribution à l’amiante, puisqu’aucun autre agent causant clairement la maladie n’a été identifié, et les maladies pleurales bénignes présentent des signes radiologiques qui peuvent les rendre plus faciles à reconnaître.
En règle générale, les caractéristiques de l’exposition doivent être évaluées. Il est peu probable que l’asbestose se développe avec des expositions cumulées inférieures à 25 fibres/ml/an,21 et l’augmentation de l’incidence du cancer du poumon se produit également après des expositions intenses pendant une période de plus de 20 ans. En revanche, les maladies pleurales bénignes peuvent apparaître après 10 ans à partir de la première exposition, et l’exposition peut être d’intensité légère.
En pratique, le patient n’est généralement pas conscient de la concentration de fibres présentes dans son environnement de travail, et il peut être difficile pour le médecin d’évaluer l’intensité de l’exposition à partir des informations obtenues par l’historique professionnel. En effet, même avec l’utilisation d’un questionnaire complet, la sensibilité et la spécificité pour détecter l’exposition ne sont que de 50% et 75%, respectivement, par rapport au nombre d’AB détectés dans le tissu pulmonaire (données personnelles non publiées). En cas d’exposition domestique ou environnementale, il est plus difficile d’établir la relation de cause à effet.
Chez les patients ayant des antécédents connus d’exposition, les maladies associées peuvent être attribuées à cette exposition sans autre considération (recommandation cohérente, qualité de preuve modérée).
Si toutefois des discordances sont détectées entre le tableau clinique ou les examens d’imagerie et la notion d’exposition, il est utile de disposer de preuves objectives de l’exposition. L’étalon-or est la détection d’amiante dans le poumon, déterminée par la recherche d’AB (les dépôts dans la plèvre sont généralement peu nombreux). Les valeurs indicatives de dépôts pulmonaires susceptibles de provoquer une maladie sont 103AB/g dans le poumon sec ou plus de 106fibres/g, selon les données du seul laboratoire espagnol qui dispose de valeurs de référence15. Cette technique peut également être réalisée en lavage broncho-alvéolaire, avec des valeurs seuils de 1AB/ml.
L’apparition de nouvelles fibres ayant remplacé l’amiante et leur impact possible sur la santé sont examinés dans des documents complémentaires, disponibles en ligne.
Conflit d’intérêts
Les auteurs déclarent ne pas avoir de conflit d’intérêts.