Introduction
La forme physiologique de la paroi thoracique est fondamentale pour une dynamique respiratoire correcte et pour protéger les organes contenus dans le thorax (1) ; par conséquent, la reconstruction de la paroi thoracique est d’une importance capitale et peut être une procédure difficile dans le domaine de la chirurgie thoracique.
La maladie de la paroi thoracique peut impliquer une zone d’excision étendue et, par conséquent, sa reconstruction varie. La nécrose radiologique, la maladie infectieuse locale ou la maladie récurrente du cancer du sein entraînent une destruction importante des os, des muscles, des tissus mous et de la peau. La fourniture de tous les composants est obligatoire pour une excellente reconstruction (2).
Les défauts importants de la paroi thoracique antérolatérale et du sternum justifient une approche chirurgicale modulée visant une reconstruction squelettique stable. Le principal souci d’une procédure chirurgicale correcte est de préserver les structures sous-jacentes, d’éviter la respiration paradoxale et le flail chest, et, last but not least, d’offrir de bons résultats fonctionnels et cosmétiques (2). La stabilité squelettique peut être obtenue, à moins qu’il ne s’agisse de tissu autogène ou de matériel synthétique.
À l’époque pionnière de la chirurgie de la paroi thoracique, la résection de la zone affectée de la paroi thoracique était limitée par la disponibilité de matériaux appropriés. La décision concernant la façon de reconstruire le défaut était compromise par l’utilisation de prothèses qui ne garantissaient pas une chirurgie durable et fonctionnelle.
Grâce à l’introduction, au cours des deux dernières décennies, de différents matériaux synthétiques ou biologiques ont amélioré les techniques chirurgicales et permettent une large résection et reconstruction de la paroi thoracique avec une morbidité et une mortalité adéquates (1).
Méthodes
De janvier 2017 à octobre 2019, quatre patients atteints de maladies thoraciques antérieures ont subi un traitement chirurgical :
- Deux jeunes patients, l’un avec une fracture traumatique déplacée du sternum et l’autre avec un pectus carinatum-excavatum, traités par une résection et une reconstruction de la paroi thoracique antérieure avec une broche absorbable et une application de plaques de titane ;
- Deux patients adultes avec un cancer du sein antérieur.
Cas 1
Le sein pigeon est un type peu commun d’anomalie de la paroi thoracique antérieure (3,4). Nous présentons ici un cas dans lequel un défaut sévère de la paroi thoracique en forme de pigeon a été favorablement corrigé par plusieurs chordotomies, une triple ostéotomie sternale de résection, et stabilisé par une infibulation de l’os spongieux en utilisant Grand-Fix résorbable et avec des barres de titane sur la surface corticale du sternum et des côtes.
Un homme de 20 ans a présenté un sein de pigeon obstiné. Une incision transversale en mini-coquille a été réalisée dans le 5e espace intercostal en suivant les lignes de Langer. En décollant la peau et le tissu sous-cutané, les muscles grands pectoraux ont été divisés bilatéralement sur leurs attaches sternales et rétractés afin d’obtenir un bon aspect des déformations de la paroi thoracique.
Le sternum a été libéré sur toute sa longueur bilatéralement par des résections sous-périchondriales du deuxième au sixième cartilage costal déformé. Trois ostéotomies ont été réalisées sur la surface du sternum :
- Calage antérieur de la partie cortico-spongieuse de l’angle courbe du sternum déformé ;
- Incision de la partie supérieure du manubrium au-dessus de l’angle de Louis ;
- Incision de la partie inférieure du corps du sternum.
Les deuxième et troisième ostéotomies ont ensuite été rapprochées et fixées avec deux broches en Poly-L-Lactide (PLLA) bioabsorbables (Grand-fix, Gunze Co, Ayabe, Japon) (5).
Les cartilages apaisés ont été nouvellement rapprochés du sternum en les suturant avec du polydioxanone N. 2 (Ethicon Inc, Johnson & Johnson International, Bruxelles, Belgique, Europe). Enfin, la reconstruction supérieure a été fixée avec la fixation sternale en titane Synthes (système en titane DePuy Synthes®, Monument, CO, États-Unis). Une barre de liaison destinée à stabiliser la jonction sternum-nervure a été moulée manuellement à la courbure de la surface du squelette thoracique et placée entre la deuxième et la troisième ostéotomie (figure 1). Les lambeaux de muscle pectoral ont été rattachés sur la reconstruction sternale.
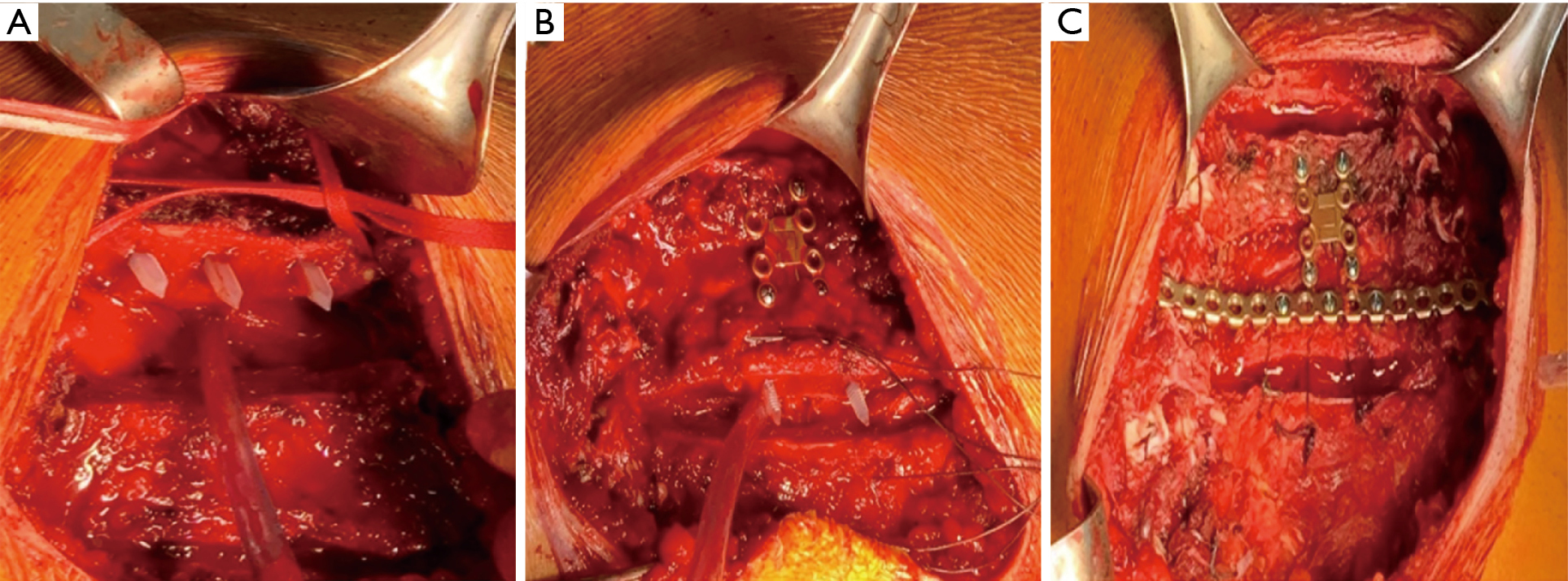
Le patient a été extubé à la fin de la procédure et est sorti le jour 9 postopératoire avec un régime de traitement analgésique oral. Le suivi CT à 4 mois a montré de bons résultats (Figure 2).

Cas 2
La majorité des fractures sternales (>95%) sont traitées de manière conservatrice. Cependant, en cas de fractures instables, d’instabilité de la paroi thoracique, de déformation du sternum, d’insuffisance respiratoire, de douleurs sévères et de fractures non unies en raison du délogement important de l’os avec les tissus mous environnants, une fixation chirurgicale pourrait être réalisée. Plusieurs méthodes de fixation ont été décrites dans la littérature (6-8).
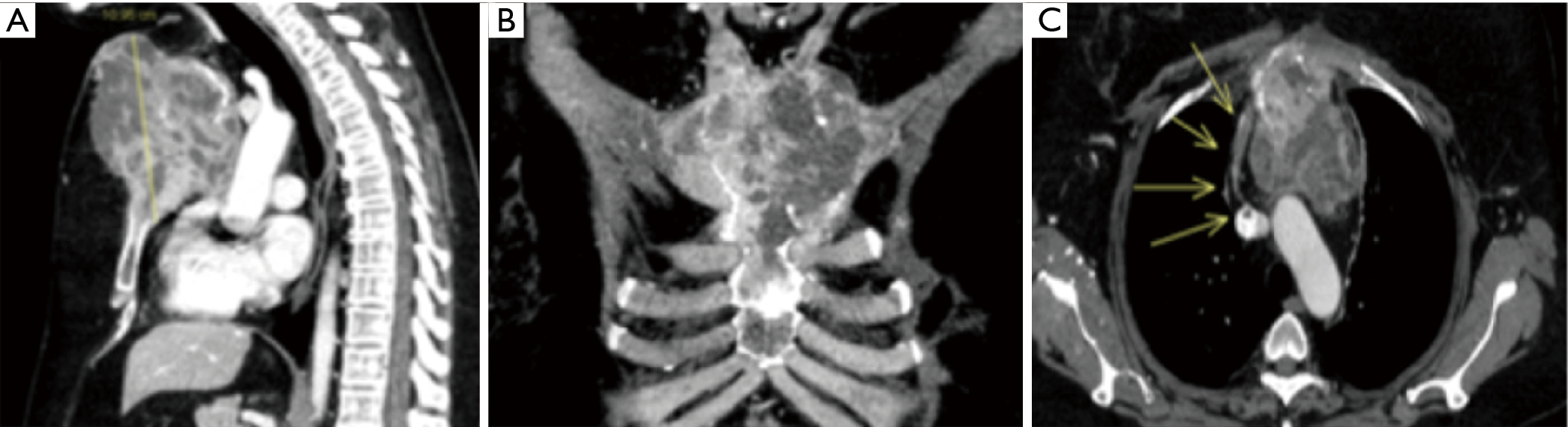
Nous rapportons le cas d’un homme de 15 ans présentant une fracture transversale du manubrium après un traumatisme sportif. Le patient s’est adressé à notre service pour des douleurs persistantes. Avant le traitement chirurgical, une tomodensitométrie reconstruite en trois dimensions a été réalisée pour obtenir des informations détaillées sur la morphologie du délogement sternal (Figure 3).

Une incision en T a permis d’accéder au manubrium et au sternum, a été obtenue par une incision cutanée transverse en collier couplée à une coupe médiane de l’échancrure jugulaire à l’angle de Louis. Les marges du manubrium et le site de la fracture ont été entièrement exposés. Tous les tissus mous coincés ont été retirés de la fracture pour assurer une réduction anatomique. La fixation interne a été réalisée par deux broches en Poly-L-Lactide (PLLA) bioabsorbables (Grand-fix, Gunze Co., Ayabe, Japon) (Figure 4). Deux plaques longitudinales en titane ont ensuite été utilisées pour fixer la fracture transversale. Nous avons décidé d’utiliser des plaques parallèles orientées longitudinalement pour une éventuelle sternotomie future.
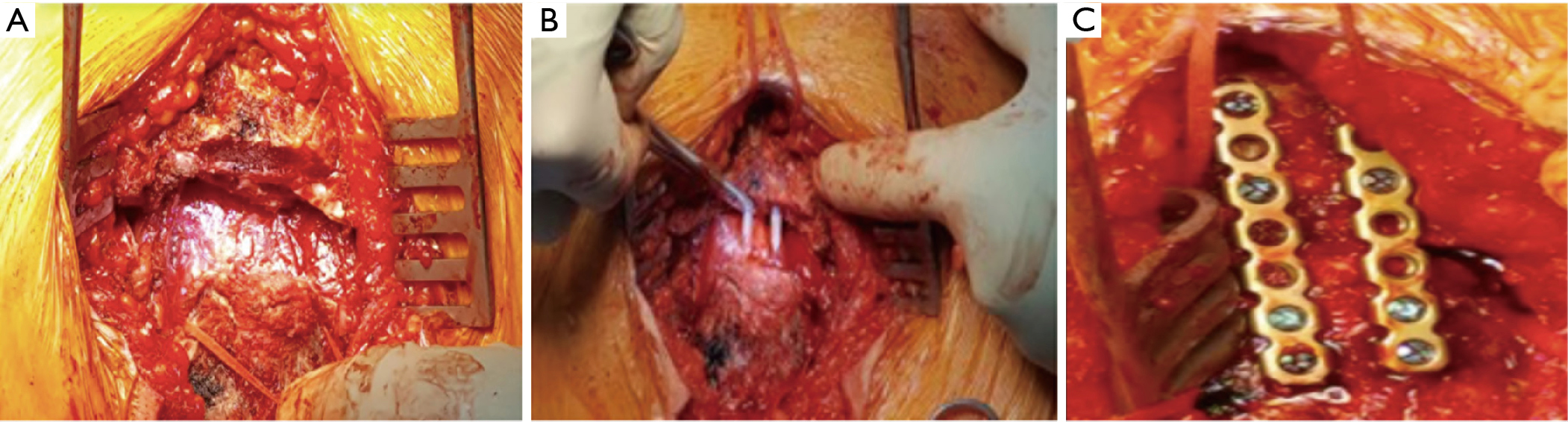
L’évolution postopératoire s’est déroulée sans incident, et le patient est sorti après 4 jours (Figure 5).

Cas 3
Les sarcomes post-radiation sont des complications peu fréquentes de la radiothérapie (RT) qui peuvent survenir après de nombreuses années de latence (9). Bien que la RT adjuvante après la chirurgie du sein joue un rôle central dans le traitement des tumeurs malignes du sein à un stade précoce (10), les sarcomes des tissus mous/musculaires et osseux de la cage thoracique ont été décrits comme une complication limitée de la RT pour les tumeurs du sein (10,11).
Nous présentons le cas d’une femme de 50 ans ayant des antécédents de maladie actuelle de carcinome canalaire invasif (pT2N3M0, stade IIIC, 8e système de classification AJCC), traitée par une mastectomie gauche plus un curage ganglionnaire axillaire et une chimio/radiothérapie adjuvante postopératoire. Onze ans après le traitement initial par RT, la patiente a présenté une douleur sternale, et une procédure de CT scan a été programmée. La tomodensitométrie du thorax avec renforcement par contraste iodé a révélé une tumeur osseuse (Figure 6) du manubrium et du corps supérieur du sternum, là où se trouve habituellement l’angle de Louis. Le néoplasme s’étend aux jonctions 2-4 côtes-costo-cartilagineuses bilatéralement avec une atteinte médiastinale et péricardique. La lésion était hypermétabolique à la tomographie par émission de positons (TEP).
Le traitement a consisté en une ablation partielle du sternum (la partie inférieure de l’os a été préservée). Une résection du tractus cartilagineux costal de la deuxième à la quatrième côte de façon bilatérale a été réalisée. La partie médiane des deux clavicules et le péricarde antérieur ont été retirés. Ainsi, les tissus mous péritumoraux ont été excisés en bloc, et la coupe congelée peropératoire a confirmé des marges négatives.
Le péricarde a été reconstruit avec un patch de polytétrafluoroéthylène (PTFE, GORE-TEX®, Flagstaff, AZ, États-Unis) d’une épaisseur de 0,1 mm. Pour reconstruire la paroi thoracique, nous avons choisi la combinaison d’un maillage durable (synthétique) et d’implants en titane. Un grand morceau de membrane Gore-tex, d’une épaisseur de 2 mm, a d’abord été fixé circonférentiellement aux marges osseuses à l’aide de sutures non résorbables interrompues sous tension maximale. Cette approche permet d’obtenir une barrière souple qui garantit un degré raisonnable de protection des deux poumons et du médiastin contre les tissus superficiels (figure 7). La deuxième étape consistait à rétablir la rigidité de la paroi thoracique à l’aide de plaques en titane. Trois plaques de reconstruction profilées (DePuy Synthes® titanium system, Monument, CO, États-Unis) ont été fixées aux deuxième et quatrième côtes bilatéralement (figure 7A) et à la clavicule avec le système Sternal ZIPFIX® (DePuy Synthes® titanium system, West Chester, PA, États-Unis) (figure 7B). Pour couvrir le défaut antérieur du thorax, nous avons utilisé des lambeaux pectoraux bilatéraux.
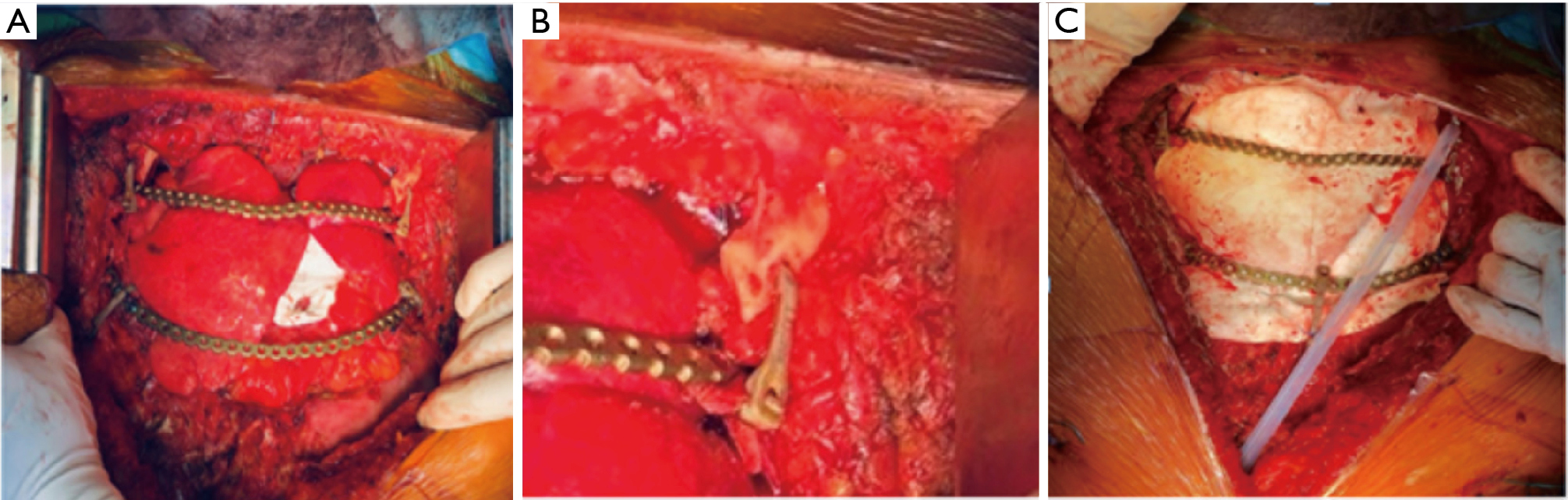
La période postopératoire a été caractérisée par une nécrose cutanée partielle et une infection, avec un pneumothorax droit ultérieur qui a nécessité la mise en place d’un tube de drainage thoracique. Le patient a subi une reprise chirurgicale consistant en un débridement et une fermeture primaire avec un lambeau mio-cutané de latissimus dorsi. La pathologie finale a confirmé la présence d’un ostéosarcome radio-induit. Le suivi, après 2 ans, démontre un excellent résultat cosmétique et l’absence de maladie récurrente.
Cas 4
Une femme de 67 ans, présentant une infection de la paroi thoracique antérieure gauche étendue du plan cutané jusqu’à la cavité pleurale, avec ostéomyélite sternochondrale, s’est présentée à notre Clinique chirurgicale pour une consultation. La patiente avait des antécédents de carcinome mammaire invasif précédemment traité par mastectomie avec dissection ganglionnaire axillaire, suivie d’une chimio et d’une radiothérapie adjuvantes.
Un an après la chirurgie mammaire, la patiente a subi une mastoplastie additive bilatérale, compliquée par une infection. Après environ une semaine, l’implant mammaire gauche a été retiré en raison de l’apparition d’une nécrose cutanée favorisée par Pseudomonas aeruginosa ultrarésistant (XDR). Plusieurs cycles de chimiothérapie ont suivi sans aucun succès.
Nous avons discuté du cas avec les chirurgiens plasticiens et les collègues infectiologues pour anticiper les complications peropératoires potentielles et avons mutuellement élaboré un plan adéquat. Nous avons tous décidé de ne pas implanter de matériaux synthétiques en raison de l’infection sous-jacente et de l’ostéomyélite (12), et nous avons donc considéré à l’unanimité que les auto-greffes étaient le meilleur outil pour la réparation du corps dans son cas.
Des échantillons de tissu de l’ulcère ont été prélevés en peropératoire et envoyés pour une culture bactérienne et un test de sensibilité aux antibiotiques. Les échantillons ont été utilisés pour détecter le meilleur choix d’antibiotiques postopératoires et cesser ou ajouter sur le traitement empirique préopératoire. Après la résection de la fistule de la paroi thoracique et de la peau cicatrisée environnante, ainsi que des tissus nécrotiques de la paroi thoracique, les segments antérieurs des deuxième et troisième côtes et la partie supérieure du sternum ont été réséqués. L’exposition des tissus sains de la paroi thoracique et de la plèvre viscérale (figure 8A) a été réalisée en même temps que le débridement pleural. Finalement, un lambeau pédiculé de muscle transverse de l’abdomen (TRAM) a été prélevé et utilisé pour fixer le défaut de la paroi thoracique (Figure 8B,C). Deux jours plus tard, une nécrose est apparue, nécessitant une réintervention pour changer le lambeau (Figure 8D).
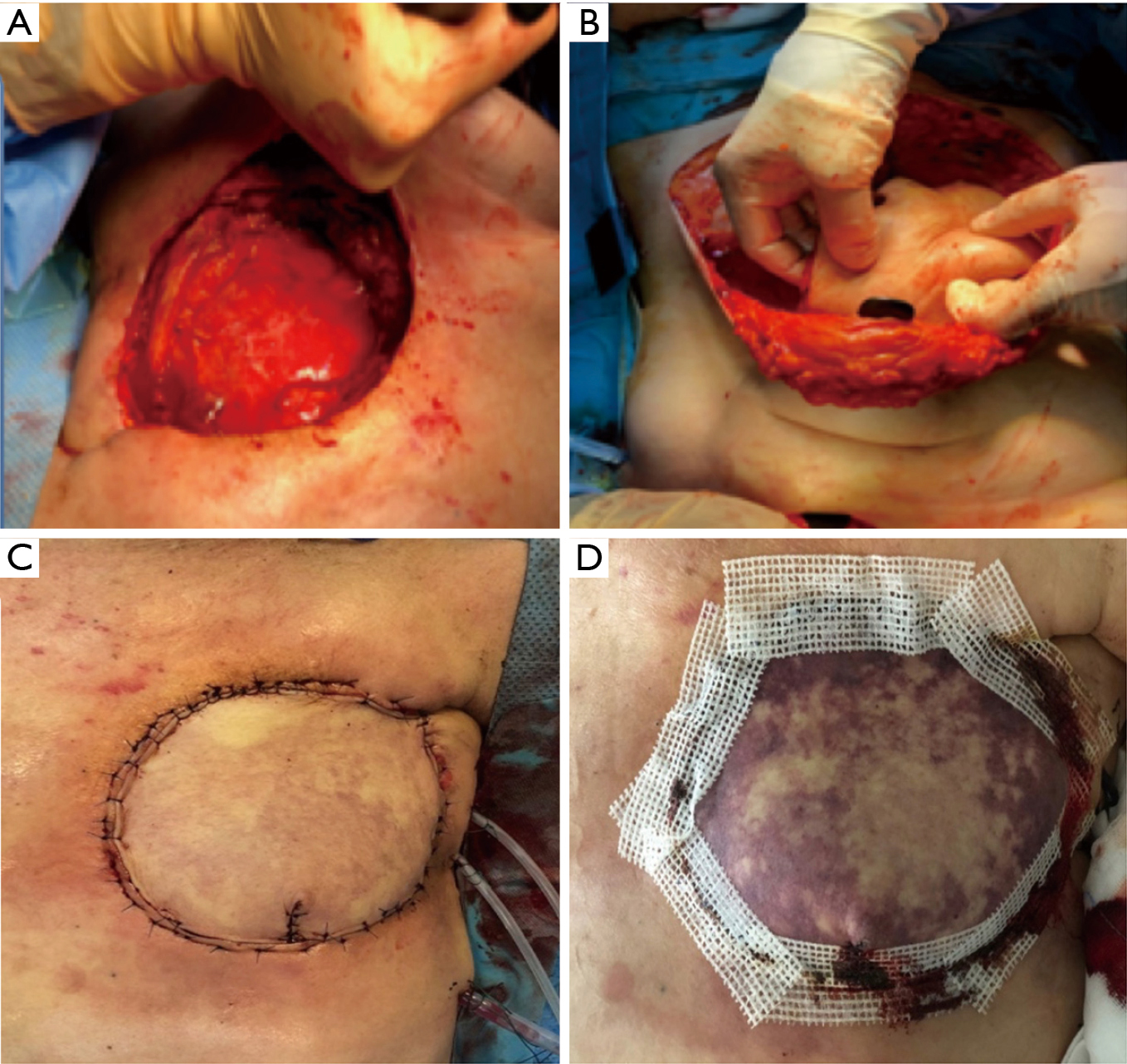
En guise d’alternative, pour couvrir le défaut, un lambeau de muscle latissimus dorsi a été utilisé (figure 9A) mais, après quatre jours, une nécrose est à nouveau survenue (figure 9B).
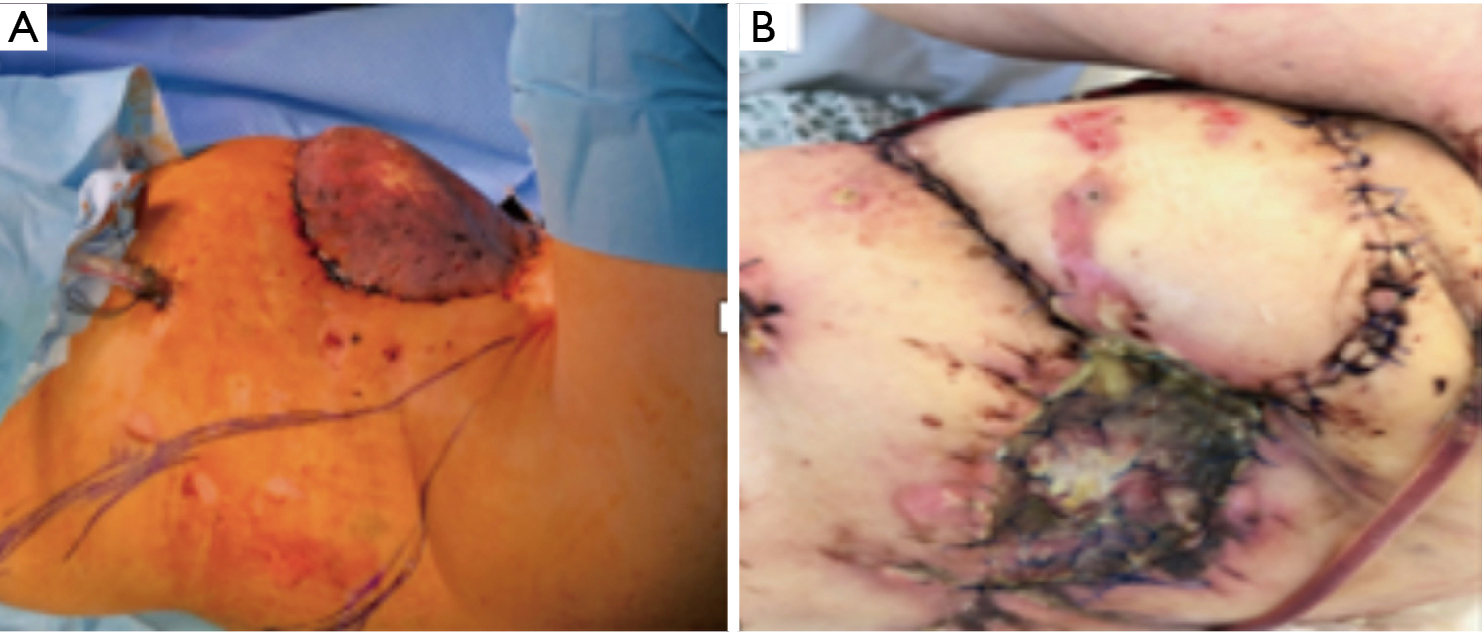
Le grand épiploon a donc été déraciné à travers un tunnel sous-cutané de l’abdomen au thorax en utilisant l’approche laparoscopique. L’opercule du diaphragme a été rendu suffisamment spacieux pour maintenir l’approvisionnement en sang du grand épiploon une fois transféré dans le défaut de la paroi thoracique antérieure. Le pédicule du grand épiploon a ensuite été recouvert par une greffe de peau prélevée sur la cuisse droite. Cependant, en raison d’une nouvelle nécrose partielle, nous avons amené le patient pour la quatrième fois au bloc opératoire (Figure 10).
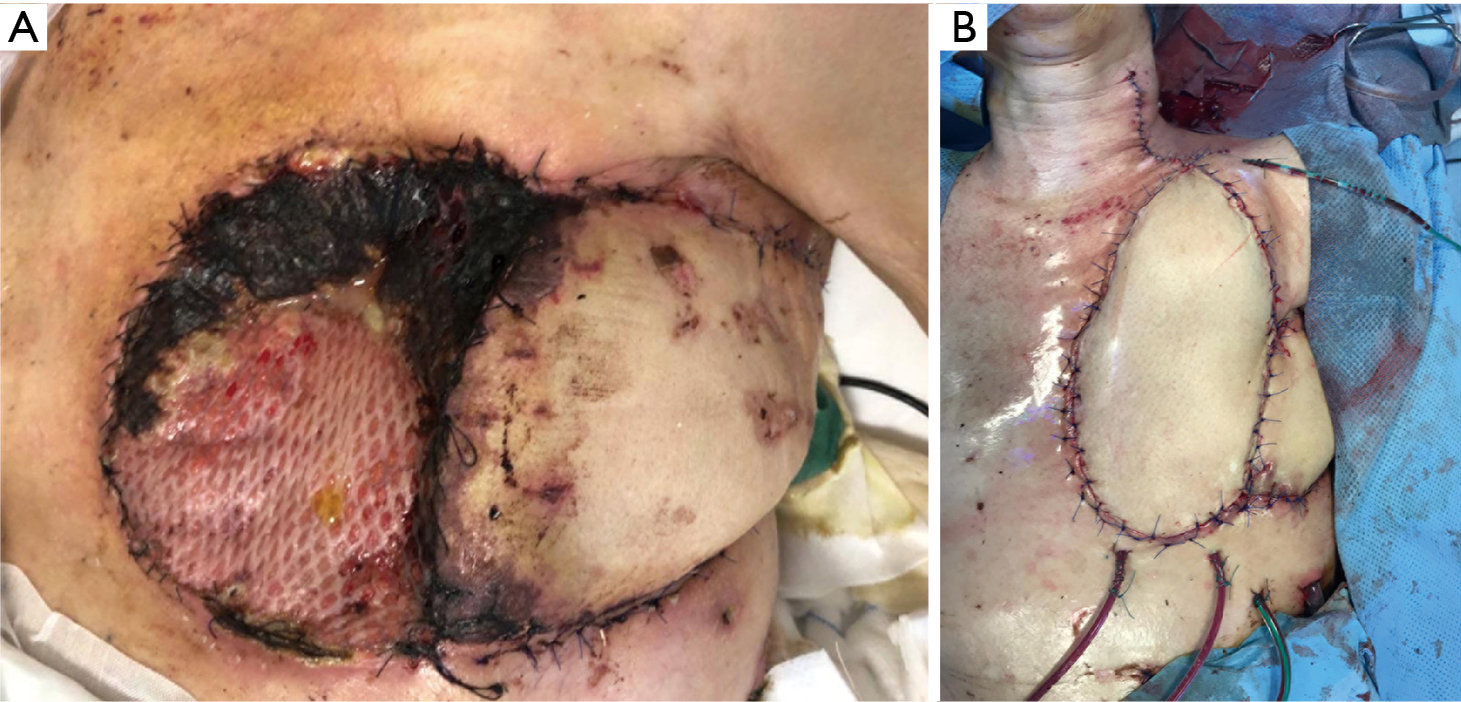
Un lambeau libre de la cuisse gauche a été prélevé. Les vaisseaux du greffon ont été anastomosés, avec une vue agrandie, bout à bout à l’artère thyroïdienne inférieure et à la veine jugulaire interne. Le site donneur a ensuite été principalement fermé.
Enfin, il n’y a pas eu de problèmes postopératoires liés à la vascularisation du greffon. Enfin, le patient se remet lentement et régulièrement des procédures chirurgicales.
Résultats
Parmi ces quatre patients atteints de maladies thoraciques antérieures, nous avons eu des résultats différents entre les deux groupes.
Dans les deux jeunes patients, l’un avec une fracture traumatique déplacée du sternum et l’autre avec un thorax en pigeon, nous avons eu de bons résultats en corrigeant les déformations puis en le fixant en utilisant une combinaison de différents matériaux. Comme nous l’avons déjà montré, le suivi par tomodensitométrie confirme le bon résultat esthétique, avec une reconstruction satisfaisante et un mouvement régulier. Les patients et les parents décrivent une amélioration du confort émotionnel et de la confiance en soi, ainsi qu’une augmentation des activités physiques et de bien-être entre la période pré- et post-chirurgicale.
L’évolution postopératoire a été compliquée chez les deux patients les plus âgés qui avaient subi une chirurgie et une radiothérapie antérieures pour un cancer du sein. Les deux cas ont eu une déhiscence cutanée et ont nécessité une révision chirurgicale supplémentaire.
Conclusions
Les déformations de la paroi thoracique antérieure peuvent survenir à la suite de malformations congénitales, de traumatismes, de néoplasmes (comme les tumeurs métastatiques ou primaires), de radiothérapie et d’infections.
Il y a un certain désaccord quant aux lésions de la paroi thoracique qui devraient être réparées mais, généralement, les blessures de moins de 5 cm d’étendue dans n’importe quel endroit, et celles jusqu’à 10 cm de dimension attribuée postérieurement ne nécessitent pas de réparation pour des raisons fonctionnelles (3).
Au fil des ans, plusieurs procédures chirurgicales ont été décrites, comprenant divers matériaux pour la réparation ou la stabilisation de la paroi thoracique. Ce qui est primordial, en particulier après une résection étendue de la paroi thoracique, c’est : d’assurer une stabilisation et un soutien optimaux de la cage thoracique, d’éviter une insuffisance respiratoire, un mouvement respiratoire paradoxal, une hernie des organes thoraciques, de prévenir les douleurs postopératoires chroniques et d’obtenir des résultats cosmétiques acceptables (1). Les résultats optimaux sont obtenus en utilisant une combinaison de matériaux prothétiques rigides et biologiques (13) ou de tissus autogènes.
Nous rapportons ici une petite série de cas de 4 patients traités pour quatre maladies différentes avec quatre techniques différentes. Le choix du type d’implant a été fait en fonction de ce que sont les caractéristiques du matériau prothétique idéal tel qu’énoncé par Le Roux et Shama (2) :
- Rigidité pour abolir le mouvement paradoxal;
- Inertesse pour permettre la croissance interne du tissu fibreux et diminuer la probabilité d’infection;
- Malléabilité pour qu’il puisse être façonné à la forme appropriée au moment de l’opération;
- Radiolucidité pour permettre le suivi radiographique des problèmes sous-jacents.
Avec ces principes à l’esprit, nous avons utilisé un type de matériau différent, toujours en combinaison, pour couvrir et protéger les structures sous-jacentes et prévenir le flail chest et la respiration paradoxale.
De plus, nous aimerions souligner comment ces matériaux, couramment utilisés dans d’autres spécialités, peuvent être amenés à une activité synergique avec des patchs ou des plaques/mailles en titane pour un résultat optimal dans les scénarios de reconstruction/stabilisation de la paroi thoracique en chirurgie thoracique.
L’idée, derrière le dispositif de fixation osseuse absorbable en PLLA (acide poly-L-lactique) que nous avons utilisé comme infibulateur médullaire osseux, est d’aider à stabiliser grandement le travail des barres en titane. Le système Zipfix a été créé pour permettre une fermeture sternale rapide. Le système est principalement constitué de PEEK (polyétheréthercétone). Il est facile à appliquer, biocompatible et compatible avec la résonance magnétique après le retrait de l’aiguille en acier inoxydable. Nous avons utilisé ce matériau pour fixer l’articulation claviculaire et les plaques de côtes.
Le scanner 3D a eu un rôle central dans le succès de notre chirurgie thoracique reconstructive en nous aidant à corriger l’approche chirurgicale en fonction de la distribution spatiale de la zone malade à corriger ou à enlever.
Enfin, une planification multidisciplinaire, ainsi qu’une approche chirurgicale rationnelle conduit à de bons résultats et à trouver la bonne solution en cas de complications, comme rapporté dans notre petite série de cas.
Remerciements
Nous tenons à remercier Mmes Simonetta Padovani et Nadia Lanni pour leur travail exceptionnel dans la collecte des données cliniques et gérer avec beaucoup de professionnalisme et d’empathie les interactions avec nos patients et leur famille.
Financement : Aucun
Note de bas de page
Provenance et révision par les pairs : Cet article a été commandé par les éditeurs invités (Francesco Zaraca, Reinhold Perkmann, Luca Bertolaccini et Roberto Crisci) pour le numéro ciblé « Chirurgie thoracique sans frontières » publié dans Current Challenges in Thoracic Surgery. L’article a été envoyé pour une évaluation externe par les pairs organisée par les éditeurs invités et le bureau éditorial.
Conflits d’intérêts : Tous les auteurs ont rempli le formulaire de divulgation uniforme de l’ICMJE (disponible sur http://dx.doi.org/10.21037/ccts.2020.02.05). Le numéro focalisé « Chirurgie thoracique sans frontières » a été commandé par le bureau éditorial sans aucun financement ou parrainage. ND est membre non rémunéré du comité de rédaction de Current Challenges in Thoracic Surgery de février 2020 à janvier 2022. Les auteurs n’ont pas d’autres conflits d’intérêts à déclarer.
Déclaration éthique : Les auteurs sont responsables de tous les aspects du travail en veillant à ce que les questions liées à l’exactitude ou à l’intégrité de toute partie du travail soient examinées et résolues de manière appropriée. Ce travail étant une étude rétrospective, aucune approbation du comité d’éthique et aucun consentement éclairé des patients n’ont été nécessaires. L’étude a été menée conformément à la Déclaration d’Helsinki (telle que révisée en 2013).
Déclaration d’accès ouvert : Il s’agit d’un article en accès libre distribué conformément à la licence internationale Creative Commons Attribution-NonCommercial-NoDerivs 4.0 (CC BY-NC-ND 4.0), qui permet la reproduction et la distribution non commerciales de l’article à la stricte condition qu’aucune modification ou édition ne soit effectuée et que l’œuvre originale soit correctement citée (y compris les liens vers la publication officielle par le biais du DOI pertinent et la licence). Voir : https://creativecommons.org/licenses/by-nc-nd/4.0/.
- Sanna S, Brandolini J, Pardolesi P, et al. Matériaux et techniques dans la reconstruction de la paroi thoracique : une revue. J Vis Surg 2017;3:95.
- Hameed A, Akhtar S, Naqvi A, et al. Reconstruction de défauts complexes de la paroi thoracique en utilisant un filet de polypropylène et un lambeau de latissimus dorsi pédiculé : une expérience de 6 ans. J Plast Reconstr Aesthet Surg 2008;61:628-35.
- Brichon PY, Wihlm JM. Correction d’une poitrine de pigeon de Pouter sévère par triple ostéotomie sternale avec une nouvelle fixation de la cage thoracique en titane. Ann Thorac Surg 2010;90:e97-9.
- Lam CR, Taber RE. Traitement chirurgical du pectus carinatum. Arch Surg 1971;103:191-4.
- Saito T, Iguchi A, Sakurai M, et al. Biomechanical study of a Poly-L-Lactide (PLLA) sternal pin in sternal closure after cardiothoracic surgery. Ann Thorac Surg 2004;77:684-7.
- Athanassiadi K, Gerazounis M, Moustardas M, et al. Fractures sternales : analyse rétrospective de 100 cas. World J Surg 2002;26:1243-6.
- Severson EP, Thompson CA, Resig SG, et al. Transverse sternal nonunion, repair and revision : a case report and review of the literature. J Trauma 2009;66:1485-8.
- Queitsch C, Kienast B, Voigt C, et al. Traitement du non-union sternale post-traumatique avec une plaque de sternumosteosynthèse verrouillée (TiFix). Blessure 2011;42:44-6.
- Cahan WG, Woodard HQ, Higinbotham NL, et al. Sarcome survenant dans un os irradié : rapport de 11 cas. Cancer 1948;1:3-29.
- Veronesi U, Cascinelli N, Mariani L, et al. Suivi de vingt ans d’une étude randomisée comparant la chirurgie de conservation du sein à la mastectomie radicale pour le cancer du sein précoce. N Engl J Med 2002;347:1227-32.
- Yap J, Chuba PJ, Thomas R, et al. Sarcome comme deuxième malignité après le traitement du cancer du sein. Int J Radiat Oncol Biol Phys 2002;52:1231-7.
- Zhou Y, Zhang Y. Reconstruction à un seul stade ou à deux stades pour un ulcère chronique de la paroi thoracique post-radiation. Une étude rétrospective sur 10 ans des ulcères chroniques radio-induits. Médecine 2019;98:e14567.
- Tamburini N, Grossi W, Sanna S, et al. Reconstruction de la paroi thoracique à l’aide d’une nouvelle maille en titane : une expérience multicentrique. J Thorac Dis 2019;11:3459-66.
Citer cet article comme : Giunta D, Daddi N, Antonacci F, Pinto V, Solli P, Dolci G. Reconstruction de la paroi thoracique antérieure pour une pathologie oncologique et non oncologique : une série de cas. Curr Chall Thorac Surg 2020;2:24.