Structure de Kekulé pour le benzène
On savait que le benzène avait la formule moléculaire C6H6, mais sa formule développée était inconnue.
Si le benzène était un hydrocarbure insaturé à chaîne droite, il devrait facilement subir des réactions d’addition (tout comme les autres alcènes et alcynes).
Par exemple, le brome, Br2, devrait s’ajouter à travers la double ou triple liaison comme indiqué ci-dessous :
| réaction d’addition possible de structure à chaîne droite : | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Mais, lorsque le brome est ajouté au benzène à 25°C et à 1 atm (101.3 kPa) de pression, aucune réaction ne semble se produire.
Donc, les structures possibles du benzène impliquant des doubles et/ou triples liaisons disposées en chaîne semblaient les plus improbables car elles devraient subir des réactions d’addition.
Si l’on ajoute du brome au benzène en présence de FeBr3, celui-ci subit une réaction de substitution dans laquelle un des atomes d’hydrogène est remplacé par un atome de brome pour produire un composé de formule C6H5Br, comme indiqué ci-dessous :
| Réaction de substitution connue : | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
A cet égard, le benzène se comportait beaucoup plus comme un hydrocarbure saturé (seulement des liaisons simples entre les atomes de carbone).
Donc, la première structure proposée par Kekulé pour le benzène en 1865 ne contenait aucune double liaison mais disposait les 6 atomes de carbone en un cycle comme indiqué ci-dessous :
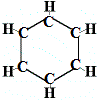
Kekulé s’est rendu compte que cette molécule rompt la règle de tétravalence du carbone, c’est-à-dire que chaque atome de carbone ne forme que 3 liaisons au lieu de 4.
Donc, en 1872, Kekulé a proposé une structure de benzène composée de trois liaisons simples et doubles alternées, comme indiqué ci-dessous :
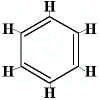
Notez que, bien que les atomes de carbone ne soient pas écrits dans la structure, il est toujours entendu qu’un atome de cabon existe là où deux lignes de l’hexagone se rejoignent, de sorte qu’il y a 6 « jointures », 6 angles, et donc 6 atomes de carbone.
Dans cette structure, chaque atome de carbone est lié à un atome d’hydrogène, et, à deux autres atomes de carbone. L’une des liaisons carbone-carbone est une liaison simple, l’autre liaison carbone-carbone est une liaison double. Chaque atome de carbone a réalisé 4 liaisons.
Bien que cette structure n’explique pas pourquoi le benzène ne subit pas de réactions d’addition, elle pourrait expliquer pourquoi le benzène ne forme qu’un seul isomère structural lorsque le benzène réagit avec le brome dans une réaction de substitution comme indiqué ci-dessous :
 structure proposée du benzène |
+ Br2 | → | 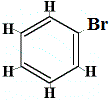 un seul isomère structural |
. | + HBr |
Les autres structures cycliques proposées pour le benzène auraient prédit plus d’un isomère structural pour le produit de la réaction de substitution, comme indiqué ci-dessous :
| autres structures cycliques proposées pour la réaction : | 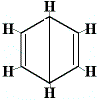 |
Br2 → |
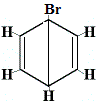 isomère structural 1 |
+ | . | 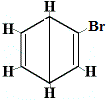 isomère structurel 2 |
Que se passerait-il si un autre atome d’hydrogène était remplacé (substitué) par un atome de brome ?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Combien d’isomères structurels de C6H4Br2 seraient produits ?
 |
Br2 → FeBr3 |
. 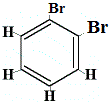 isomère structurel 1 |
+ | 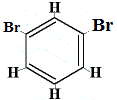 isomère structurel 2 |
+ | . 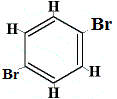 isomère structurel 3 |
+ | 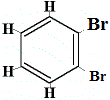 isomère structurel 4 |
Les isomères structurels 1 et 4 sont différents car dans l’isomère 1, les deux atomes de Br sont liés aux atomes de carbone sur une liaison C-.C, alors que dans l’isomère 4, les deux atomes de Br sont liés à des atomes de carbone sur une liaison C=C.
Cependant, lorsque le C6H5Br fabriqué à partir du benzène réagit avec le brome dans une réaction de substitution, seuls 3 isomères structurels de C6H4Br2 sont produits !
Afin de résoudre ce problème, Kekulé a proposé que le cycle benzénique soit en équilibre rapide entre les structures dans lesquelles les doubles liaisons sont dans les positions alternatives comme indiqué ci-dessous :
 |
⇋ |  |
Ainsi, lorsque le brome réagit avec C6H5Br dans une réaction de substitution pour produire C6H4Br2, les paires d’isomères structurels de C6H4Br2 sont en équilibre les unes avec les autres.
Cela signifie que les isomères structuraux 1 et 4 présentés ci-dessus, qui diffèrent seulement par le fait que les atomes de Br sont liés à travers une liaison simple ou une double liaison, sont maintenant en équilibre rapide l’un avec l’autre comme indiqué ci-dessous :
| Atomes de Br sur des atomes de C adjacents, l’isomère structural 1 a des atomes de Br sur C-C l’isomère structural 4 a des atomes de Br sur C=C |
 l’isomère structural 1 |
⇋ |  l’isomère structural 4 |
Selon Kekulé, ces deux isomères structuraux de C6H4Br2 sont en équilibre si rapide qu’ils ne peuvent être séparés comme deux molécules distinctes, il semble donc qu’il n’y ait que 3 isomères au lieu de 4.
Bien que cette structure d’équilibre rapide pour le benzène, connue sous le nom de structure de Kekulé, se soit avérée utile, elle n’explique pas la stabilité unique (absence de réactivité) du cycle benzénique, elle n’explique pas pourquoi le benzène ne subit pas facilement des réactions d’addition mais peut être induit à subir des réactions d’addition.
Comprenez-vous cela ?
Rejoignez AUS-e-TUTE!
Passez le test maintenant!