Introduction
L’immunofluorescence (IF) utilise des anticorps et une détection fluorescente pour étudier la localisation, l’expression relative et les états d’activation des protéines cibles dans des cellules ou des tissus fixés. L’IF est largement utilisée dans divers domaines d’étude.
L’IF peut être utilisée pour répondre à des questions telles que :
- Quelles cellules ou quels tissus expriment ma ou mes protéines cibles ?
- Comment l’expression et/ou l’activation de ma protéine cible change-t-elle en réponse à des perturbations expérimentales ?
- Où dans la cellule/le tissu la protéine cible est-elle localisée ?
- Quelle est la relation spatiale entre les différentes protéines cibles dans le contexte de l’architecture cellulaire ou tissulaire ?
L’immunofluorescence englobe un certain nombre de techniques connexes qui ont évolué au fil du temps. Toutes ces techniques tirent parti de la reconnaissance spécifique de cibles biologiques par des anticorps et de la détection de rapporteurs fluorescents dans l’analyse cytométrique. S’assurer que l’échantillon biologique est bien préservé tandis que les antigènes cibles sont accessibles aux anticorps est important, mais peut présenter des défis qui varient en fonction de l’échantillon, de la cible et de l’anticorps.
Sur cette page, nous avons compilé des ressources pour vous aider à naviguer dans les protocoles, répondre aux questions courantes et vous aider à concevoir des expériences IF réussies.
Choisir la bonne technique et le bon protocole d’IF
La technique/le protocole d’IF optimal est influencé par le type de matériel biologique, les étapes de traitement de l’échantillon, les propriétés de l’antigène cible et l’anticorps particulier utilisé.
Les considérations comprennent :
- Les matériaux d’entrée peuvent être des lignées cellulaires cultivées, des tissus congelés ou des tissus fixés au formol et inclus en paraffine (FFPE).
- Pour les lignées cellulaires cultivées et les cellules primaires, recherchez des anticorps validés pour l’immunofluorescence-immunocytochimie (IF-IC).
- Dans de nombreux laboratoires, le terme « immunohistochimie/IHC » est utilisé comme un terme fourre-tout pour inclure les tissus inclus en paraffine ou congelés, et peut être utilisé pour inclure la détection chromogène et fluorescente. Sur cellsignal.com, les applications font la distinction entre les préparations de tissus congelés (IF-F) et les préparations de tissus inclus en paraffine.
- Pour les échantillons de tissus FFPE, les anticorps validés pour l’immunohistochimie (IHC-P) peuvent également être utilisés avec une détection par fluorescence sans amplification si l’antigène cible est abondant, ou en IHC multiplexé (mIHC) avec une amplification du signal.
- Un anticorps peut être validé pour une ou plusieurs des applications énumérées ci-dessus. Les recommandations de protocoles sont le résultat des tests effectués par les scientifiques au cours du processus de validation.
- Les protocoles spécifiques aux produits se trouvent sur la page web de chaque produit. Pour les anticorps validés par IF, sélectionnez « IF » sur la page du produit pour afficher les données et le protocole de validation IF. Les informations de base (dilutions/concentration de travail, applications validées, réactivité de l’espèce, espèce hôte) pour chaque anticorps sont incluses dans la fiche technique du produit.
- Les protocoles d’IF les plus couramment utilisés se trouvent également sur la page des protocoles.
- Vous n’avez pas besoin ou ne voulez pas utiliser la détection par fluorescence pour vos échantillons de tissus ? Une approche alternative est la détection chromogénique, couverte sur la page IHC.
Choisir des anticorps pour l’IF : l’importance de la validation des anticorps
Les meilleurs anticorps produisent un signal fort et spécifique avec un fond minimal. Il est important de choisir des anticorps qui ont été validés dans l’application que vous allez utiliser. La validation des anticorps dans l’IF peut inclure des expériences d’expression positive et négative (en utilisant des lignées cellulaires knockout, des modèles génétiques, CRISPR ou RNAi), la manipulation expérimentale de la localisation de la protéine cible ou des modifications post-traductionnelles, et l’optimisation du protocole.
La performance d’un anticorps varie selon l’application. Un anticorps qui donne de bons résultats dans une expérience de western blot, par exemple, peut ou non donner de bons résultats en IF. Au cours des essais de nouveaux anticorps, certains présenteront une liaison hors cible mineure ; ces anticorps ne sont jamais recommandés pour l’immunofluorescence ou d’autres applications non-BW. En outre, un anticorps peut donner de bons résultats sur des tissus congelés mais pas sur des tissus FFPE, ou vice versa. La sensibilité et la performance des anticorps peuvent changer en fonction de la façon dont l’échantillon est fixé et traité et des conditions de travail des anticorps.
Une fois que vous avez décidé du type d’échantillons biologiques à utiliser dans votre expérience et de la façon dont ils seront préparés, la façon la plus simple de parcourir les anticorps sur cellsignal.com est de sélectionner d’abord l’application appropriée. Ensuite, vous pouvez entrer des termes de recherche ou sélectionner d’autres attributs (tels que l’espèce hôte, le domaine de recherche, et plus encore) pour affiner votre recherche et sélectionner un anticorps qui a été validé dans l’application dont vous avez besoin.
Conception d’expériences de contrôle pour l’IF
Pour être sûr de votre conception expérimentale et de vos résultats, et que votre anticorps rapporte fidèlement sa cible, des expériences de contrôle positif et négatif peuvent être informatives. Par exemple :
- Les contrôles secondaires seuls peuvent vous indiquer s’il y a une liaison non spécifique de l’anticorps secondaire.
- Confirmez la spécificité d’un anticorps primaire en concevant des expériences de Knockout/siRNA ou en comparant des lignées cellulaires connues exprimant et n’exprimant pas.
- Les expériences de cible unique sont utilisées pour mettre en place l’imagerie par démixage spectral. Ce type d’expérience peut aider à déterminer si un manque de coloration est dû à un encombrement stérique qui se produit lorsque 2 antigènes sont à proximité l’un de l’autre.
- Traiter les échantillons avec de la phosphatase pour confirmer que les anticorps phospho-spécifiques reconnaissent uniquement la cible phosphorylée en IF.
- Si vous suspectez des problèmes de fixation ou de perméabilisation, vérifier avec un anticorps qui a fonctionné pour votre laboratoire dans le passé peut être utile pour le dépannage.
Les scientifiques de Cell Signaling Technology (CST) effectuent régulièrement ces types de contrôles dans le cadre de notre processus de validation (voir un exemple). Il peut être intéressant de mettre en place des contrôles similaires dans votre système modèle expérimental, en particulier si vous avez des difficultés à obtenir les résultats souhaités.
Anticorps primaires vs secondaires et coloration directe vs indirecte
Les anticorps primaires permettent une reconnaissance spécifique de l’antigène cible. Les anticorps secondaires se lient aux anticorps primaires en fonction de l’espèce dans laquelle ils ont été élevés. Les anticorps primaires qui ont été élevés chez le lapin ou la souris se prêtent à la détection avec des anticorps secondaires anti-lapin ou anti-souris, respectivement.
L’appariement d’un anticorps primaire et d’un anticorps secondaire (spécifique de l’espèce hôte du primaire) qui est conjugué à un fluorophore est connu sous le nom de coloration indirecte. L’utilisation d’anticorps primaires conjugués à des fluorophores, sans anticorps secondaires, est connue sous le nom de coloration directe. Les méthodes de coloration directe permettent d’économiser du temps et de réaliser un multiplexage en utilisant des anticorps produits dans la même espèce hôte. La coloration indirecte offre traditionnellement une plus grande sensibilité grâce à l’amplification du signal qui se produit lorsque plusieurs anticorps secondaires se lient à un seul anticorps primaire.
D’autres variations de ces techniques sont disponibles, comme l’utilisation d’anticorps primaires biotinylés avec un fluorochrome conjugué à l’avidine/streptavidine. Des fragments d’anticorps secondaires F(ab’)2 conjugués à un fluorophore (dépourvus du domaine Fc) peuvent contribuer à réduire le bruit de fond. En mIHC, des anticorps secondaires conjugués à la peroxydase de raifort (HRP) sont employés pour catalyser le dépôt des conjugués tyramide-fluorophore.
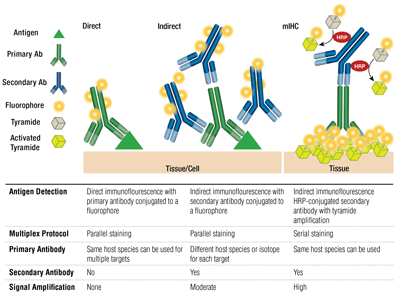
Sélection des anticorps fluorophores
Sélection des anticorps fluorophores
Combien de cibles/anticorps peuvent être multiplexés ?
Le multiplexage emploie la détection de plus d’une cible à la fois par le biais de plusieurs anticorps et la détection de différentes longueurs d’onde (couleurs) pour chaque cible. Pour la coloration indirecte, la capacité de multiplexage repose sur l’appariement d’anticorps secondaires spécifiques à l’espèce, conjugués à un fluorophore, à chaque anticorps primaire. Les anticorps de souris d’isotypes distincts peuvent également être multiplexés en utilisant des anticorps secondaires spécifiques de l’isotype, ce qui permet de détecter jusqu’à 5 anticorps de souris en même temps. Pour une coloration directe, chaque anticorps primaire doit être couplé à un fluorophore différent. Cela permet de combiner plusieurs anticorps de la même espèce/isotype et permet également une coloration « souris sur souris », puisque la liaison non spécifique des secondaires anti-souris aux tissus de la souris n’est pas un problème.
Lors de la conception d’expériences de FI multiplex, les caractéristiques spectrales du microscope à fluorescence, y compris les sources d’excitation et les ensembles de filtrage disponibles, doivent être prises en compte pour éviter le bleed-through spectral. Les microscopes à fluorescence épifluorescents et confocaux modernes ont généralement la capacité de distinguer 3 canaux ou plus.
Combinaison de la coloration des anticorps avec des colorants ou des étiquettes
Les colorants cellulaires qui sont appliqués post-fixation ou les étiquettes de cellules vivantes fixables peuvent être incorporés dans un flux de travail IF. Le marquage des organites est souvent utilisé pour vérifier la localisation subcellulaire d’une cible. Les marqueurs exprimés, tels que la GFP, sont souvent utilisés pour suivre les cellules transfectées ou dans les expériences en mosaïque ; si le signal de fluorescence de la GFP est faible, un anticorps anti-GFP peut être utilisé en IF. L’utilisation de colorants ou de protéines fluorescentes occupera les canaux de fluorescence, laissant moins de disponibilité pour les anticorps.
Choix des fluorophores pour votre expérience
Cela dépendra des caractéristiques spectrales de la source d’excitation et du filtrage d’excitation/émission dont vous disposez. Évaluez le profil d’excitation et d’émission du fluorophore avant d’exécuter votre expérience afin d’éviter le bleed through de la fluorescence. La CST propose une variété d’anticorps primaires et secondaires conjugués à un fluorophore, y compris des colorants de la gamme Alexa Fluor®.
Préparation des échantillons
Tissus
Les coupes de tissus peuvent être préparées soit par congélation rapide dans un milieu à température de coupe optimale (OCT), soit par fixation et inclusion en paraffine. Les échantillons congelés peuvent être sectionnés à l’aide d’un cryostat et laissés sécher à l’air sur la lame 10 à 15 minutes avant la fixation avant l’étape suivante. Pour les échantillons de tissus FFPE, les exigences relatives aux étapes de prélèvement, de fixation et d’inclusion en paraffine peuvent varier selon le type de tissu.
Tissus congelés contre tissus FFPE
En général, les tissus FFPE donnent une meilleure morphologie que les tissus congelés inclus dans les OCT. Cela peut faciliter la quantification des cellules positives ou l’identification des limites entre les taches. Les tissus FFPE sont également très stables ; une fois inclus, les blocs de tissus peuvent être conservés pendant des années. Ce type de tissu est également plus facile à expédier entre les laboratoires, et c’est la méthode de traitement préférée pour les échantillons de pathologie humaine.
En revanche, le tissu FFPE subit plusieurs étapes de traitement supplémentaires qui réduisent la quantité totale d’antigène en raison de la dégradation des protéines, nécessitent des étapes de démasquage pour détecter l’antigène restant, et exacerbent l’autofluorescence induite par les aldéhydes. À moins de travailler avec une protéine très abondante, l’antigène restant peut être difficile à détecter par immunofluorescence indirecte et peut nécessiter une amplification pour produire une coloration appropriée. Il est également possible que la récupération de l’antigène puisse démasquer des antigènes qui ne seraient normalement pas détectés et qu’un anticorps qui donne autrement le schéma de coloration attendu puisse donner une coloration non spécifique. Il est également possible de travailler avec une cible pour laquelle une méthode spécifique de récupération d’antigène est nécessaire pour détecter l’épitope cible. Par conséquent, il est important de considérer comment un anticorps est validé et quelles sont les étapes nécessaires pour l’utiliser.
Dans le cas des tissus congelés incorporés par OCT, la réduction du traitement est prioritaire sur la morphologie. Il s’agit de la méthode la plus rapide pour obtenir des résultats d’immunomarquage, car les lames sont prêtes à être utilisées au moment où le tissu est coupé et il y a moins d’étapes de traitement avant l’inclusion. Il y a moins de dégradation des protéines et une plus grande quantité d’antigène est disponible pour fixer les anticorps sans nécessiter d’étapes de récupération supplémentaires et difficiles. Comme cette méthode ne nécessite pas d’amplification, elle est plus sensible à la qualité du tissu. Le type de fixation (alcool ou aldéhyde), la durée (certaines cibles, comme les facteurs de transcription, nécessitent un temps de fixation plus court) et l’âge du tissu (surtout après la coupe) sont tous importants et varient selon la cible. Enfin, travailler avec des tissus congelés donne plus de flexibilité dans la sélection des cibles, car le traitement peut avoir lieu après la section permettant une plus grande personnalisation dans la conception du test.
Cellules cultivées
Les cellules doivent être ensemencées sur un matériau de support compatible avec la microscopie à fluorescence. Les supports typiques comprennent des boîtes de culture cellulaire à fond de verre, des lamelles de verre (conservées dans des boîtes de culture en plastique) préparées avec de la polylysine et/ou des composants de la matrice extracellulaire pour soutenir la culture de cellules adhérentes, et des chambres multipuits disponibles dans le commerce montées sur des lames de verre compatibles avec les microscopes.
Notez que les conditions de culture cellulaire peuvent affecter la santé des cellules, la morphologie et l’expression/localisation de votre protéine cible et, en fin de compte, dicter la qualité de vos données IF. Assurez-vous que vos cellules sont saines en vérifiant régulièrement les changements de pH du milieu de culture et en inspectant les signes de stress cellulaire (comme les cellules multinucléées) à faible grossissement au microscope. Vérifiez également que la confluence des cellules est appropriée pour le type de cellule et la cible.
Fixation de l’échantillon
Le fixateur idéal préserve un instantané « ressemblant à la vie » tout en arrêtant rapidement le processus de dégradation de l’autolyse par réticulation et inhibition des enzymes endogènes, et il présente l’antigène pour la reconnaissance par l’anticorps. Malheureusement, il n’existe pas de méthode de fixation unique qui fonctionne idéalement sur tous les échantillons et pour tous les antigènes. Même des antigènes différents sur la même protéine cible peuvent présenter des différences entre les protocoles. C’est pourquoi le meilleur protocole peut varier non seulement selon le type d’échantillon mais aussi selon l’épitope (et l’anticorps).
Tissue
Pour les tissus fraîchement congelés, les sections qui ont été congelées et cryostatées doivent maintenant être traitées avec un fixateur. Alternativement, les échantillons de tissus peuvent être préservés en fixant d’abord avec une perfusion ou une immersion transcardiaque, une post-fixation et des étapes de cryoconservation, suivies de la congélation et de la section.
Dans le traitement des tissus FFPE, les tissus sont préservés via une fixation par immersion avec du formol (ou un autre fixateur à base d’aldéhyde) ou avec une perfusion comme ci-dessus, suivie d’un enrobage en paraffine et d’une section. Avant l’incubation avec l’anticorps, les sections doivent subir des étapes de déparaffinisation, de réhydratation et de récupération de l’antigène pour permettre aux anticorps d’accéder à l’échantillon et de lier les molécules cibles.
Cellules
Rincer les cellules avec un milieu chaud sans protéines ou du PBS immédiatement avant la fixation peut empêcher la précipitation des protéines extracellulaires et des débris. La fixation rapide est réalisée en échangeant rapidement les milieux pour la solution fixatrice.
Fixation à l’aldéhyde vs fixation à l’alcool
Les fixateurs à base d’aldéhyde tels que le formaldéhyde, le formol (un mélange de formaldéhyde dissous avec un pourcentage plus faible de méthanol) et le glutaraldéhyde sont le plus souvent utilisés lorsque la préservation de la structure est primordiale. Pour la plupart des anticorps, la CST recommande la fixation avec du formaldéhyde à 4 % (sans méthanol). Les aldéhydes réagissent et réticulent les amines primaires des protéines cellulaires et stabilisent l’échantillon. En outre, les enzymes cellulaires, y compris les phosphatases et les protéases, sont désactivées par la réticulation. Les aldéhydes traversent la membrane plasmique et fixent les protéines solubles mieux que les alcools, mais certaines cibles peuvent perdre leur antigénicité avec la réticulation des aldéhydes.
Les fixateurs alcooliques déshydratants/dénaturants, comme le méthanol, déplacent l’eau autour des macromolécules cellulaires, ce qui entraîne leur dénaturation et leur précipitation in situ. La dénaturation de la protéine cible peut exposer les épitopes enfouis, ce qui rend cette approche avantageuse par rapport à la fixation par aldéhyde pour certains anticorps. Cependant, les fixateurs déshydratants sont moins adaptés aux cibles solubles et aux anticorps à état de modification spécifique tels que les phospho-anticorps. Consultez la fiche technique du produit pour connaître la méthode de fixation optimale.
Choisir un agent perméabilisant
Si un fixateur réticulant est utilisé, la membrane plasmique sera toujours intacte, rendant les cibles intracellulaires inaccessibles aux anticorps. Par conséquent, la perméabilisation doit être effectuée après une fixation réticulante, sauf si vos anticorps reconnaissent des épitopes extracellulaires. La méthode de perméabilisation optimale varie selon l’anticorps ; consultez toujours la page du produit pour connaître le protocole recommandé.
L’utilisation de la perméabilisation au Triton® X-100 après la fixation est courante. Le Triton et d’autres détergents, comme le NP-40, le TWEEN®, la saponine, la digitonine et le DOTMAC, interagissent avec les membranes cellulaires pour créer des » pores » de taille variable et permettre l’accès des anticorps.
Alternativement, une perméabilisation à l’alcool avec de l’éthanol ou du méthanol peut être effectuée après l’étape de fixation. Cette méthode combine la fixation rapide des fixateurs réticulants avec une dénaturation intermédiaire des protéines et une délipidation de la membrane. Cela peut améliorer le signal pour certaines cibles, en particulier celles associées aux organelles ou au cytosquelette.
Quelles conditions de fixation/perméabilisation dois-je utiliser lors d’un multiplexage ?
Si vous effectuez un multiplexage avec des anticorps qui font appel à différents protocoles de CST, vous devrez peut-être prioriser l’anticorps à utiliser dans ses conditions optimales. Un exemple d’optimisation de l’ordre effectué en mIHC est présenté dans cette note d’application (PDF). La réalisation d’un essai à petite échelle comparant différents protocoles peut être informative avant de mettre à l’échelle vos expériences.
Choisir un réactif de blocage
La recommandation la plus courante est un sérum de chèvre normal à 5 % (ou un sérum de la même espèce que l’anticorps secondaire) dans du PBS + 0,3 % de Triton® X-100. Consultez la fiche technique pour connaître l’agent bloquant recommandé.
Si des récepteurs Fc sont présents dans l’échantillon, le signal de l’anticorps proviendra d’un mélange de reconnaissance spécifique de la cible (via le site de liaison à l’antigène/la région variable de l’anticorps) ainsi que de l’absorption non spécifique de la liaison de la chaîne lourde de l’anticorps aux récepteurs Fc. L’IgG totale présente dans le sérum animal bloque les récepteurs Fc pour empêcher la liaison des anticorps primaires et secondaires et réduire le bruit de fond. Le choix de fragments F(ab’)2 conjugués à un fluorophore évitera également la liaison des récepteurs Fc pour l’anticorps secondaire (mais pas pour l’anticorps primaire)
Dans d’autres applications à base d’anticorps, comme le western blotting, les étapes de blocage réduisent le signal de fond causé par la liaison non spécifique et de moindre affinité des anticorps primaires et secondaires à des sites autres que leur cible prévue. Cependant, nous avons constaté que les anticorps monoclonaux recombinants de lapin qui ont été rigoureusement testés en immunofluorescence donnent de bons résultats sur de nombreux échantillons avec ou sans blocage. En fin de compte, choisir des anticorps de qualité validés en immunofluorescence permet d’éviter le bruit de fond.
Concentration d’anticorps et rapport signal/bruit en IF
Le rapport signal/bruit (S/N) est lié à la spécificité et à la sensibilité d’un anticorps dans une application particulière. Le S/N peut être calculé en comparant le « signal » des intensités de fluorescence dans les cellules qui expriment la cible d’intérêt au « bruit de fond » des cellules qui n’ont pas d’expression. Si l’anticorps est appliqué à une concentration trop faible, le signal de fluorescence sera trop faible pour être distingué du bruit de fond. D’autre part, une concentration excessivement élevée contribuera à la coloration de fond, diminuant le rapport S/N. Vérifiez toujours la fiche technique du produit pour connaître la dilution recommandée, qui est basée sur les titrages effectués pendant la validation de l’anticorps.
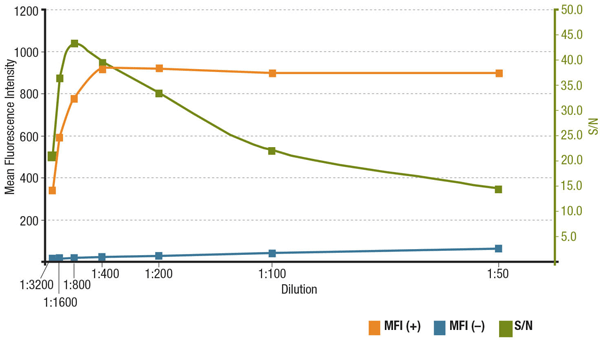
Analyse du S/N pour la dilution de MUC1 (D9O8K) XP® Rabbit mAb #14161. Quantification de l’intensité moyenne de fluorescence dans les cellules ZR-75-1 exprimant (MFI(+), orange) et les cellules HCT 116 n’exprimant pas (MFI(-), bleu), et calcul du S/N (vert).
Analyse du S/N pour la dilution de MUC1 (D9O8K) XP® Rabbit mAb #14161. Quantification de l’intensité de fluorescence moyenne dans les cellules ZR-75-1 exprimant (MFI(+), orange) et les cellules HCT 116 n’exprimant pas (MFI(-), bleu), et calcul du S/N (vert).
Temps d’incubation de l’anticorps
En général, les incubations d’une nuit à 4°C donnent un signal fort. La modification du temps d’incubation et de la température peut changer le signal et le S/N. Différents anticorps peuvent répondre différemment à la modification des conditions d’incubation ; pour en savoir plus, consultez cet article de blog.
Dois-je avoir accès à un microscope confocal pour réaliser une IF ?
L’IF peut être réalisée sur n’importe quel microscope à fluorescence avec une source d’excitation et un filtrage appropriés, y compris les microscopes confocaux à épifluorescence, à balayage et à disque rotatif. L’immunofluorescence est également généralement compatible avec les techniques de fluorescence spécialisées, y compris la fluorescence par réflexion interne totale (TIRF), la microscopie à feuille de lumière et certaines techniques de super-résolution.
Compatibilité avec le criblage automatisé à haut débit/analyse à haut contenu
Tout anticorps approuvé pour l’IF-IC peut être utilisé dans le criblage à haut débit (HCS) et l’analyse à haut contenu (HCA). Ces expériences sont basées sur des techniques d’IF standard, incorporant l’automatisation.
Vous rencontrez des problèmes avec votre expérience d’IF ? Cliquez ici pour un guide de dépannage.
Cell Signaling Technology, CST et XP sont des marques commerciales de Cell Signaling Technology, Inc. Toutes les autres marques sont la propriété de leurs propriétaires respectifs.