Introduzione
Le micosi profonde sono infezioni poco comuni causate da funghi; si dividono in micosi sottocutanee e sistemiche.1 Mentre le manifestazioni cutanee si verificano sempre nelle micosi sottocutanee, o micosi di impianto, come sono anche note, sono solo occasionalmente viste nelle micosi sistemiche. In questi casi, la pelle è colpita direttamente, dalla penetrazione del fungo nel derma, o indirettamente, da un’infezione che si è diffusa da un focus più profondo. Secondo Rezusta et al.,2 la maggior parte delle micosi sottocutanee e sistemiche in Spagna sono importate, con poche eccezioni (ad esempio, la mucormicosi). Mancano dati epidemiologici sulla prevalenza e l’incidenza delle micosi in Spagna.
Micosi sottocutanee
Le micosi sottocutanee comprendono diverse entità cliniche causate dall’invasione della pelle e del tessuto sottocutaneo da funghi saprofiti che vivono nel suolo e nella vegetazione. Tuttavia, anche se i tagli e le ferite sono molto comuni nelle persone che vivono nelle aree rurali, nel complesso, ci sono pochissimi casi di micosi sottocutanee.1
La tipica via di ingresso del fungo è l’inoculazione traumatica attraverso materiale contaminato come schegge, spine o altri oggetti taglienti, spiegando perché le micosi sottocutanee sono anche chiamate micosi da impianto.3
Anche se i funghi responsabili delle micosi sottocutanee sono tassonomicamente eterogenei, sono unificati dal fatto che condividono la stessa via di ingresso. Ognuna di queste infezioni può colpire persone che hanno viaggiato in zone endemiche, anche anni dopo il loro ritorno.
Le micosi sottocutanee più comuni sono la sporotricosi, la cromoblastomicosi e il micetoma.1 Altre entità meno comuni sono la lacaziosi, la feofomicosi, l’alofomicosi e la conidiobolomicosi.
La sporotricosi
La sporotricosi è un’infezione subacuta o cronica causata da funghi dimorfi, il più comune dei quali è Sporothrix schenckii.4,5 Questi funghi sono universali, sebbene siano più comuni nelle aree tropicali e subtropicali. L’incidenza stimata della sporotricosi in Sud America è tra i 48 e i 60 casi per 100000 abitanti all’anno.6,7 Solo pochi casi autoctoni sono stati riportati in Spagna e in altre parti d’Europa,8 e la maggior parte dei casi in queste aree sono importati.9
Gli agenti causali appartengono a un complesso di specie noto come S schenckii,10,11 che comprende Sporothrix brasiliensis, Sporothrix mexicana, Sporothrix luriei, Sporothrix pallida (precedentemente Sporothrix albicans), e Sporothrix schenckii sensu lato (sl.), che è il più comune dei cinque.12
Dopo un periodo di incubazione da 15 a 30 giorni, l’inoculazione traumatica da Sporothrix spp. provoca un’infezione cronica caratterizzata da lesioni nodulari nel tessuto cutaneo e sottocutaneo associate a linfangite nell’area colpita.
Sporothrix spp. vive nella vegetazione, nelle piante o nei detriti vegetali nel terreno, e quindi le infezioni sono più comuni nei lavoratori agricoli e nelle persone che lavorano in aree aperte. La sporotricosi è considerata una malattia professionale in guardie forestali, orticoltori, giardinieri e lavoratori agricoli in generale.4,13 Anche l’alcolismo e il diabete sono stati descritti come fattori di rischio. L’immunosoppressione, indipendentemente dalla causa, è anche un fattore predisponente per la malattia disseminata o sistemica.1 La malattia può anche essere acquisita attraverso la manipolazione del fungo in un ambiente di laboratorio. Infine, c’è stata un’interessante epidemia nel sud del Brasile in cui la sporotricosi è stata trasmessa all’uomo attraverso graffi di gatto, suggerendo che potrebbe essere un’infezione zoonotica.14 La maggior parte delle specie isolate in questi casi erano S brasiliensis.
Forme cliniche5
- 1)
Sporotricosi linfocutanea. Conosciuta anche come sporotricosi linfangitica, questa forma clinica rappresenta oltre il 75% di tutti i casi di sporotricosi.15 Le lesioni si presentano in aree esposte, come le mani, il viso e i piedi. La malattia inizia come un nodulo indolore viola o nerastro che si erode in una piccola ulcera (pancreas sporotricotico) con bordi gonfi, un centro granulomatoso doloroso e uno scarico minimo. Questo è seguito da una linfangite con noduli secondari lungo la linea di drenaggio linfatico che possono progredire in ulcere; questo modello caratteristico è noto come diffusione sporotrichoide (Fig. 1).6 La salute generale del paziente non è influenzata.15 Il decorso della malattia varia a seconda della risposta immunitaria dell’ospite, della virulenza del ceppo, della dimensione dell’inoculo e della profondità della lesione.
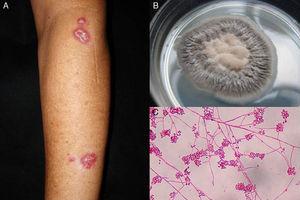 Figura 1.
Figura 1.A, Sporotricosi linfangitica. B, coltura di Sporothrix schenckii. C, esame microscopico della coltura su terreno Sabouraud dextrose agar (eritrosina 2%, ingrandimento originale ×40).
(0.21MB). - 2)
Sporotricosi fissa. Questa variante è caratterizzata dalla presenza di una lesione solitaria. L’infezione è limitata e si presenta generalmente come una placca verrucosa a crescita lenta e meno progressiva. La sporotricosi fissa non colpisce normalmente i vasi linfatici ed è più comune nelle aree endemiche.16
- 3)
Altre forme cliniche:
Sporotricosi osteoarticolare. Questa è una forma disseminata di sporotricosi che colpisce le ossa e le articolazioni; è la forma più comune di coinvolgimento sistemico.17
Sporotricosi polmonare primaria. Questa variante colpisce di preferenza i pazienti immunosoppressi e si acquisisce per inalazione. Imita la tubercolosi cavitaria.16
Sporotricosi polmonare metastatica. La forma metastatica della sporotricosi polmonare è rara ed è stata descritta solo in casi isolati. Si verifica in pazienti immunocompromessi, in particolare quelli con infezione da virus dell’immunodeficienza umana (HIV) in fase di AIDS.18
Invasione diffusa. La malattia disseminata è rara nella sporotricosi, sebbene il coinvolgimento meningeo e oculare sia stato descritto in pazienti immunosoppressi con diabete incontrollato o alcolismo cronico.
In Messico, come in altri paesi dell’America Latina (sede della più grande casistica e della più grande esperienza con la sporotricosi), la sporotricosi linfocutanea rappresenta dal 60% all’80% di tutti i casi di sporotricosi, la sporotricosi cutanea fissa dal 10% al 30%, e altre forme cliniche dall’1% al 2%.16
La sporotricosi deve essere distinta da tubercolosi, leishmania, tularemia, nocardiosi cutanea, infezioni micobatteriche non tubercolari, micetoma, cromoblastomicosi e lebbra lepromatosa. La diffusione sporotrichoide (linfangitica) può essere vista in molte di queste condizioni, che devono essere contemplate nella diagnosi differenziale.19
Diagnosi
-
Pus (aspirato dai noduli). L’esame microscopico diretto non ha valore nella sporotricosi, poiché le lesioni contengono pochissime forme di lievito. Sabouraud dextrose agar (SDA) e SDA con antibiotici (cloramfenicolo e cicloesimide) possono essere utilizzati per la coltura, che produce colonie di lievito che sono inizialmente bianche e poi diventano scure (Fig. 1). La crescita è caratteristicamente rapida (3-5 giorni)20 , ma sono necessarie 2 settimane per identificare il fungo e confermare la diagnosi.16 È possibile anche l’identificazione molecolare mediante analisi della reazione a catena della polimerasi (PCR).10,21
-
Istologia. L’esame istologico rivela una reazione granulomatosa mista aspecifica con microascessi neutrofili. Il fungo si presenta come una piccola forma di lievito a forma di sigaro a volte circondato da materiale eosinofilo caratteristico che si irradia conosciuto come un corpo asteroide. Mentre i corpi asteroidali possono aiutare la diagnosi, non sono patognomici,16,20 poiché si trovano anche intracellulari nella sarcoidosi, nella silicosi e nella lacaziosi (lobomicosi). I corpi asteroidi extracellulari, tuttavia, sono più caratteristici della sporotricosi. Diversi campioni possono essere necessari per visualizzare i microrganismi, anche se sono più facili da trovare in caso di malattia disseminata o viscerale.
Trattamento
La sporotricosi può risolversi spontaneamente in alcuni casi, come durante la gravidanza, anche se paradossalmente la diffusione è stata riportata anche in donne incinte.
-
Soluzione satura di ioduro di potassio. Il trattamento con ioduro di potassio, come soluzione satura, è iniziato a 5 gocce per pasto. Questa dose iniziale viene poi aumentata gradualmente a 20 o 30 gocce per pasto secondo i livelli di tolleranza. Il trattamento deve essere mantenuto per 3 o 4 settimane dopo la risoluzione delle manifestazioni cliniche. Il meccanismo d’azione è sconosciuto, anche se si pensa che lo ioduro di potassio agisca come immunostimolante. Gli effetti avversi includono un sapore metallico in bocca, rinite, espettorazione, orticaria, petecchie, rash bolloso o acneiforme, vasculite e induzione di ipotiroidismo o ipertiroidismo. Lo ioduro di potassio è controindicato durante la gravidanza.20,22
-
Itraconazolo 200mg/d per 3-6 mesi.22 Questo è il trattamento di prima linea raccomandato nella maggior parte delle linee guida di trattamento. Tende ad essere un po’ più costoso dello ioduro di potassio, ma ha meno effetti avversi.
-
Altre opzioni. Terbinafina 250-1000mg/d per 3-6 mesi23,24; fluconazolo 400mg/d per 3-6 mesi22; amfotericina B (desossicolato) 0.5-1mg/kg/d per la malattia sistemica o formulazioni liposomiali o lipidiche di amfotericina B alla dose di 3-5mg/kg/d22; calore locale o termoterapia per 2 o 3 mesi,22 o una combinazione dei trattamenti di cui sopra (ioduro di potassio con itraconazolo, itraconazolo con terbinafina, e terbinafina con ioduro di potassio).25 L’aggiunta della terapia fotodinamica con aminolevulinato di metile o meglio ancora del blu di metilene intralesionale 1% (combinato o meno con l’itraconazolo) ha prodotto buoni risultati in vitro e in 1 paziente.26
La chirurgia può avere un ruolo importante nella sporotricosi osteoarticolare.22 Lo sbrigliamento e l’artrodesi sono stati tradizionalmente considerati i trattamenti di scelta, ma anche la sostituzione protesica dell’articolazione seguita da un trattamento antifungino a lungo termine è stata descritta come un’opzione valida
1.1Cromoblastomicosi (cromomicosi)
La cromomicosi, nota anche come cromomicosi, è un’infezione fungina cronica polimorfa della pelle e del tessuto sottocutaneo. È causata da diverse specie di funghi melanizzati o dematiacei, che producono un pigmento scuro. Le forme parassitarie di questi funghi sono chiamate cellule fumagoidi o muriformi (corpi sclerotici).27-30
Le specie più comuni che causano la cromoblastomicosi sono Fonsecaea pedrosoi, Fonsecaea monophora, Cladophialophora carrionii, Phialophora verrucosa, e Rhinocladiella aquaspersa.5,27,28 La maggior parte dei pazienti ha una storia di una lesione traumatica che coinvolge legno o vegetazione, e oltre l’80% sono lavoratori rurali in Africa, Asia e Sud America che tendono a camminare a piedi nudi. I funghi responsabili della cromoblastomicosi sono stati trovati in tutto il mondo, anche se sono più comuni nei paesi tropicali e subtropicali.27
Forme cliniche
Il fungo generalmente penetra nella pelle attraverso una lesione cutanea, tipicamente situata sugli arti inferiori.31 Circa 1 o 2 mesi dopo, l’individuo infetto sviluppa una papula che progredisce in un nodulo verrucoso a crescita lenta (Fig. 2). L’infezione è limitata al tessuto sottocutaneo e non si diffonde ai muscoli o alle ossa, tranne nei pazienti immunocompromessi. Le singole lesioni possono sviluppare un aspetto spesso simile a un cavolfiore e la superinfezione batterica è comune. Possono verificarsi linfedema secondario, che può progredire in elefantiasi, e carcinoma a cellule squamose.27
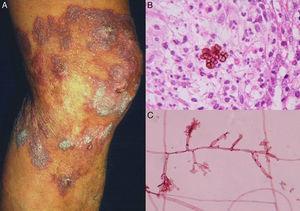
A, Cromoblastomicosi nodulare-verrucosa. B, biopsia che mostra cellule fumagoidi. C, esame diretto della coltura di Fonsecaea pedrosoi (biopsia; ematossilina-eosina ed eritrosina 2%, ingrandimento originale in entrambi i casi ×40).
Diagnosi
-
Esame diretto. L’esame diretto di croste e frammenti di pelle può rivelare forme parassitarie che si presentano isolate o che formano setti caratteristici (Fig. 2). Le strutture microscopiche osservate sono comuni a tutte le specie.27,28
-
Cultura. I funghi che causano la cromoblastomicosi crescono lentamente se coltivati su SDA con o senza antibiotici (cloramfenicolo e cicloesimide); producono colonie scure olivacee o nere con una superficie piatta vellutata e un centro in rilievo. La distinzione tra le specie è difficile e si basa sulle strutture riproduttive e sull’identificazione molecolare.30 Le tecniche di biologia molecolare (PCR), in particolare le regioni dello spaziatore interno trascritto (ITS) del DNA ribosomiale (rDNA), sono anche utili.32,33
-
Istologia. L’esame istologico mostra una caratteristica iperplasia pseudoepiteliomatosa nell’epidermide e un infiltrato infiammatorio granulomatoso misto con cellule giganti contenenti strutture fungine rotonde caratteristiche (Fig. 2) nel derma.27
Trattamento
La cromoblastomicosi è estremamente difficile da trattare ed è spesso refrattaria a diverse opzioni, compresi i trattamenti non farmacologici come il curettage, l’elettrocoagulazione e la criochirurgia.5 Gli antimicotici devono essere mantenuti per almeno 6 mesi, e mentre possono produrre un risultato clinico favorevole, le recidive durante o dopo la terapia sono comuni. Il trattamento dovrebbe essere terminato quando tutte le lesioni scompaiono.27
Altri trattamenti includono la resezione chirurgica di piccole lesioni; criochirurgia locale (in associazione con un antimicotico per prevenire la diffusione linfatica); itraconazolo 200-400mg/d da solo o combinato con 5-fluorocitosina 30mg/kg 4 volte al giorno per 6 mesi; terbinafina 250-500mg/d per 12 mesi, e in caso di coinvolgimento sistemico amfotericina B per via endovenosa alla dose di 1mg/kg o formulazioni liposomiali o lipidiche di amfotericina B alla dose di 3-5mg/kg/d.27
Micetoma
Il micetoma è un’infezione cronica locale causata da diverse specie di funghi e batteri. L’infezione è chiamata actinomicetoma quando è causata da batteri filamentosi aerobi e eumicetoma quando è causata da funghi.34 È caratterizzata dalla formazione di aggregati dei microrganismi causali negli ascessi. Questi aggregati sono conosciuti come grani o granuli. I granuli possono drenare attraverso i seni che si aprono sulla pelle o colpire le ossa adiacenti. La malattia avanza per diffusione diretta, con pochissimi casi di diffusione in siti lontani. Gli agenti causali si trovano generalmente nel terreno ed entrano nel corpo attraverso la pelle rotta. La maggior parte dei casi riguarda i lavoratori rurali.
Eziologia
-
Funghi. I funghi che causano l’eumicetoma producono granuli bianchi o scuri. Sono particolarmente comuni in Africa, India e Messico. I granuli scuri sono formati da Madurella mycetomatis, Trematosphaeria grisea, e Leptosphaeria senegalensis,35 mentre i granuli bianchi sono formati da Fusarium spp, Acremonium spp, e Aspergillus nidulans.
-
Batteri filamentosi o attinomiceti aerobi. I granuli formati da queste specie sono rossi (Actinomadura pelletieri), bianco-gialli (Actinomadura madurae, Nocardia brasiliensis e Nocardia spp.) o giallo-marroni (Streptomyces somaliensis). Gli attinomiceti si trovano in tutto il mondo, non solo nei paesi tropicali.36
Forme cliniche
Le caratteristiche cliniche del micetoma causato da funghi e attinomiceti sono molto simili. Le lesioni sono più comuni su piedi, stinchi e mani. La prima manifestazione clinica è un nodulo duro e indolore che si diffonde lentamente fino a produrre papule e seni che scaricano sulla superficie cutanea un fluido contenente granuli.35,36 Il sito originale dell’infezione è distorto dal gonfiore locale dei tessuti, dalla formazione di seni cronici e da un coinvolgimento osseo tardivo (Fig. 3). Le lesioni sono raramente dolorose, tranne negli stadi tardivi.
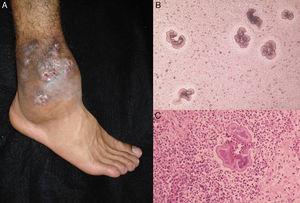
A, Actinomycetoma del piede. B, granuli di Nocardia sp. visti all’esame diretto (KOH, ingrandimento originale ×10). C, biopsia (ematossilina-eosina ×40).
Diagnosi
I granuli di micetoma (Fig. 3) sono un reperto diagnostico chiave e si trovano generalmente esaminando lo scarico dai seni o schiacciando una crosta presa da una lesione. L’esame microscopico mostrerà se questi granuli sono formati da piccoli attinomiceti o da filamenti micotici più ampi. L’identificazione definitiva richiede una coltura, che viene normalmente effettuata su SDA con o senza antibiotici (cloramfenicolo e cicloeximide); il solo cloramfenicolo è preferito nel caso di funghi ialini. Gli agenti possono anche essere identificati tramite test di biologia molecolare, in particolare analisi PCR utilizzando diversi marcatori37 a seconda degli agenti causali (ad esempio, regioni ITS dell’rDNA, β-tubulina,38 e D1/D2). L’analisi della sequenza parziale del gene dell’RNA ribosomiale, al contrario, può essere usata per identificare le specie Nocardia e Actinomadura.36 I risultati istologici sono simili in tutte le forme di micetoma e comprendono un centro infiammatorio ricco di cellule polimorfonucleate (veri ascessi), cellule epitelioidi, cellule giganti e fibrosi. I granuli si trovano al centro dell’infiammazione.35,39 Gli studi di imaging, pur essendo complementari, possono aiutare la diagnosi mostrando gonfiore dei tessuti molli, lesioni osteolitiche e ispessimento corticale.
La diagnosi differenziale dovrebbe includere osteomielite batterica, osteomielite tubercolare, hidradenitis suppurativa, sarcoma di Kaposi e tubercolosi cutanea, tra gli altri.35,39
Trattamento
Actinomicetoma. Il regime di trattamento con la più forte base di prove per il micetoma nocardiale è il trimetoprim-sulfametossazolo più diaminodifenilsulfone (dapsone) per 6 mesi a 2 anni. L’acido amoxicillina-clavulanico, somministrato per 6 mesi, può essere usato per i casi refrattari.40-42 Il trattamento di scelta per infezioni estese e/o coinvolgimento viscerale è l’amikacina combinata con trimetoprim-sulfametoxazol39 o meropenem.43,44 Ci sono stati rapporti isolati di esiti positivi con altri agenti in pazienti che non rispondono a questi trattamenti.36,39,45
Eumicetoma. A differenza dell’actinomicetoma, dove il trattamento farmacologico è associato a buoni risultati, il trattamento standard dell’eumicetoma è una combinazione di trattamento medico e chirurgia. Risultati accettabili sono stati riportati per l’uso di triazoli di ultima generazione, come itraconazolo e fluconazolo usati da soli o in combinazione con terbinafina. Questi farmaci vengono somministrati per un lungo periodo e solo dopo aver esaurito tutte le opzioni chirurgiche.35,45
Phaeohyphomycosis
La feofomicosi è un gruppo eterogeneo di micosi causate da funghi a parete scura (dematiacei).46,47 Questi funghi si trovano in tutti i climi, sebbene siano più comuni nei climi tropicali. C’è stato un recente aumento di casi tra i pazienti immunosoppressi con infezione da HIV o AIDS, i pazienti trapiantati e i pazienti diabetici, tra gli altri.46,48
Gli agenti causali più comuni sono Exophiala spp, Bipolaris spp., Curvularia spp., Pleurophomopsis spp., Phaeoacremonium spp, e Alternaria spp. I funghi si trovano principalmente nei detriti organici.
Forme cliniche
-
Faeoiomicosi sottocutanea. In seguito a un trauma locale o all’inoculazione di materiale estraneo, i pazienti sviluppano una lesione solitaria a crescita lenta (generalmente una cisti o un nodulo, o eventualmente una placca o un ascesso) normalmente localizzata sulle estremità (Fig. 4).48,49 La diagnosi differenziale dovrebbe includere lipomi, cisti epidermiche o sinoviali, fibromi, cisti da corpo estraneo e ascessi batterici.
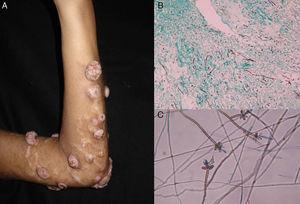 Figura 4.
Figura 4.A, Feofomicosi nodulare. B, Filamenti e lieviti nel campione bioptico (Grocott, ingrandimento originale ×10). C, esame microscopico di Veronaea botryosa (blu di cotone lattofenolo, ingrandimento originale ×40).
(0.22MB). -
Faeoiomicosi sistemica o diffusa. Anche se molto rara, la feofomicosi sistemica è molto grave nei pazienti immunosoppressi.50
Diagnosi
La microscopia a umido mostra ife scure settate diagnostiche che formano rami o catene (Fig. 4). La crescita è lenta (3-4 settimane) su SDA e le colonie acquisiscono un colore olivaceo o marrone scuro. L’analisi PCR di marcatori come la β-tubulina e le regioni ITS può essere usata per l’identificazione molecolare.51,52 La biopsia rivela una parete di cisti formata da macrofagi paleggianti con ife micotiche.49
Trattamento
Il trattamento delle infezioni causate da Exophiala spp. è controverso, e una opzione che è stata proposta è la resezione chirurgica.48 Non esistono inoltre protocolli standard per il trattamento delle infezioni da Alternaria.53 L’opzione migliore per la feofomicosi sembra essere una combinazione di terapia antifungina (itraconazolo, ketoconazolo o terbinafina) e chirurgia. I ceppi di Exophiala spp. tendono ad essere resistenti al fluconazolo. Le infezioni disseminate sono trattate con amfotericina B.48,49
Hyalohyphomycosis
Hyalohyphomycosis è causata da funghi ialini (Hyphomycetes) che formano ife settate nei tessuti.47 Questa classificazione, tuttavia, è piuttosto arbitraria poiché ci sono molti tipi di Hyphomycetes terrestri e acquatici. Solo alcuni organismi, tuttavia, possono causare infezioni, la maggior parte delle quali sono opportunistiche, nell’uomo.54,55 La maggior parte dei generi coinvolti nell’alofomicosi sono morfologicamente identici quando osservati in sezioni di tessuto e innescano la stessa risposta patologica. I funghi che causano frequentemente infezioni o che hanno un’altra caratteristica particolarmente distintiva sono assegnati a una categoria diversa (ad esempio, l’aspergillosi).
Gli agenti più comuni coinvolti nell’alofomicosi sono Aspergillus (fumigatus, niger, flavus), Scopulariopsis spp, Fusarium spp, Acremonium recifei, Paecilomyces spp, Purpureocillum spp, e Neoscytalidium spp.55 Sono tutte ampiamente distribuite in natura, e possono essere trovate in qualsiasi tipo di terreno, legno o materiale vegetale in decomposizione.56 Colpiscono individui di entrambi i sessi e a qualsiasi età, e l’immunosoppressione non è una condizione necessaria per l’infezione.
Forme cliniche
L’alofomicosi può essere classificata come superficiale, sottocutanea o sistemica.
-
Inalofomicosi superficiale. Le infezioni superficiali includono dermatomicosi e onicomicosi. Sono comuni nei lavoratori rurali, nei pescatori, nei pazienti con gravi ustioni e nei neonati prematuri.57,58
-
Italofomicosi sottocutanea. L’inoculazione traumatica causa ascessi, cisti e lesioni tumorali simili a quelle viste nel micetoma (Fig. 5).56
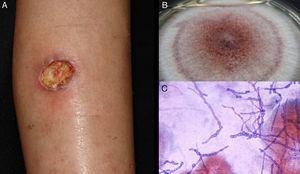 Figura 5.
Figura 5.Ulcera da alofomicosi dovuta a Acremonium sp. B, coltura (terreno Sabouraud dextrose agar). C, esame diretto dell’essudato (Giemsa, ingrandimento originale ×40).
(0.17MB). -
Ialofomicosi sistemica. Le infezioni sistemiche, sebbene poco comuni, sono molto gravi. Colpiscono i pazienti immunosoppressi e possono essere fatali. La diffusione ematogena e linfatica porta al coinvolgimento dei polmoni e del sistema nervoso centrale.55,57
Diagnosi
L’identificazione delle ife ialine settate attraverso l’esame microscopico di squame cutanee, frammenti di unghie, secrezioni o frammenti fornisce una diagnosi presunta, che viene poi confermata dalla coltura (Fig. 5). La maggior parte dei funghi cresce su SDA senza antibiotici o inibitori.47,59 Come nei casi descritti sopra, è possibile anche l’identificazione molecolare.60
La diagnosi differenziale dovrebbe includere altre dermatomicosi, cisti epidermiche, actinomicetoma, eumicetoma, istoplasmosi e criptococcosi.
Trattamento
In individui immunocompetenti, i trattamenti di scelta sono triazoli, terbinafina o chirurgia.61 Quando il sistema immunitario è compromesso, il trattamento di prima linea è l’amfotericina B combinata con un triazolo (itraconazolo 200mg/d per 6 mesi o fluconazolo 150mg due volte a settimana per 6 mesi).
Lacaziosis (Lobomycosis)
Lacaziosis, che era precedentemente conosciuta come lobomycosis, è un’infezione fungina granulomatosa cronica della pelle e dei tessuti sottocutanei descritta per la prima volta sotto il nome di blastomicosi cheloidea nel 1930 da Jorge Lobo a Recife, Brasile.62 È un’infezione rara che si trova nell’America centrale e meridionale; è causata da Lacazia loboi,62,63 un lievito che non può essere coltivato in coltura. Si pensa che la fonte dell’infezione sia nel suolo e nella vegetazione. Il fungo entra probabilmente attraverso la pelle a seguito di una ferita penetrante, come una puntura di spina o una puntura d’insetto.
La lacaziosi è caratterizzata da lesioni cheloidee con bordi lobulati ben definiti in aree esposte del corpo (frequentemente il viso, le braccia o le gambe). Le lesioni si diffondono in siti contigui, sebbene la trasmissione a siti distanti sia possibile anche tramite autoinoculazione.
Diagnosi
La diagnosi è facilitata dall’identificazione di abbondanti strutture fungine durante l’esame diretto e di catene di cellule rotonde diffuse collegate da piccole strutture tubolari in campioni bioptici.62 Gli agenti causali possono anche essere identificati nei tessuti attraverso l’analisi PCR, in particolare i saggi mirati al frammento 18S rDNA.64
La diagnosi differenziale dovrebbe includere cheloidi, lebbra lepromatosa e leishmania anergica.
Trattamento
Gli antimicotici non sono efficaci nella lacaziosi e il trattamento definitivo è la resezione chirurgica.62,63
Zigomicosi
La zigomicosi è un gruppo eterogeneo di infezioni fungine causate da Zigomiceti opportunisti degli ordini Mucorales (Rhizopus, Lichtheimia, Mucor, e Rhizomucor) e Entomophthorales (Basidiobolus e Conidiobolus).65 In questa sezione, parleremo solo dei funghi Entomophthorales, poiché i Mucorales sono trattati nella seconda parte di questa revisione, che esamina le micosi sistemiche.
L’entomoftoromicosi è caratterizzata dalla comparsa di una massa dura e progressiva che colpisce i tessuti sottocutanei. Esistono 2 varianti. La prima è causata da Basidiobolus ranarum ed è più comune nei bambini.66 Le lesioni appaiono generalmente nelle spalle e nelle cinture pelviche e si presentano come una cellulite legnosa che si diffonde lentamente. La seconda variante è causata da Conidiobolus coronatus e colpisce gli adulti. L’infezione primaria inizia nei turbinati inferiori del naso e poi si diffonde al centro del viso, causando gonfiori induriti dolorosi e gravi deformazioni di naso, labbra e guance.65-68
Conclusione
Abbiamo passato in rassegna le principali caratteristiche delle micosi sottocutanee e i principali metodi di diagnosi e trattamento disponibili (Tabella 1).
Sommario delle caratteristiche delle micosi sottocutanee.
| Micosi | Agente causale principale | Diagnosi | Trattamento |
|---|---|---|---|
| Sporotrichosis | Sporothrix schenckii | Coltivazione di pus aspirato da noduli; istologia; PCR | Soluzione satura di ioduro di potassio per 3 settimane; itraconazolo 200mg/d per 3-6 mesi; combinazioni |
| Cromoblastomicosi | Fonsecaea pedrosoi | Esame microscopico; cultura; istologia | Molto difficile. Itraconazolo 200mg/d per 6 mo; terbinafina per 12 mo; amfotericina B; combinazioni |
| Micetoma | Attinomiceti filamentosi e funghi filamentosi | Identificazione dei granuli di micetoma; coltura; istologia; PCR | Antibiotici per actinomicetoma; antifungini+chirurgia per eumicetoma |
| Phaeohyphomycosis | Exophiala jeanselmei Alternaria spp. |
Esame microscopico e coltura; istologia; PCR | Controverso. Chirurgia + combinazione di antifungini |
| Hyalohyphomycosis | Aspergillo (fumigatus, niger, flavus), Fusarium spp, Paecilomyces, ecc. | Esame microscopico e coltura; PCR | Pazienti immunocompetenti: triazoli; terbinafina; ciclopirox olamina; chirurgia Pazienti immunosoppressi: amfotericina B combinata con un triazolo per 6 mo |
| Lacaziosi (lobomicosi) | Lacazia loboi | Esame microscopico; istologia; PCR | Chirurgia |
| Entomoftoromicosi | Conidiobolus coronatus Basidiobolus ranarum |
Esame diretto e cultura | Chirurgia e antifungini sistemici |
Abbreviazione: PCR, reazione a catena della polimerasi.
Conflitti di interesse
Gli autori dichiarano di non avere conflitti di interesse.