Introduzione
I pazienti ricoverati in unità di terapia intensiva (ICU) richiedono spesso la somministrazione per via endovenosa di diversi farmaci. I farmaci vasodilatatori, analgesici e sedativi sono tra i gruppi terapeutici più utilizzati e vengono solitamente somministrati in infusione continua.
Secondo la revisione sistematica condotta da Moyen et al. vi è una media di 1,7 errori/giorno associati al processo di somministrazione dei farmaci in terapia intensiva.1 D’altra parte, i dati riportati da Merino et al. in uno studio condotto tra le unità di terapia intensiva degli ospedali spagnoli sono un po’ migliori (1,13 errori di medicazione ogni 100 pazienti/giorno).2 Anche così, gli errori di medicazione sono comuni nelle unità di terapia intensiva e richiedono attenzione da parte degli operatori sanitari per minimizzarli.
Gli errori nella somministrazione di farmaci in terapia intensiva sono dovuti a diversi fattori: l’uso di farmaci ad alto rischio (farmaci vasoattivi, inotropi, sedativi, ecc.) spesso somministrati in basse dosi a causa della loro elevata forza farmacologica, che richiede una diluizione e una valutazione preliminare alla loro somministrazione. Un altro fattore è la prescrizione di dosi in diverse unità di misura o l’elevato numero di farmaci utilizzati con ogni paziente. Sebbene sia un progresso importante per quanto riguarda la sicurezza, l’uso di pompe di infusione intelligenti è stato associato a un numero importante di errori di medicazione dovuti a problemi di programmazione.3
La combinazione di questi fattori di rischio aumenta le possibilità di commettere errori nei pazienti più vulnerabili a causa della loro gravità. I pazienti critici hanno spesso accessi venosi limitati. Ciò significa che diversi farmaci vengono somministrati utilizzando la stessa via di somministrazione, il che aumenta i rischi legati alla miscelazione di farmaci incompatibili. La miscela di farmaci incompatibili è un errore di medicazione che può avere gravi conseguenze per il paziente come fallimenti terapeutici, micro-embolia o tossicità.4
L’infusione sul sito Y di 2 farmaci richiede che entrambi i farmaci siano fisicamente compatibili.5 Questa co-somministrazione avviene quando si mescolano i farmaci in un rapporto 1:1 e in assenza di segni visibili di incompatibilità come precipitazione o cambiamento di colore. D’altra parte, per la co-somministrazione sicura di 2 farmaci nello stesso diluente, la miscela deve essere chimicamente stabile. Questo significa che è necessaria una conferma preventiva che non si sono verificati cambiamenti significativi nella concentrazione di uno dei due farmaci presenti nella miscela.6
La standardizzazione della concentrazione delle soluzioni di infusione è una delle misure più utili per prevenire gli errori di medicazione in terapia intensiva, soprattutto per i farmaci ad alto rischio a causa del loro potenziale di causare danni gravi e perché hanno la più alta incidenza di errori di medicazione.
Un’altra misura altamente raccomandata per la somministrazione sicura dei farmaci è avere informazioni affidabili disponibili sulla compatibilità dei farmaci quando si somministrano farmaci comuni in pazienti critici. Tuttavia, le informazioni sulla compatibilità dei farmaci sono scarse e, in molte occasioni, difficili da interpretare a causa delle diverse concentrazioni utilizzate, della mancanza di informazioni sulle tecniche di valutazione utilizzate o della sospetta qualità tecnica delle fonti. La mancanza di informazioni sul mix sicuro di 2 farmaci crea problemi nel lavoro quotidiano dei team infermieristici dell’ICU. Oltre al rischio di complicazioni associate alla somministrazione di 2 molecole incompatibili, questa mancanza di informazioni può costringere l’infermiere a cercare nuovi accessi venosi per somministrare i farmaci separatamente, il che aumenta il rischio di complicazioni infettive o tromboemboliche.
L’obiettivo di questa revisione è di raccogliere le informazioni pubblicate sulla compatibilità fisica e chimica dei farmaci più comunemente usati in un’unità di terapia intensiva quando vengono infusi attraverso la stessa linea attraverso un sito Y. Inoltre, valutare la qualità delle informazioni pubblicate e generare una tabella di compatibilità con informazioni affidabili e aggiornate per migliorare la sicurezza nella somministrazione di farmaci a pazienti critici.
MetodologiaStrategia di ricerca
È stata condotta una ricerca sistematica su Medline, Stabilis, Handbook on Injectable Drugs e Micromedex per identificare articoli originali, articoli di revisione e meta-analisi sulla compatibilità fisica e chimica dei farmaci. A causa del loro approccio clinico e della mancanza di metodologia per determinare la stabilità fisica e chimica, i casi di studio sono stati scartati. Le revisioni pubblicate da Kanji et al. e López-Cabezas et al.5,7 sono state utilizzate come punto di riferimento. La ricerca si è concentrata sulle combinazioni di farmaci su cui questi autori non avevano informazioni o non avevano cercato informazioni. Gli anni di pubblicazione degli studi andavano dal 1990 al dicembre 2017 e le lingue incluse erano inglese, spagnolo e francese. La strategia di ricerca consisteva nell’utilizzare più termini che descrivono le informazioni di interesse per combinarli con l’operatore booleano “OR” seguito da una ricerca raffinata utilizzando l’operatore “AND”. I termini utilizzati erano compatibilità fisica, stabilità del farmaco, y-site, y-injection, farmaco endovenoso, più i nomi e i sinonimi dei farmaci di interesse.
I farmaci utilizzati nella revisione sono usati di routine nel setting ICU e sono spesso somministrati per infusione continua. Le concentrazioni usate come riferimento sono quelle standardizzate nel nostro centro7 per questi farmaci e sono coerenti con quelle comunemente usate nella maggior parte delle unità di terapia intensiva (tabella 1). Tutte le informazioni sulla compatibilità trovate per una certa molecola su un diverso intervallo di concentrazione sono riportate nella tabella 2. Il processo di ricerca di riferimento per ogni farmaco è stato condotto contemporaneamente da 2 ricercatori indipendenti.
Droghe di studio e concentrazioni utilizzate come riferimento per la ricerca bibliografica.
| Farmaco | Concentrazione standard | Farmaco | Concentrazione standard |
|---|---|---|---|
| Adrenalina | 40mcg/mL | Isoproterenolo | 4mcg/mL |
| Amiodarone | 3.6mg/mL | Ketamina | 50mg/mL |
| Argatroban | 1mg/mL | Labetalolo | 2mg/mL |
| Bicarbonato | 1mmol/L | Magnesio solfato di magnesio | 15mg/mL |
| Cloruro di calcio | 10mg/mL | Meropenem | 30mg/mL |
| Calcio gluconato | 10mg/mL | Metadone | 0.2mg/mL |
| Ceftazidime | 24mg/mL | Midazolam | 4mg/mL |
| Cisatracurium | 2mg/mL | Milrinone | 0.2mg/mL |
| Clonidina | 7.5mcg/mL | N-acetilcisteina | 50mg/mL |
| Cloruro di morfina | 1mg/mL | Naloxone | 8mcg/mL |
| Dexmedetomidina | 4mcg/mL | Nitroglicerina | 0.2mg/mL |
| Diltiazem | 1mg/mL | Nitroprussiato | 0.2mg/mL |
| Dobutamina | 8mg/mL | Noradrenalina | 0.32mg/mL |
| Dopamina | 8mg/mL | Pantoprazolo | 0.32mg/mL |
| Esomeprazolo | 0.32mg/mL | Piperacillina-tazobactam | 64mg/mL |
| Fenilefrina | 0.2mg/mL | Cloruro di potassio | 120mEq/L |
| Fentanyl | 30mcg/mL | Propofol | 10mg/mL |
| Flumazenil | 40mcg/mL | Remifentanil | 20mcg/mL |
| Furosemide | 2mg/mL | Somatostatina | 24mcg/mL |
| Eparina sodica | 50IU/mL | Vecuronio | 0.2mg/mL |
| Insulina | 1IU/mL | Verapamil | 0.1mg/mL |
Combinazioni di farmaci fisicamente e chimicamente compatibili con concentrazioni inferiori al segno di riferimento.
| Farmaco#1 | Concentrazione massima compatibile | Farmaco#2 | Concentrazione massima compatibile |
|---|---|---|---|
| Adrenalina | 32mcg/mL | Pantoprazolo | 0.8mg/mL |
| 2mcg/mL | Verapamil | 0.08mg/mL | |
| Amiodarone | 4mg/mL | Fenilefrina | 0.04mg/mL |
| 6mg/mL | Furosemide | 1mg/mL | |
| 15mg/mL | Nitroprusside | 0.3mg/mL | |
| Cloruro di calcio | 4mg/mL | Dobutamina | 4mg/mL |
| Gluconato di calcio | 4mg/mL | Dobutamina | 4mg/mL |
| Ceftazidime | 120mg/mL | Dobutamina | 1mg/mL |
| 120mg/mL | Dopamina | 0.4mg/mL | |
| 125mg/mL | Ketamina | 10mg/mL | |
| Dobutamina | 1mg/mL | Eparina | 50IU/mL |
| 4mg/mL | Solfato di magnesio | 40mg/mL | |
| 4mg/mL | Cloruro di potassio | 60mEq/L | |
| Dopamina | 3.2mg/mL | Midazolam | 2mg/mL |
| Fentanyl | 12.5mcg/mL | Remifentanil | 0.25mg/mL |
| Eparina | 20IU/mL | Verapamil | 0.08mg/mL |
| Isoproterenolo | 4mcg/mL | Solfato di magnesio | 1mg/mL |
| 200mcg/mL | Cloruro di potassio | 40mEq/L | |
| 4mcg/mL | Vecuronio | 0.1mg/mL | |
| 10mcg/mL | Verapamil | 0.08mg/mL | |
| Meropenem | 22mg/mL | Cloruro di potassio | 40mEq/L |
| Naloxone | 0.8mcg/mL | Verapamil | 0.08mg/mL |
| Nitroglicerina | 0.1mg/mL | Verapamil | 0.08mg/mL |
| Nitroprussiato | 0.2mg/mL | Vecuronio | 0.1mg/mL |
| 0,1mg/mL | Verapamil | 0,08mg/mL | |
| Noradrenalina | 0,008mg/mL | Verapamil | 0.08mg/mL |
| Piperacillina-tazobactam | 40mg/mL | Dexmedetomidine | 4mcg/mL |
| 40mg/mL | Remifentanil | 250mcg/mL | |
| Cloro di potassio cloruro | 100mEq/L | Remifentanil | 250mcg/mL |
È coerente con le caselle grigie indicate come I/C come mostrato in Fig. 2.
Selezione degli studi
Dopo la ricerca di riferimento, 2 revisori indipendenti hanno valutato la qualità degli studi utilizzando un processo di revisione tra pari. Questa revisione è stata condotta seguendo i criteri di qualità basati sull’opinione di esperti e seguendo le linee guida della pratica clinica8-11:
-
Riproducibilità dello studio: descrizione del principio attivo e del diluente, condizioni di studio e metodologia.
-
Numero di test eseguiti (almeno in triplicato).
-
Tempi trascorsi durante il prelievo dei campioni nell’analisi di stabilità: si raccomanda un periodo di tempo di 5 campioni, compreso un tempo di campionamento di 0,
-
Studi condotti per valutare la stabilità della miscela: (a) trasparenza: per le particelle visibili, osservazione con un pannello nero opaco, conteggio automatico delle particelle o turbidimetria; per le particelle subvisibili, uso di microscopia ottica, spettrofotometria o turbidimetria; (b) cambiamento di colore: ispezione visiva o spettrofotometria; (c) formazione di gas: ispezione visiva; (d) pH; e (e) stabilità chimica: misurazione della variazione della concentrazione dei 2 farmaci.
Creazione del grafico dei risultati
È stato creato un grafico con tutte le possibili combinazioni dei farmaci di interesse. Le caselle sono state nominate con una “C” se la miscela era compatibile, con una “I” se incompatibile e con “I/C” se la stabilità dipendeva da condizioni speciali. Le combinazioni di farmaci senza dati di compatibilità sono state lasciate deselezionate.
RisultatiPerformance della ricerca di riferimento
Sono stati identificati un totale di 48 articoli. La Fig. 1 mostra il processo di selezione. Dei 29 articoli inclusi nella revisione, 4 erano scritti in spagnolo, 3 in francese e 22 in inglese. Per quanto riguarda le date di pubblicazione, 8 articoli sono stati pubblicati tra il 1990 e il 1999, 10 tra il 2000 e il 2009, e i restanti 11 articoli sono stati pubblicati tra il 2010 e il 2017.
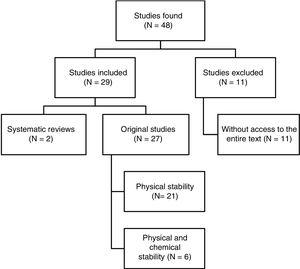
Riassunto strutturato dei risultati della ricerca di riferimento.
Qualità degli studi trovati
Nessuno degli studi ha soddisfatto tutti i criteri di qualità stabiliti in questa revisione. Tuttavia, il 93% degli articoli ha descritto le condizioni e la metodologia dello studio con sufficiente dettaglio per garantire la sua riproducibilità.
I test sono stati eseguiti in triplicato solo nel 26% dei casi. Al contrario, l’81% degli studi ha seguito la raccomandazione di prelevare i campioni al tempo 0, anche se solo 10 hanno ottenuto un campione in 5 tempi diversi.
Per quanto riguarda le prove condotte per valutare la stabilità dei campioni, tutti gli studi hanno valutato la trasparenza mentre il 93% degli studi ha segnalato un cambiamento di colore tramite ispezione visiva. Altri metodi sono stati utilizzati in 16 studi (59%) per vedere le particelle subvisibili. Il 67% degli studi ha valutato la formazione di gas e solo 12 hanno misurato i cambiamenti di pH nel tempo. Solo 6 studi hanno valutato la stabilità chimica delle miscele essendo la cromatografia liquida ad alta risoluzione il metodo usato in 5 studi per misurare la concentrazione dei principi attivi della miscela.
I risultati su questa sezione sono riassunti nella tabella 3.
Sommario dei criteri di qualità dei lavori pubblicati.
| Indicatore di qualità | Numero di studi (%) | |
|---|---|---|
| Valutazione della formazione di precipitato | 27 (100) | 12,13,16-40 |
| Valutazione del cambiamento di colore | 25 (93) | 12,13,16-27,30-40 |
| Misurazione della variazione del pH | 12 (44) | 12,13,16,18,19,22,26,27,29,38,39 |
| Valutazione della formazione di gas | 18 (67) | 12,13,17,19-21,24-26,31,33-40 |
| Analisi eseguita in triplicato | 7 (26) | 18,21,22,29,34,35,38 |
| Descrizione della metodologia utilizzata (include numero e frequenza delle osservazioni e condizioni di studio) | 24 (89) | 12,13,17-24,26-33,35-40 |
| Descrizione dei diluenti di tutti i farmaci dello studio | 21 (78) | 13,17-29,33,35-40 |
| Descrizione del materiale dei destinatari dello studio | 22 (81) | 12,13,17-31,33,36-39 |
| Stabilità chimica | 6 (22) | 16,18,19,22,29,38 |
Risultati della compatibilità fisica e chimica
Sono stati selezionati quarantaquattro farmaci usati in perfusione continua in terapia intensiva, compresa una soluzione per nutrizione parenterale con e senza lipidi e 3 antibiotici beta-lattamici. La compatibilità di questi è mostrata nella Fig. 2. I dati ottenuti dalle revisioni condotte da Kanji et al. e López-Cabezas et al. hanno fornito informazioni di compatibilità su 393 delle 945 combinazioni possibili.5,7 Dopo aver completato la revisione sistematica, sono stati aggiunti nuovi dati di stabilità per 82 combinazioni di farmaci. I nuovi risultati hanno rivelato 29 combinazioni compatibili, 27 combinazioni incompatibili e 26 combinazioni compatibili in condizioni specifiche. Pertanto, la tabella finale mostra i dati di compatibilità di 475 su 945 possibili combinazioni di 2 farmaci (50,3%). Di queste, 366 sono compatibili (77,1%), 80 sono incompatibili (16,8%), e 29 sono compatibili in condizioni specifiche (6,1%) come mostrato nella tabella 2.

Sommario delle compatibilità fisiche e chimiche. C, compatibile; I, incompatibile; I/C, compatibile in condizioni speciali. Le caselle tratteggiate mostrano che la miscela è compatibile solo con il siero glicosilato. Le caselle con linee diagonali mostrano la compatibilità solo con il siero fisiologico.
Discussione
Assicurarsi che l’uso dei farmaci sia sicuro è uno dei principali impegni presi dagli operatori sanitari con i loro pazienti. In terapia intensiva e data l’enorme quantità di farmaci somministrati per via endovenosa e il numero limitato di vie di somministrazione dei pazienti, questa sicurezza è talvolta compromessa a causa dei rischi connessi alla co-somministrazione di farmaci incompatibili in pazienti particolarmente vulnerabili.
I database online come Stabilis 4.0 sono molto utili per cercare informazioni sulla compatibilità dei farmaci. Tuttavia, il personale che somministra i farmaci trova i grafici molto più utili perché possono guardare rapidamente le informazioni di cui hanno bisogno in un dato momento. Questo è particolarmente interessante in situazioni urgenti quando qualsiasi ritardo causato dal personale sanitario può avere conseguenze sul paziente.
Questa revisione si è concentrata sull’analisi della compatibilità fisica e chimica dei farmaci per via endovenosa più comunemente usati attraverso l’infusione Y-site nell’impostazione ICU e riassumendo le informazioni ottenute in una tabella a doppia entrata. Gli studi di compatibilità fisica sono i più comuni di tutti perché sono facili da condurre. Gli studi di stabilità chimica, invece, non lo sono perché richiedono tecniche analitiche più sofisticate per determinare la concentrazione iniziale e finale dei farmaci.
Nonostante ciò, il numero di combinazioni di farmaci studiate è ancora insufficiente. Come mostra la Fig. 2, non siamo riusciti a trovare alcuna informazione sulla compatibilità fisica e chimica di tutte le combinazioni suggerite; per esempio, nel caso del flumazenil e del piperacillin-tazobactam abbiamo potuto determinare la stabilità solo con 4 farmaci e in entrambi i casi le 39 combinazioni rimanenti sono rimaste senza informazioni.
Anche se prendessimo in considerazione tutte le possibili combinazioni suggerite e aggiungessimo i nuovi dati trovati, avremmo ancora zero informazioni sulla compatibilità fisica e chimica di 470 combinazioni. Questo significa che abbiamo dati disponibili solo per il 50,3% di tutte le possibili combinazioni suggerite.
Le combinazioni più problematiche per quanto riguarda l’incompatibilità sono farmaci la cui stabilità è strettamente legata all’intervallo di pH; questo è il caso del bicarbonato di sodio, della furosemide o del pantoprazolo. La furosemide, per esempio, richiede un pH basico per garantire la stabilità della molecola in soluzione, motivo per cui la miscela con farmaci acidi (pH
4) causa torbidità e precipitazione.12
La presenza di adiuvanti nella formulazione farmaceutica, la concentrazione e l’esposizione a temperature estreme o la luminosità sono altri fattori associati all’incompatibilità dei farmaci.13 Ci sono momenti in cui una data combinazione di farmaci può essere stabile in un certo diluente e incompatibile in un altro; per esempio, la dopamina è compatibile con l’amiodarone solo quando entrambi sono dissolti in siero glicosilato al 5% perché quest’ultimo è instabile in soluzioni saline allo 0,9%. Così, se questa presunta miscela compatibile viene eseguita in siero fisiologico, può verificarsi una perdita di concentrazione di amiodarone con il corrispondente rischio di mancanza di risposta terapeutica.
D’altra parte, in molti casi, la qualità degli studi pubblicati finora può essere migliore. Sarebbe bene avere una maggiore uniformità negli standard di qualità di questo tipo di studi. Per esempio, anche se il pH è un fattore critico nella stabilità dei farmaci in soluzione, è stato verificato solo in 12 dei 27 lavori. Allo stesso modo, la turbidimetria o la microscopia – tecniche più accurate dell’osservazione visiva per il rilevamento di particelle e cambiamenti di colore – sono sottoutilizzate. Negli ultimi anni, diversi esperti hanno pubblicato delle linee guida per la progettazione degli studi di stabilità dei farmaci.8-11 Possiamo solo sperare che questo migliorerà la qualità complessiva di questo tipo di studi in futuro.
Autori precedenti hanno pubblicato delle revisioni di queste caratteristiche. Per esempio, Flamein et al.14 hanno studiato questo problema nelle ICU neonatali; Knudsen et al.15 hanno fatto luce sulla compatibilità di analgesici e sedativi. La nostra revisione si basa sul precedente lavoro fatto da Kanji et al.5 in Canada e López-Cabezas.7 in Spagna. È stata completata con le nuove informazioni disponibili sui farmaci nel nostro ambiente e con i dati sulle concentrazioni di farmaci più utilizzate.
In totale, abbiamo trovato informazioni su 82 nuove combinazioni di farmaci da 27 riferimenti diversi, comprese le combinazioni di 3 antibiotici beta-lattamici (ceftazidime, meropenem e piperacillina-tazobactam) ampiamente utilizzati in terapia intensiva. Negli ultimi anni sono stati confermati i vantaggi farmacocinetici di una via di somministrazione per perfusione prolungata di questi 3 antibiotici.16-19
Perfusioni a concentrazioni di farmaco che superano quelle abituali sono spesso utilizzate nel paziente malato critico. In questo senso, non abbiamo potuto trovare dati su tutte le combinazioni di farmaci per quanto riguarda le alte concentrazioni utilizzate in terapia intensiva (Tabella 1); tuttavia, in alcuni casi, abbiamo ottenuto informazioni su concentrazioni inferiori a quelle riportate in questa revisione. Questi casi sono mostrati sul grafico di compatibilità (Fig. 2) come compatibilità condizionata (I/C), cioè che la combinazione era stata studiata ad una concentrazione diversa da quella standard.
I dati di stabilità riportati in questa revisione non possono essere generalizzati ad altre combinazioni di farmaci o concentrazioni diverse da quelle descritte. Inoltre, le informazioni fornite si riferiscono a 2 combinazioni di farmaci, e le incompatibilità possono essere presenti con>2 combinazioni di farmaci alla volta, il che è altamente sconsigliabile. Ciononostante, i farmaci e le concentrazioni selezionate sono i più usati nelle unità di terapia intensiva per adulti della maggior parte degli ospedali.
Fino a quando non avremo nuovi e migliori studi di compatibilità che facciano luce su questo problema, questa revisione può essere un aggiornamento di facile lettura sulle prove disponibili sulla compatibilità dei farmaci più comunemente usati in terapia intensiva. Il suo obiettivo è quello di contribuire alla somministrazione sicura di farmaci a pazienti che possono affrontare le conseguenze di maggiore gravità a causa della loro fragilità.
Contributo degli autori
Genís Castells Lao: disegno e idea dello studio, data mining, analisi e interpretazione dei dati; bozza della carta o revisione critica del materiale intellettuale; e approvazione finale di questa versione.
Montse Rodríguez Reyes: disegno e idea dello studio, estrazione dei dati, analisi e interpretazione dei dati; bozza della carta o revisione critica del materiale intellettuale; e approvazione finale di questa versione.
Judit Roura Turet: estrazione dei dati, analisi e interpretazione dei dati; bozza della carta o revisione critica del materiale intellettuale; e approvazione finale di questa versione.
Marta Prat Dot: estrazione dei dati, analisi e interpretazione dei dati; bozza della carta o revisione critica del materiale intellettuale; e approvazione finale di questa versione.
Dolors Soy Muner: disegno e idea dello studio; bozza della carta o revisione critica del materiale intellettuale; e approvazione finale di questa versione.
Carmen López Cabezas: disegno e idea dello studio, data mining, analisi e interpretazione dei dati; bozza della carta o revisione critica del materiale intellettuale; e approvazione finale di questa versione.
Conflitti di interesse
Gli autori non hanno dichiarato alcun conflitto di interesse.