Rilascio di ormoniModifica
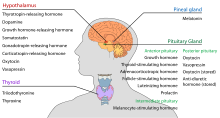
L’ipotalamo ha una funzione neuroendocrina centrale, in particolare attraverso il suo controllo della pituitaria anteriore, che a sua volta regola varie ghiandole e organi endocrini. Gli ormoni rilascianti (chiamati anche fattori di rilascio) sono prodotti nei nuclei ipotalamici e poi trasportati lungo gli assoni all’eminenza mediana o all’ipofisi posteriore, dove sono immagazzinati e rilasciati secondo necessità.
Ipofisi anteriore
Nell’asse ipotalamo-adenoipofisario, gli ormoni rilascianti, noti anche come ormoni ipofisiotici o ipotalamici, sono rilasciati dall’eminenza mediana, un prolungamento dell’ipotalamo, nel sistema portale ipofisario, che li trasporta all’ipofisi anteriore dove esercitano le loro funzioni di regolazione sulla secrezione di ormoni adenoipofisari. Questi ormoni ipofisiotici sono stimolati da cellule neurosecretrici parvocellulari situate nell’area periventricolare dell’ipotalamo. Dopo il loro rilascio nei capillari del terzo ventricolo, gli ormoni ipofisiotropici viaggiano attraverso la cosiddetta circolazione portale ipotalamo-ipofisaria. Una volta raggiunta la loro destinazione nell’ipofisi anteriore, questi ormoni si legano a recettori specifici situati sulla superficie delle cellule ipofisarie. A seconda di quali cellule vengono attivate attraverso questo legame, l’ipofisi inizierà a secernere o smetterà di secernere ormoni nel resto del sangue.
| Ormone secreto | Abbreviazione | Prodotto da | Effetto |
|---|---|---|---|
| Ormone di rilascio della tirotropina (Ormone di rilascio della prolattina) |
TRH, TRF, o PRH | Cellule neurosecretrici parvocellulari del nucleo paraventricolare | Stimolano il rilascio di ormone stimolante la tiroide (TSH) dall’ipofisi anteriore (principalmente) Stimolano il rilascio di prolattina dall’ipofisi anteriore |
| Ormone di rilascio della corticotropinareleasing hormone | CRH o CRF | Cellule neurosecretrici paraventricolari del nucleo paraventricolare | Stimolano il rilascio dell’ormone adrenocorticotropo (ACTH) dall’ipofisi anteriore |
| Dopamina (ormone inibitore della prolattina |
DA o PIH | Neuroni di dopamina del nucleo arcuato | Inibiscono il rilascio di prolattina dall’ipofisi anteriore |
| Ormone della crescitaormone di rilascio dell’ormone della crescita | GHRH | Neuroni neuroendocrini del nucleo arcuato | Stimolano il rilascio dell’ormone della(GH) dall’ipofisi anteriore |
| Ormone di rilascio delle gonadotropine | GnRH o LHRH | Cellule neuroendocrine dell’area preottica | Stimolano l’ormone follicolo(FSH) dall’ipofisi anteriore Stimolare il rilascio dell’ormone luteinizzante (LH) dall’ipofisi anteriore |
| Somatostatina (ormone inibitore della crescita) |
SS, GHIH, o SRIF | Cellule neuroendocrine del nucleo periventricolare | Inibiscono il rilascio dell’ormone della crescita (GH) dall’ipofisi anteriore Inibiscono (moderatamente) il rilascio dell’ormone stimolante la tiroide (TSH) dall’ipofisi anteriore |
Altri ormoni secreti dall’eminenza mediana includono vasopressina, ossitocina e neurotensina.
Ipofisi posteriore
Nell’asse ipotalamo-neuroipofisario, gli ormoni neuroipofisari sono rilasciati dall’ipofisi posteriore, che è in realtà un prolungamento dell’ipotalamo, nella circolazione.
| Ormone secreto | Abbreviazione | Prodotto da | Effetto |
|---|---|---|---|
| Ossitocina | OXY o OXT | Cellule neurosecretrici magnocellulari del nucleo paraventricolare e sovraottico nucleo | Contrazione uterina Allattamento (riflesso di discesa) |
| Vasopressina (ormone antidiuretico) |
ADH o AVP | Celle neurosecretrici magnocellulari e parvocellulari del nucleo paraventricolare, cellule magnocellulari del nucleo sopraottico | Aumento della permeabilità all’acqua delle cellule del tubulo distale e del dotto collettore nel rene e quindi permette il riassorbimento dell’acqua e l’escrezione di urina concentrata |
È anche noto che gli ormoni dell’asse ipotalamo-ipofisi-surrene (HPA) sono legati a certe malattie della pelle e all’omeostasi della pelle. Ci sono prove che collegano l’iperattività degli ormoni HPA alle malattie della pelle legate allo stress e ai tumori della pelle.
StimolazioneModifica
L’ipotalamo coordina molti ritmi circadiani ormonali e comportamentali, modelli complessi di uscite neuroendocrine, meccanismi omeostatici complessi e comportamenti importanti. L’ipotalamo deve quindi rispondere a molti segnali diversi, alcuni dei quali sono generati esternamente e altri internamente. La segnalazione dell’onda delta che nasce nel talamo o nella corteccia influenza la secrezione di ormoni rilascianti; GHRH e prolattina sono stimolati mentre TRH è inibito.
L’ipotalamo risponde a:
- La luce: lunghezza del giorno e fotoperiodo per regolare i ritmi circadiani e stagionali
- Stimoli olfattivi, compresi i feromoni
- Steroidi, compresi gli steroidi gonadici e i corticosteroidi
- Informazioni trasmesse per via nervosa provenienti in particolare dal cuore, dal sistema nervoso enterico (del tratto gastrointestinale) e dal tratto riproduttivo.
- Input autonomici
- Stimoli ematici, tra cui leptina, grelina, angiotensina, insulina, ormoni ipofisari, citochine, concentrazioni plasmatiche di glucosio e osmolarità ecc.
- Stress
- Microorganismi invasori aumentano la temperatura corporea, resettando il termostato del corpo verso l’alto.
Stimoli olfattiviModifica
Gli stimoli olfattivi sono importanti per la riproduzione sessuale e la funzione neuroendocrina in molte specie. Per esempio, se un topo incinta è esposto all’urina di un maschio “strano” durante un periodo critico dopo il coito, la gravidanza fallisce (effetto Bruce). Così, durante il coito, un topo femmina forma una precisa “memoria olfattiva” del suo partner che persiste per diversi giorni. Gli spunti feromonali aiutano la sincronizzazione dell’estro in molte specie; nelle donne, le mestruazioni sincronizzate possono anche derivare da spunti feromonali, anche se il ruolo dei feromoni negli esseri umani è discusso.
Stimoli trasportati dal sangueModifica
Gli ormoni peptidici hanno importanti influenze sull’ipotalamo, e per farlo devono passare attraverso la barriera emato-encefalica. L’ipotalamo è delimitato in parte da regioni cerebrali specializzate che mancano di un’efficace barriera emato-encefalica; l’endotelio capillare in questi siti è fenestrato per consentire il libero passaggio anche di grandi proteine e altre molecole. Alcuni di questi siti sono i siti di neurosecrezione – la neuroipofisi e l’eminenza mediana. Tuttavia, altri sono siti in cui il cervello campiona la composizione del sangue. Due di questi siti, l’OFS (organo subfornico) e l’OVLT (organum vasculosum della lamina terminalis) sono i cosiddetti organi circumventricolari, dove i neuroni sono in intimo contatto con il sangue e il liquor. Queste strutture sono densamente vascolarizzate e contengono neuroni osmorecettivi e sodio-ricettivi che controllano il bere, il rilascio di vasopressina, l’escrezione di sodio e l’appetito di sodio. Contengono anche neuroni con recettori per l’angiotensina, il fattore natriuretico atriale, l’endotelina e la relaxina, ognuno dei quali è importante nella regolazione dell’equilibrio di fluidi ed elettroliti. I neuroni dell’OVLT e dell’OFS proiettano al nucleo sopraottico e al nucleo paraventricolare, e anche alle aree ipotalamiche preottiche. Gli organi circumventricolari possono anche essere il sito d’azione delle interleuchine per suscitare sia la febbre che la secrezione di ACTH, attraverso effetti sui neuroni paraventricolari.
Non è chiaro come tutti i peptidi che influenzano l’attività ipotalamica ottengano l’accesso necessario. Nel caso della prolattina e della leptina, c’è la prova dell’assorbimento attivo nel plesso coroideo dal sangue al liquido cerebrospinale (CSF). Alcuni ormoni ipofisari hanno un’influenza di retroazione negativa sulla secrezione ipotalamica; per esempio, l’ormone della crescita alimenta di nuovo l’ipotalamo, ma come entra nel cervello non è chiaro. Ci sono anche prove di azioni centrali della prolattina.
I risultati hanno suggerito che l’ormone tiroideo (T4) è assunto dalle cellule gliali ipotalamiche nel nucleo infundibolare/ eminenza mediana, e che è qui convertito in T3 dalla deiodinasi di tipo 2 (D2). Successivamente, la T3 viene trasportata nei neuroni produttori di ormone di rilascio della tireotropina (TRH) nel nucleo paraventricolare. I recettori dell’ormone tiroideo sono stati trovati in questi neuroni, indicando che sono effettivamente sensibili agli stimoli T3. Inoltre, questi neuroni hanno espresso MCT8, un trasportatore di ormoni tiroidei, sostenendo la teoria che T3 è trasportato in loro. T3 potrebbe quindi legarsi al recettore dell’ormone tiroideo in questi neuroni e influenzare la produzione di ormone di rilascio della tireotropina, regolando così la produzione di ormone tiroideo.
L’ipotalamo funziona come un tipo di termostato per il corpo. Stabilisce una temperatura corporea desiderata e stimola la produzione e la ritenzione di calore per aumentare la temperatura del sangue ad un livello più alto o la sudorazione e la vasodilatazione per raffreddare il sangue ad una temperatura più bassa. Tutte le febbri derivano da un’impostazione elevata dell’ipotalamo; le temperature corporee elevate dovute a qualsiasi altra causa sono classificate come ipertermia. Raramente, un danno diretto all’ipotalamo, come per esempio un ictus, causerà una febbre; questo è talvolta chiamato febbre ipotalamica. Tuttavia, è più comune per tali danni a causare temperature corporee anormalmente basse.
SteroidsEdit
L’ipotalamo contiene neuroni che reagiscono fortemente agli steroidi e glucocorticoidi – (gli ormoni steroidei della ghiandola surrenale, rilasciati in risposta a ACTH). Contiene anche neuroni specializzati sensibili al glucosio (nel nucleo arcuato e nell’ipotalamo ventromediale), che sono importanti per l’appetito. L’area preottica contiene neuroni termosensibili; questi sono importanti per la secrezione di TRH.
NeuralEdit
La secrezione di ossitocina in risposta all’allattamento o alla stimolazione vagino-cervicale è mediata da alcune di queste vie; la secrezione di vasopressina in risposta a stimoli cardiovascolari derivanti da chemorecettori nel corpo carotideo e nell’arco aortico, e da recettori di volume atriale a bassa pressione, è mediata da altri. Nel ratto, la stimolazione della vagina provoca anche la secrezione di prolattina, e questo provoca una pseudo-gravidanza dopo un accoppiamento sterile. Nel coniglio, il coito provoca un’ovulazione riflessa. Nella pecora, la stimolazione cervicale in presenza di alti livelli di estrogeni può indurre un comportamento materno in una pecora vergine. Questi effetti sono tutti mediati dall’ipotalamo, e l’informazione è trasportata principalmente dalle vie spinali che fanno da relè nel tronco encefalico. La stimolazione dei capezzoli stimola il rilascio di ossitocina e prolattina e sopprime il rilascio di LH e FSH.
Gli stimoli cardiovascolari sono trasportati dal nervo vago. Il vago trasmette anche una varietà di informazioni viscerali, compresi per esempio i segnali derivanti dalla distensione gastrica o dallo svuotamento, per sopprimere o promuovere l’alimentazione, segnalando il rilascio di leptina o gastrina, rispettivamente. Anche queste informazioni raggiungono l’ipotalamo tramite relè nel tronco encefalico.
Inoltre la funzione ipotalamica è sensibile e regolata dai livelli di tutti e tre i classici neurotrasmettitori monoaminici, noradrenalina, dopamina e serotonina (5-idrossitriptamina), in quei tratti da cui riceve innervazione. Per esempio, gli input noradrenergici derivanti dal locus coeruleus hanno importanti effetti di regolazione sui livelli di ormone di rilascio della corticotropina (CRH).
Controllo dell’assunzione di ciboModifica
| Peptidi che aumentano il comportamento alimentare comportamento |
Peptidi che diminuiscono il comportamento alimentare |
|---|---|
| Grelina | Leptina |
| Neuropeptide Y | (α,β,γ)-Ormoni stimolanti i melanociti |
| Peptide legato all’Agouti | Peptidi di trascrizione regolati da cocaina e anfetamina |
| Orexine (A,B) | Ormone di rilascio della corticotropina |
| Ormone di concentrazione della melanina | Cholecistochinina |
| Galanina | Insulina |
| Glucagon-like peptide 1 |
La parte laterale estrema del nucleo ventromediale dell’ipotalamo è responsabile del controllo dell’assunzione di cibo. La stimolazione di quest’area causa un aumento dell’assunzione di cibo. La lesione bilaterale di quest’area causa la completa cessazione dell’assunzione di cibo. Le parti mediali del nucleo hanno un effetto di controllo sulla parte laterale. La lesione bilaterale della parte mediale del nucleo ventromediale causa iperfagia e obesità dell’animale. Un’ulteriore lesione della parte laterale del nucleo ventromediale nello stesso animale produce la completa cessazione dell’assunzione di cibo.
Ci sono diverse ipotesi relative a questa regolazione:
- Ipotesi lipostatica: Questa ipotesi sostiene che il tessuto adiposo produce un segnale umorale che è proporzionato alla quantità di grasso e agisce sull’ipotalamo per diminuire l’assunzione di cibo e aumentare la produzione di energia. È stato dimostrato che un ormone, la leptina, agisce sull’ipotalamo per diminuire l’assunzione di cibo e aumentare la produzione di energia.
- Ipotesi dei gutpeptidi: gli ormoni gastrointestinali come Grp, glucagoni, CCK e altri sostengono di inibire l’assunzione di cibo. Il cibo che entra nel tratto gastrointestinale scatena il rilascio di questi ormoni, che agiscono sul cervello per produrre sazietà. Il cervello contiene sia recettori CCK-A che CCK-B.
- Ipotesi glucostatica: L’attività del centro della sazietà nei nuclei ventromediali è probabilmente regolata dall’utilizzazione del glucosio nei neuroni. È stato postulato che quando il loro utilizzo del glucosio è basso e di conseguenza quando la differenza di glucosio arterovenosa sangue attraverso di loro è basso, l’attività attraverso i neuroni diminuire. In queste condizioni, l’attività del centro di alimentazione è incontrollata e l’individuo si sente affamato. L’assunzione di cibo è rapidamente aumentata dalla somministrazione intraventricolare di 2-deossiglucosio, diminuendo così l’utilizzo del glucosio nelle cellule.
- Ipotesi termostatica: Secondo questa ipotesi, una diminuzione della temperatura corporea al di sotto di un dato set-point stimola l’appetito, mentre un aumento al di sopra del set-point inibisce l’appetito.
Elaborazione della pauraModifica
La zona mediale dell’ipotalamo è parte di un circuito che controlla i comportamenti motivati, come quelli difensivi. Le analisi della marcatura Fos hanno mostrato che una serie di nuclei nella “colonna di controllo comportamentale” è importante nel regolare l’espressione dei comportamenti difensivi innati e condizionati.
Comportamento difensivo antipredatorio
L’esposizione a un predatore (come un gatto) suscita comportamenti difensivi nei roditori di laboratorio, anche quando l’animale non è mai stato esposto a un gatto. Nell’ipotalamo, questa esposizione causa un aumento delle cellule marcate Fos nel nucleo ipotalamico anteriore, nella parte dorsomediale del nucleo ventromediale e nella parte ventrolaterale del nucleo premammillare (PMDvl). Il nucleo premammillare ha un ruolo importante nell’espressione dei comportamenti difensivi verso un predatore, poiché le lesioni in questo nucleo aboliscono i comportamenti difensivi, come il congelamento e la fuga. Il PMD non modula il comportamento difensivo in altre situazioni, poiché le lesioni di questo nucleo avevano effetti minimi sui punteggi di congelamento post-shock. Il PMD ha importanti connessioni con il grigio periaqueduttale dorsale, una struttura importante nell’espressione della paura. Inoltre, gli animali mostrano comportamenti di valutazione del rischio verso l’ambiente precedentemente associato al gatto. L’analisi delle cellule marcate Fos ha mostrato che il PMDvl è la struttura più attivata nell’ipotalamo, e l’inattivazione con muscimolo prima dell’esposizione al contesto abolisce il comportamento difensivo. Pertanto, l’ipotalamo, principalmente il PMDvl, ha un ruolo importante nell’espressione dei comportamenti difensivi innati e condizionati verso un predatore.
La sconfitta sociale
Anche l’ipotalamo ha un ruolo nella sconfitta sociale: I nuclei della zona mediale sono anche mobilitati durante un incontro con un conspecifico aggressivo. L’animale sconfitto ha un aumento dei livelli di Fos nelle strutture sessualmente dimorfiche, come il nucleo preottico mediale, la parte ventrolaterale del nucleo ventromediale e il nucleo premammillare ventrale. Tali strutture sono importanti in altri comportamenti sociali, come i comportamenti sessuali e aggressivi. Inoltre, anche il nucleo premammillare è mobilitato, la parte dorsomediale ma non la parte ventrolaterale. Lesioni in questo nucleo aboliscono il comportamento difensivo passivo, come il congelamento e la postura “on-the-back”.