はじめに
心拍変動(HRV)分析は、自律神経調節と交感神経と副交感神経系の間の相互作用に関する洞察を提供するものです。 HRV は、健康な状態で自然に発生する、心拍数の時間的な変動を記述するものです。 これらの変動は、ホメオスタシスを維持するために、内外の事象に継続的に適応する生物の能力を反映しています。 興味深いことに、Chrousos and Gold (1992, p. 1245) は、ストレスを「ホメオスタシスが脅かされた状態」と定義しています。 そのため、長年にわたって、HRV の低下はストレスの上昇を反映していると考えられており、HRV 解析はストレスを測定する方法の 1 つとして認識されるようになっています。
最も単純な HRV 測定の 1 つ (SDNN) は、正常 RR 間隔時間の標準偏差、すなわち心電図 (ECG) 上の連続した QRS の正常 (洞) R ピークの間隔が時間的にどのように変化するかを定量的に示したものです。 それにもかかわらず、HRVからますます正確な情報を抽出するために、HRV分析に対する数多くの数学的指標とアプローチが長年にわたって開発されてきました (Shaffer and Ginsberg, 2017)。
時間領域HRV分析は、NN間隔 (すなわち正常RR間隔) の時間的変動に焦点を当てて行われます。 SDNNに加えて,HRV研究では,連続した差の二乗平均平方根(RMSSD)や,前回と50ms以上(pNN50)または20ms以上(pNN20)異なる間隔の割合が頻繁に調査されます。 時間領域におけるこれらすべての HRV メトリクスについて、値が高いほど変動が大きいことを示し、これは健康な状態でより一般的です。
非線形または幾何学的 HRV 分析は、NN 間隔をポアンカレ プロットにプロットして行うことができます。 SD1とSD2の間の相互作用を反映するために、心臓交感神経指数(CSI)や心臓迷走神経指数(CVI)などの指標が開発されている(Toichi et al.) CSI は CVI と反対の挙動を示すため、他の多くの HRV メトリクスとは異なり、CSI が高いほど変動が小さい、すなわちストレスが高いということになります。 その他の幾何学的指標としては、三角指標 (TINN) と HRV 指標があります。 SDNN と同様、これら 2 つのパラメータは、記録期間中の全体的な変動性の尺度を示しています。 TINN は、NN 間隔のヒストグラムの底辺の正規化幅を測定し (NN ヒストグラムの最高値に関連して)、HRV 指数は、すべての NN 間隔数と NN ヒストグラムの最高点における NN 間隔数 (128 個/秒のサンプリング レートに正規化) の比です。
周波数領域分析では、ECG パワー スペクトルの異なるバンドとそれらの相互関係 (バンド間および合計パワーに関連して) が解析されます。 成人では、これまでの研究で、関心のある4つの周波数帯域が定義されている。 超低周波(ULF)、超低周波(VLF)、低周波(LF)、高周波(HF)であり、それぞれ異なる生理学的起源があると考えられている。 ULFは中核体温の概日振動とレニン-アンジオテンシン調節、VLFは体温調節の長期的調節とホルモン機構、LFは交感神経と迷走神経活動の混合と圧受容器活動、HFは迷走神経活動と関連している(Pomeranzら、1985年)。 それにもかかわらず、乳幼児におけるULFとVLFの定義と意味は十分に文書化されていないため、この報告書には含まれていない。 HF帯とLF帯のパワーの絶対値は増減するが、正常な心伝導度の下では、LFnとHFn(LFとHFをトータルパワーで正規化したもの)はほとんどの場合、逆の方向に動くと予想される。 したがって、副交感神経活動を表すHFnは生理的ストレスが低いときに高くなり、ストレスが高いときにLFnが高くなると予想される。 これらの関連は、それにもかかわらず、議論の余地があり(von Rosenbergら、2017;Adjeiら、2019)、現実のシナリオにおけるLFおよびHF所見の解釈には注意が必要です。
心拍変動分析は、自律神経障害の測定方法として広く受け入れられ、疾患層別化の価値に関してますます検討されています(Ahmadら、2009;Leesら、2018;Oliveiraら、2018)。 先行研究では、最初の数日間における新生児の標準的なHRV基準値が記載されているが(Mehtaら、2002;Longinら、2005;Doyleら、2009;Makarovら、2010;Lucchiniら、2019)、出生後の初期数時間のHRVに関する調査は不足している。 これらの研究は、ほとんどが最初の日に数分間のECGしか記録していないか、生後12時間以降にのみ開始しており、生後24時間の連続的なHRVの傾向を記述したものはない。
にもかかわらず、いくつかの状態、特に新生児脳症のような出生合併症によって発生し一刻を争う決定を要する状態では、出生直後の正常HRV基準値と最初の24時間にわたるその傾向について述べることが重要であり、そのような初期の傾向は赤ちゃんが出生関連のあらゆる合併症からいかに回復したかという貴重な情報となるかもしれない。 私たちの第一の目的は、健康な正期産児における生後 24 時間の HRV トレンドの標準的な基準値を明らかにすることです。 第二の目的として、我々は、どの(もしあれば)臨床的特徴またはリスク要因がHRVに高い影響を及ぼすかを調査した。”8672″
材料と方法
研究集団
我々は2017年8月から2019年1月にQueen Charlotte and Chelsea病院の出産センター、陣痛室または産後院から150人の健康成体赤ちゃんを前向きにかつ連続的に募集した。 合併症のない妊娠に続いて妊娠36週以上で生まれ、出生時体重が9~91センタイルで良好な状態で生まれた健康な赤ちゃんを対象としました。 赤ちゃんは、何らかの薬物療法や光線療法を必要とした場合、陣痛開始時または48時間以内に周産期の母体の発熱があった場合、出生時または出生後に蘇生術(挿管や心臓圧迫、何らかの薬物)を必要とした場合、分娩内合併症(母体出血、胎盤早期剥離、子癇前症、臍帯脱出)があった場合は除外された。
Intrapartum and Early Postnatal Care
Babies were born either at the birth center or in the labor ward, based on the maternal preference.The study contained in the birth center or the labor ward, based on the maternal preference. より自然で、より医療的でない出産を希望する女性は、バースセンターでの助産師主導のケアを選択した。 温水プール、アロマセラピー、音楽、亜酸化窒素、さまざまな機器が用意され、彼女たちが陣痛の痛みに対処するのを助けています。 硬膜外鎮痛法を選択した女性たちは、産科医主導のケアを陣痛室で受けました。 どちらの環境でも、室温は24〜25℃に設定されていました。 国のガイドラインに基づき、状態の良い赤ちゃんは出産後すぐに母親に渡し、胸や腹に乗せてスキンシップを図ります。 心電図の記録は、出生後できるだけ早く開始し、保護者の同意を得て、出生前または出生後に記録した。 この研究は、国の研究倫理委員会(REC17/LO/0956)および地域の研究開発部門の承認を得ている。 記録は少なくとも6時間継続したが,両親からの要請があった場合,あるいは赤ちゃんが退院する場合は,より早く中断することができた。 心電図記録装置には、以前テストした3電極胸部セットアップ、サンプリングレート500Hzのポータブル2インチ心電図記録装置(Faros 180, Bittium, Oulu, Finland)を使用した(図1)。 記録が完了したら、ECGファイルをCardiscopeTM HRV Analysis Software (Hasiba Medical, Graz, Austria) にアップロードしてECGとHRVを解析した。
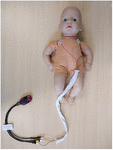
Figure 1. ポータブルECGレコーダーと胸部セットアップ。 3つのECG電極は、ECGワイヤ間の距離を短縮し、生のECG信号(自動Rピーク検出による500 Hz)上の磁気誘導アーチファクトを防止するために、アライメントスリーブを通して供給した。
HRV Analysis
時間(線形および非線形)および周波数領域における心拍変動メトリクスは、ECGの各5分セグメント(重複しないウィンドウ)について算出された。 QRSの有効性を90%以上とし,連続した良質のQRSが90%未満の5分セグメントはすべて解析から除外した。 新生児に特化したHRV解析の国際的な推奨がないため、我々の方法と選択したメトリックは、利用可能な国際ガイドライン(欧州心臓病学会および北米ペーシング・電気生理学会のタスクフォース、1996、シュワルツら、2002)の適応に加えて、HRV研究に関する最近の推奨(ラボルドら、2017)および生後数日の新生児の関連HRV研究のレビュー(ドイルら、2009、グールドら、2015、テムコら、2015)に基づいている。 分析に選んだ16のHRVメトリクスは、これらの文献に基づいたものである。 周波数解析はフーリエ変換(ウェルチピリオドグラム)で行い、RR間隔の時系列はデトレンドして補間(キュービックスプライン)したものを使用しました。 上記文献に基づき、LF帯を0.04-0.20Hz、HF帯を0.20-2.0Hzで使用した。 そして、正規化したLFとHF、すなわち、全スペクトルパワーに対するこれらの帯域のパワーの割合を分析した。 本研究で報告された HRV メトリクスの一覧とその意味は、表 1 に記載されています。 HRVメトリクス:略語と意味
Statistical Analysis
統計解析にはStata 15 (StataCorp, Austin, TX, United States)を使用した。 HRVの時間推移を時間ごとの中央値と四分位範囲で記述し、生後6時間および24時間の個人平均を算出した。 心電図記録の開始と終了が異なる場合があり、データのバランスが悪い、すなわち、すべての参加者の測定回数がまったく同じでなかったため、HRVの経時変化は、自己回帰共分散による多段階混合効果回帰で解析し、6時間ごとの平均を比較する場合はペアワイズ検定を用いて解析した。 臨床変数の関連性も自己回帰共分散を用いた多値混合効果回帰で検証し、有意な臨床変数については比率/平均比較検定を用いてサブグループ比較を行った。 ほとんどのトレンドは線形ではなく、少なくとも1回の偏向があったため、回帰モデルでは時間変数に2次項を使用した。 正規分布していないHRV変数を対数変換し、正規の残差を確保した。
結果
2017年9月から2019年1月の間に、511人の赤ちゃんをスクリーニングし、そのうち360人が適格、151人がそうでなかった。 その360人の赤ちゃんのうち、201人の母親・父親から、後日または別の都合の良い時間に再来訪するよう要請があり、最終的に最大募集枠を超えたり、機器が使用中のため募集不可能になったりしました。 本研究について十分な説明を受けた159人の母親・父親のうち、9人が辞退し、150人が文書によるインフォームドコンセントを行った。 この150人のうち、7人が24時間後に心電図記録を開始した。標本の特徴を表2、3に報告する。 合計で1858時間55分の心電図記録が得られ、中央値(IQR)2時間46分(3時間6分)、最小で出生後1分、最大で52時間23分の年齢で開始された。 すべての赤ちゃんが同時に心電図記録を開始したわけではなく、すべての記録が同じ時間続いたわけでもない。 図2は、時間ごとの有効な記録と赤ちゃんの数を示している

Table 2. サンプルの特性I(連続変数).

Table 3. サンプル特性II(カテゴリー変数).
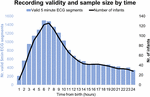
Figure 2. 記録有効性と時間ごとのサンプルサイズ。
HRV Values Over Time
生後6時間の間、中央値(IQR)はHR 122 (15.9), SDNN 27.5 (13.2), RMSSD 18.32 (11.42), SD1 13.1.6 (7.7), SD2 36.2 (17.8), SDSD 18.8 (11.4), CVI 2.7 (0.4), CSI 2.6 (1.2), pNN20 14.8 (15.2), pNN50 1.7 (2.).5) HFn 40.4(16.9) LFn 57.7(17.8) Total power 751(835), TINN 226(144) HRV Index 5.9(2.3) Parseval 0.7(0.2) とした。 これらのHRV指標のうち9項目(心拍数を含む)は、関連する臨床変数で調整した上で、経時的に有意に変化した(HR p < 0.01; SDNN p = 0.01; SD2 p < 0.01; CSI p < 0.01; HFn p = 0.03; LFn p < 0.01;Total power p < 0.01;HRV Index p = 0.01;Parseval Index p = 0.03). より顕著な変動は、生後6時間の間に観察された。 心拍数とLFnのみが生後6時間から12時間の間に変化し、心拍数のみが生後12時間から18時間の間に変化した(ボンフェローニ調整p値。 それぞれ0.03、< 0.01、< 0.01であった)。 これらの指標は、最初の6時間でHRVの増加を示し、その後12時間までわずかに減少し、そこからはHRVは安定したままであった(表4)。 時間ごとの傾向は、中央値と四分位範囲で図3に示した。 HRVの経時的傾向は、妊娠年齢、胎動低下、CTG分類、母親の慢性疾患または妊娠によって誘発された疾患、および分娩合併症の発生によって独立して影響を受けた。 (a) 時間領域メトリクス間の類似性、(b) HFn と LFn、CSI と CVI の間の対称性の傾向を強調しました。 6時間ごとのHRV平均値とペアワイズ比較。
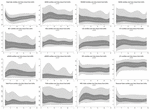
Figure 3.HRV平均値とペアワイズ比較。 生後24時間におけるHRVの百分位数。 薄い灰色の部分。 第5-25百分位と第75-95百分位。 暗い灰色の部分。 25-75th百分位。 中央の白線は中央値に相当する。 p値は、経時的変化を測定するための多段階混合効果回帰から得られたものである。 図4

Figure 4
すべての百分位は三次スプラインで平滑化した。 相関行列: すべての HRV メトリクス。 HRVメトリクスの略語については、表1を参照してください。 特に、(a) RMSSD、SDSD、SD1 の間の一致は、以前にも報告されている。(b) HRV 解析によって得られる追加情報の多さを強調する、HR に関連した異なる HRV 指標の挙動、(c) HFn、LFn および CVI、CSI の相互依存性には、交感神経と副交感神経が相互に及ぼす影響に注目されよう。
Effect of Clinical Factors
年齢(出生時刻形式)に加え、単変量多値混合効果回帰では、HRVメトリクスが妊娠年齢、胎動減少、CTG、母体疾患、分娩合併症に影響を受けることが示された。 これらの変数を調整した後でも、上記7つのHRV指標の経時的変動は統計的に有意であった。 HFnとParseval Indexもまた、有意な変化を示した。 単変量回帰分析ではパリティは独立した予測因子ではなかったが、自然経膣分娩のサブグループでは、多パラに比べてプリミパラのHRVが高いという一貫した傾向が認められた。
Reduced Fetal Movements
CSI(逆方向の挙動、すなわち結果が一致)を除くすべてのメトリクスで胎動の減少がHRV値の低下と一貫して関連していた。 このようなサブグループ間の差は、CSI (p = 0.001), pNN20 (p = 0.045) および Parseval Index (p = 0.047) の傾向でのみ統計的に有意であった。 図5は、これら3つの指標の経時的な傾向を、心拍数との比較で示したものである。 これは、HRVを独立して予測しなかった平均的な重症度以外、サブグループ間に有意な差がないにもかかわらず、である(表5)。 CSIとpNN20との関連は、妊娠年齢、出生からの時間、CTG分類、母親の慢性疾患の有無、分娩合併症を調整しても、有意なままであった(表6)。 胎動が減少したサブグループは、最初の6時間の間、平均HRVが低かったが、これらの差は統計的に有意ではなかった
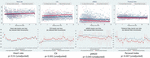
Figure 5. 母親が胎動減少を報告した赤ちゃんのHRV変化。 HRV指標の略語については、表1を参照されたい。 上段は、心拍数(比較)および胎動減少の母親の報告と有意に関連した3つのHRV指標の経時的なHRVデータの散布と線形傾向線である。 赤線は母親が胎動減少を報告した乳児、青線は母親が報告しなかった乳児を表す。 下段は、それらの指標の平均値と95%信頼区間を示している。 サブグループの比較-胎動が減少した赤ちゃんとそうでない赤ちゃん。

Table 6. HRV指標と低下した胎動との未調整および調整後の相関
Cardiotocography
CSI(p=0.03)、LFn(0.01)、HFn(p=0.02)で、時間経過によるCTG所見とHRV傾向との間に有意な関連があり、低下した胎動、妊娠期間、出生からの時間、母体または妊娠によって引き起こされた慢性疾患や出産合併症の存在で調整後も、統計的に有意であることがわかった。 それにもかかわらず、各CTG分類のイベント数が少ないことから、これらのサブグループ間の6時間平均値も比較した。 徐脈サブグループのCSIは、「正常」、「減速度変化」、「その他」グループと有意な差があったが(ボンフェローニ調整p値:それぞれ0.02、0.03、0.04)、その他のグループ差は統計的に有意でなかった。 HFnは「徐脈」サブグループと「可変減速」サブグループの間でのみ差があり(p=0.03)、LFnは異なるCTGサブグループ間で差がなかった。
母体の慢性疾患または妊娠による後遺症
我々のサンプルでは、104人(69%)の女性は慢性疾患も妊娠による疾患もなく、20人(13%)は孤立型糖尿病または妊娠糖尿病、7人(3%)は甲状腺疾患、1人(0.7%)は高血圧、残りの人は上記の組み合わせを含む他の疾患を持っていました(表3)。 母親の慢性疾患または妊娠によって引き起こされた病気は、調整前のHRVの傾向と有意に関連していたが、これは臨床的交絡因子で調整した後も、パースバル指数(p = 0.03)のみで統計的に有意であった。 バイナリ解析では、妊娠/慢性疾患を持つ母親の赤ちゃんは、最初の6時間(p = 0.98)および24時間(p = 0.29)のいずれにおいても平均Parseval指数に違いはなかった。
分娩時の出来事
本研究のすべての赤ちゃんは合併症のない妊娠・分娩を経て生まれ、良い状態で生まれました。 それにもかかわらず、次のイベントのいずれかがあった出産が13件あった:メコニウム染色液(11)、円形頸髄(1)、分娩第2期の延長(1)、肩甲難産(1、メコニウムに加えて)である。 24時間のCSIの傾向は、出産前の分娩イベントの有無(p=0.04)と有意に関連していたが、交絡因子調整後(p=0.42)では有意ではなかった。
出産形態はHRV値を独立して予測しなかったが、器具分娩で生まれた赤ちゃんは自然経膣分娩で生まれた赤ちゃんより24時間のHFnが低く、24時間のCSIが高かった。 これは、他の関連する臨床変数の間に有意な差がないにもかかわらず、1分後のアプガースコアと妊娠の多重性は独立してHRVを予測しなかった(表7)
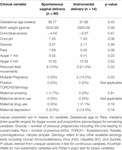
Table 7. サブグループ比較-通常の経膣分娩で生まれた赤ちゃんと器械分娩で生まれた赤ちゃんでの比較
考察
本研究は、健康な正期産児の出生直後の連続HRV傾向を説明した初めての研究である。 生後早期のHRV解析と解釈は時間依存的であること、すなわち生後1~6時間では正常でも生後12~18時間では正常でない場合があることがわかったため、これらの閾値と傾向を明らかにすることは重要であった。 これにより、臨床医や研究者は、生後すぐの健康な乳児と病気の乳児の間の HRV の違いをより正確に調べることができるようになります。 また、生後すぐの正確な基準値を持つことは、HRV 解析に基づく早期警告システムを開発するための準備が整ったことを意味します。
生後 6 時間に観察された変化については、いくつかの理由が考えられます。 出産は赤ちゃんにとってストレスの多いイベントであると以前から言われているため (Peebles et al., 1994; Aldrich et al., 1996) 、最初の数時間の HRV の改善は、ストレス要因の影響の終了 (すなわち、出産の終了) を反映しているという可能性があります。 この副交感神経のリバウンドは、交感神経系が副交感神経活動を一時的に抑制することができ、ストレス期間が終了するとその活動が停止するために起こる可能性があります。 別の観点では、Reyes-Lagosら, 2015が分娩中の母体HRVが第3期よりも高いことを報告し、Musaら, 2017が分娩中の頸管拡張によるLFnとHFnの上昇について述べています。 胎児HRVが母体HRVに追随するとすれば、これはかえって、健康な赤ちゃんでは、生理的な課題への良好な適応を反映して、出産が特に高いHRVの期間となる可能性を示唆することになる。 最後に、最初の数時間に観察されたHRVの変化は、年齢とともに起こるHRVの成熟の部分的な表現である可能性もあります(Fyfe et al. 我々が最初の6-12時間に観察したHRV値は、生後12時間における活発な睡眠におけるDoyleら(2009)および12-84時間におけるLucchiniら(2019)が報告した値と同等(わずかに高い)であり、それ以上の年齢、すなわち24-168時間において報告した値(Mehtaら、2002;Longinら、2005;Mcarovら、2010)よりも低いものであった。 本研究の赤ちゃんは、生後6時間の間のSDNN値が、期産の胎児(Brändleら、2015;Schneiderら、2018)と同等(わずかに高い)であり、これは、記録期間が長く、妊娠年齢が上昇していることから予想されることであった。 出産前後に同様のHRVがあることは、健康な赤ちゃんの出産は、良好なHRVの安定性と関連しているという説を支持します。
我々は、すべてのHRVメトリクスで被験者内よりも被験者間の変動が多く観察されました。 このことは、HRV分析は基準値に基づいて解釈するだけでなく、個人のベースラインとの関係における変化や進捗を考慮しなければならないことを強調しています。 実際、生後 6 時間の間、時間ごとの HRV の変化を観察することができましたが、単一の時点または平均値の分析にのみ専念していた場合、このような変動を検出できなかったかもしれません。 このような傾向を監視することで、複雑な出産や緊急介入の際に乳児がどのように回復するかについて、さらなる知見が得られるかもしれません。 実際、HRVメトリクスが胎動の減少、CTG異常、母親の慢性疾患または妊娠による疾患、分娩合併症と有意に関連していたという事実は、総合的なウェルビーイングの指標としてHRV分析の価値を強調している。
HRVと胎動の関連は、胎児生体磁気学を使ってBrändleら(2015)によって以前に報告されている。 24週から41週の健康な胎児を含む動きに基づいて行動状態を評価する彼らの研究では、HRVメトリクス(ただしEntropyではない)は、すべての妊娠年齢で、静かな睡眠から活発な睡眠、活発な睡眠から覚醒状態へと増加していた。 実は、Nijhuisら(1982)はすでに、胎児のHRV、眼球運動、体動に基づく胎動分類を提案していました
これまでの著者らは、異なる分娩様式でHRV値に違いがあることを発見しています。 Kozarら(2018)は、帝王切開で生まれた赤ちゃんは、経膣で生まれた赤ちゃんよりもHFnが低く、LFnが高いと報告しました。 彼らの発見は、分娩様式というよりも、彼らのすべての選択的切開における全身麻酔(GA)のためのチオペンタールの使用(Riznykら、2005;土屋ら、2006)と関連している可能性があるが、我々の研究ではいかなるGAも使用されていなかった。 HRVはウェルビーイングに差があれば分娩形態の違いを示すというのが我々の解釈であり、したがって、我々の研究では、これは難産による分娩時の器具の使用と関連していると思われる。 生後数時間で概日リズムが確立することは考えにくく、多くの場合、新生児は代わりに超日常リズムに従っている(Mirmiranら、2003)。 しかし、24時間測定の後半に見られるやや低下した傾向は、眠っている赤ちゃんや静かな状態の赤ちゃんの割合が増えたことを反映している可能性があります。 私たちは、母親が慢性疾患や妊娠に起因する疾患を持つ健康な赤ちゃんを数名、この研究に参加させた。 このようなケースを含めると、健康な新生児や健康な新生児 HRV の定義が危うくなると言えるかもしれません。 HRV 測定値と pH、塩基過剰、アプガースコアとの間に有意な相関が認められなかったという事実は、本研究のサンプルが実に健康であったことを如実に示しています。 私たちの目的は、実用的な観点から「健康」とみなされ臨床的に管理されている分娩の全領域(すなわち、「低リスク」で「合併症のない」すべて)を代表することでした。 したがって、これらの赤ちゃんを含めることは、考えられる「正常のバリエーション」に対処し、データセットを充実させるための重要なステップであった。 同様に、我々は、いくつかのサブグループ(表2に記載されているような臨床変数による)間のHRVの違いの可能性を探った。 しかし、我々の研究は、これらのサブグループ間の違いの可能性を詳細に検討することを目的としたものではなく、また検出力もなかったことを明確にすることが重要であり、我々の知見を解釈するためには注意が必要である。 しかし、これらの関連性を調べることは、産科や周産期・新生児医療に携わる医療チームにとって興味深いものになると考えられる。 HRVは生後1日目、特に最初の6時間に大きく変化し、その間は短時間の上昇を示し、その後正常化するようである。 HRV と臨床的リスク変数との有意な相関は、HRV が赤ちゃんの全般的な健康状態の優れた指標であり、出生に関連するストレスを拾い上げてその解消を経時的に監視する感度が高いという仮説を裏付けています。
Data Availability
本論文の結論を裏付ける生データは、著者らにより、資格ある研究者なら誰でも、過度の遠慮なく入手できる。
Ethics Statement
この研究は、英国健康研究庁の勧告およびGCP ICHに従って、すべての被験者から書面での同意を得て実施したものである。 すべての被験者がヘルシンキ宣言に基づき、書面によるインフォームドコンセントを行った。 プロトコルはLondon Chelsea Research Ethics Committeeの承認を得た。
Author Contributions
VOは研究の設計、データの収集、分析、解釈、最初のドラフトを書き、原稿の作成をリードした。 WvRはデータの解析と解釈に貢献し、原稿の作成に重要なインプットを提供した。 PMとTAはデータの解釈に貢献し、原稿の作成に重要なインプットを提供した。 JMは研究デザインとデータ解釈、患者募集とデータ取得に貢献した。 VSは研究管理、被験者募集に貢献した。 DM は HRV 解析と解釈の全側面を監督し、原稿の作成に重要な示唆を与えた。 STは研究のアイデアと設計を行い、研究のすべての面を監督し、原稿の作成を主導した
資金
VOはNIHR ICA Doctoral Research Fellowshipの資金援助を受けた。 PMはMRC Doctoral Research Fellowshipの資金援助を受けた。 記載された見解は著者のものであり、必ずしもNIHRやDepartment of Healthのものではありません。
利益相反声明
著者らは、潜在的な利益相反と解釈される商業的または金銭的関係がない状態で研究を実施したことを宣言します。
謝辞
本研究への赤ちゃんの参加を承諾してくださったすべてのご両親と、この原稿に含まれるデータの統計解析でサポートしてくださったPaul Basset氏(医学統計学者)に感謝いたします。 Rosenberg, W., Von, Nakamura, T., and Chanwimalueang, T. (2019). The classA framework : HRV based assessment of SNS and PNS dynamics without LF-HF controversies(LF-HF論争を回避したHRVベースのSNSおよびPNSダイナミクスの評価)。 Front. Physiol. 10:505. doi: 10.3389/fphys.2019.00505
PubMed Abstract | CrossRef Full Text | Google Scholar
Ahmad, S., Tejuja, A., Newman, K. D., Zarychanski, R. and Seely, A. J. E. (2009). 臨床レビュー:心拍変動と感染症の診断・予後に関するレビューと分析。 Crit. Care 13, 1-7. doi: 10.1186/cc8132
PubMed Abstract | CrossRef Full Text | Google Scholar
Aldrich, C.J., D’Antona, D., Spencer, J.A.D., Delpy, D.T., Reynolds, E. O.R., and Wyatt, J.S. (1996). 陣痛第一期における近赤外分光法による胎児心拍数変化と脳酸素化測定。 Eur. J. Obstet. Gynecol. Reprod. Biol. 64, 189-195. doi: 10.1016/0301-2115(95)02284-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Brändle, J., Preissl, H., Draganova, R., Ortiz, E., Kagan, K.O., Abele, H., et al.(2015)。 心拍変動パラメータと胎動は、神経栄養発達をモニターするために、マグネトグラフィーを介した胎児の行動状態検出を補完する。 Front. Hum. Neurosci. 9:147. doi: 10.3389/fnhum.2015.00147
PubMed Abstract | CrossRef Full Text | Google Scholar
Chrousos, G., and Gold, P. (1992). ストレスとストレス系障害の概念-身体的・行動的ホメオスタシスの概説。 JAMA 267, 1244-1252. doi: 10.1001/jama.267.9.1244
PubMed Abstract | CrossRef Full Text | Google Scholar
Doyle, O. M., Korotchikova, I., Lightbody, G., Marnane, W., Kerins, D., and Boylan, G.B. (2009).を参照されたし。 生後間もない健康な正期産新生児における睡眠中の心拍変動。 Physiol. Meas. 30, 847-860. doi: 10.1088/0967-3334/30/8/009
PubMed Abstract | CrossRef Full Text | Google Scholar
Fyfe, K. L., Yiallourou, S. R., Wong, F. Y., Odoi, A., Walker, A. M., and Horne, R. S. C. (2015). 出生時の妊娠年齢が心拍変動の後期成熟に及ぼす影響。 Sleep 38, 1635-1644. doi: 10.5665/sleep.5064
PubMed Abstract | CrossRef Full Text | Google Scholar
Golińska, A. K.(2013). 選択された生体信号の解析におけるポアンカレプロット。 Stud. Logic Gramm. Rhetor. 35, 117-127. doi: 10.2478/slgr-2013-0031
CrossRef Full Text | Google Scholar
Goulding, R. M., Stevenson, N. J., Murray, D. M., Livingstone, V., Filan, P. M., and Boylan, G. B. (2015). 低酸素性虚血性脳症における心拍変動:脳波グレードおよび2-y神経発達アウトカムとの相関。 小児科医。 Res. 77, 681-687. doi: 10.1038/pr.2015.28
PubMed Abstract | CrossRef Full Text | Google Scholar
Kozar, M., Tonhajzerova, I., Mestanik, M., Matasova, K., Zibolen, M., Calkovska, A.,et al. (2018). 健康な正期産新生児の心拍変動は、分娩様式と関連している:前向き観察研究。 BMC Pregnancy Childbirth 18:264. doi: 10.1186/s12884-018-1900-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Laborde, S., Mosley, E., and Thayer, J. F. (2017). 心理生理学的研究における心拍変動と心臓迷走神経緊張-実験計画、データ解析、データ報告に関する推奨事項。 Front. Psychol. 8:1-18. doi: 10.3389/fpsyg.2017.00213
PubMed Abstract | CrossRef Full Text | Google Scholar
Lees, T., Shad-Kaneez, F., Simpson, A. M., Nassif, N. T., Lin, Y., and Lal, S. (2018). 脳卒中、脳卒中後の合併症、機能性を予測するためのバイオマーカーとしての心拍変動。 Biomark. Insights 13:117727191878693. doi: 10.1177271918786931
PubMed Abstract | CrossRef Full Text | Google Scholar
Longin, E., Schaible, T., Lenz, T. , and König, S. (2005). 健康な新生児における短期的な心拍変動:標準データと生理学的観察。 Early Hum. Dev. 81, 663-671. doi: 10.1016/j.earlhumdev.2005.03.015
PubMed Abstract | CrossRef Full Text | Google Scholar
Lucchini, M.Burtchen, N.Fifer, W.and Signorini, M. (2019). 出生時の後期早産児、早産児、完熟児におけるマルチパラメトリック心肺機能解析。 Med. Biol. Eng. Comput. 57, 99-106. doi: 10.1007/s11517-018-1866-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Makarov, L., Komoliatova, V., Zevald, S., Schmidt, G. , Muller, A., and Serebruany, V. (2010). 生後1~4日目の健康な新生児における24時間外来心電図モニタリング中のQT動態、マイクロボルトT波オルタナンス、および心拍変動。 J. Electrocardiol. 43, 8-14. doi: 10.1016/j.jelectrocard.2009.11.001
PubMed Abstract | CrossRef Full Text | Google Scholar
Mehta, S. K., Super, D. M., Connuck, D., Salvator, A., Singer, L., Fradley, L. G.ら(2002年). 健康な新生児における心拍変動。 Am. J. Cardiol. 89, 50-53. doi: 10.1016/S0002-9149(01)02162-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Mirmiran, M., Maas, Y. G. H., and Ariagno, R. L. (2003)(2013). 胎児・新生児期の睡眠と概日リズムの発達。 Sleep Med. Rev. 7, 321-334. doi: 10.1053/smrv.2002.0243
CrossRef Full Text | Google Scholar
Musa, S. M., Adam, I., Hassan, N. G., Rayis, D. A., and Lutfi, M. F.(2017). “胎児と新生児の睡眠と概日リズム”。 分娩第1期における母体心拍変動. Front. Physiol. 8:1-6. doi: 10.3389/fphys.2017.00774
CrossRef Full Text | Google Scholar
Nijhuis, J., Prescht’l, H., and Martin, C. (1982). ヒトの胎児に行動状態はあるのか? Early Hum. Dev. 6, 177-195. doi: 10.1016/0378-3782(82)90106-2
PubMed Abstract | CrossRef Full Text | Google Scholar
Oliveira, V., Martins, R., Liow, N., Teiserskas, J., Von Rosenberg, W., Adjei, T., et al(2018年). 新生児脳症における心拍変動解析の予後精度:系統的レビュー。 Neonatology 115, 59-67. doi: 10.1159/000493002
PubMed Abstract | CrossRef Full Text | Google Scholar
Peebles, D. M., Spencer, J. A. D. , Edwards, A. D., Wyatt, J. S., Reynolds, E. O., Cope, M. , et al. (1994). 近赤外分光法による陣痛時の子宮収縮頻度とヒト胎児脳内酸素飽和度の関係。 Br. J. Obstet. Gynaecol. 101, 44-48. doi: 10.1111/j.1471-0528.1994.tb13008.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Pomeranz, B., Macaulay, R. J., Caudill, M. A., Kutz, I., Adam, D., Gordon, D.、他 (1985). 心拍スペクトル解析によるヒトの自律神経機能の評価。 Am. J. Physiol. 248, H151-H153. doi: 10.1152/ajpheart.1985.248.1.H151
PubMed Abstract |Ref Full Text | Google Scholar
Reyes-Lagos, J. J…, Echeverría-Arjonilla, J. C., Peña-Castillo, M. Á, García-González, M. T., Ortiz-Pedroza Mdel, R., Pacheco-López, G., et al.(2015)。 妊娠第3期の女性および低リスク陣痛時の心拍変動の比較。 Physiol.Behav. 149, 255-261. doi: 10.1016/j.physbeh.2015.05.041
PubMed Abstract |Ref Full Text | Google Scholar
Riznyk、L.、Fijałkowska、M、およびPrzesmycki、K. (2005). フェンタニルを用いた全身麻酔導入時の心拍変動に対するチオペンタールおよびプロポフォールの効果。 Pharmacol. Rep. 57, 128-134. doi: 10.1103/PhysRevB.69.052404
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, U.Bode, F.Schmidt, A.Nowack, S.Rudolph, A.Doelcker, E. M., et al.(2018).の項参照。 胎児心拍変動の縦断的モニタリングにより明らかになった自律神経系の発達マイルストーン。 PLoS One 13:1-13. doi: 10.1371/journal.pone.0200799
PubMed Abstract | CrossRef Full Text | Google Scholar
Schwartz, P. J., Garson, A., Paul, T., Stramba-Badiale, M., Vetter, V. L., Villain, E.、他 (2002).All. 新生児心電図の解釈のためのガイドライン:欧州心臓病学会のタスクフォース(Guidelines for the interpretation of the neonatal electrocardiogram: a task force of the european society of cardiology. Eur. Heart J. 23, 1329-1344. doi: 10.1053/euhj.2002.3274
PubMed Abstract | CrossRef Full Text | Google Scholar
Shaffer, F., and Ginsberg, J.P. (2017). 心拍変動の指標と規範の概要。 Front. Public Heal. 5:1-17. doi: 10.3389/fpubh.2017.00258
PubMed Abstract | CrossRef Full Text | Google Scholar
Task Force of the European Society of Cardiology, and the North American Society of Pacing and Electrophysiology. (1996). 心拍変動-測定基準、生理学的解釈、および臨床的使用。 Eur. Heart J. 17, 354-381. doi: 10.1161/01.CIR.93.5.1043
CrossRef Full Text | Google Scholar
Temko, A., Doyle, O., Murray, D., Lightbody, G., Boylan, G., and Marnane, W. (2015). 低酸素虚血性脳症の新生児における神経発達転帰のマルチモーダル予測因子。 Comput. Biol. Med. 63, 169-177. doi: 10.1016/j.compbiomed.2015.05.017
PubMed Abstract | CrossRef Full Text | Google Scholar
Toichi, M., Sugiura, T., Murai, T.and Sengoku, A. (1997). 新しい心臓自律神経機能評価法とそのスペクトル解析およびR-R間隔の変動係数との比較. J. Auton. Nerv. Syst. 62, 79-84. doi: 10.1016/S0165-1838(96)00112-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Tsuchiya, S., Kanaya, N., Hirata, S., Kamada, N., Edanaga, M.and al. (2006). チオペンタルのbispectral indexと心拍変動に及ぼす影響. Eur. J. Anaesthesiol. 23, 454-459. doi: 10.1017/S0265021506000159
PubMed Abstract | CrossRef Full Text | Google Scholar
von Rosenberg, W., Chanwimalueang, T., Adjei, T., Jaffer, U. , Goverdovsky, V., and Mandic, D.P. (2017). LF/HF Ratioの曖昧さを解決する。 HRVから精神的・身体的ストレスの分類を行うためのLF-HF散布図。 Front. Physiol. 8:360. doi: 10.3389/fphys.2017.00360
PubMed Abstract | CrossRef Full Text | Google Scholar