In de begintijd van de organische chemie werden alkenen “onverzadigd” genoemd, omdat zij, in tegenstelling tot de “verzadigde” alkanen, gemakkelijk bleken te reageren met stoffen als halogenen, waterstofhalogeniden, oxidatiemiddelen, enzovoorts. Daarom werd de “chemische affiniteit” van alkenen als onbevredigd of “onverzadigd” beschouwd. (Zie ook Sectie 1-1I.)
Een van de redenen waarom alkenen en alkynen gemakkelijker reageren dan alkanen is omdat de koolstof-koolstof bindingen van een meervoudige binding afzonderlijk zwakker zijn dan normale koolstof-koolstof enkelvoudige bindingen. Denk aan de bindingsenergieën die hierbij betrokken zijn. Volgens tabel 4-3 zijn de sterkten van de enkelvoudige, dubbele en drievoudige koolstof-koolstofbindingen respectievelijk 83, 146 en 200 kBcal. Uit deze waarden kunnen we berekenen dat voor het splitsen van de helft van een dubbele koolstof-koolstof binding ongeveer 63: 30 en voor het splitsen van een derde van een drievoudige koolstof-koolstof binding ongeveer 54: 7742> Als gevolg hiervan zullen additiereacties op meervoudige bindingen naar verwachting ongeveer 20 tot 30 minuten duren:
Als gevolg hiervan zullen additiereacties op meervoudige bindingen naar verwachting ongeveer 20 tot 30 minuten duren:
Het grote verschil in reactiewarmte van ethaan, etheen en ethyne met broom wordt weerspiegeld in een zeer belangrijke praktische overweging bij het werken met ethyne (acetyleen), namelijk zijn thermodynamische stabiliteit ten opzichte van vaste koolstof en waterstofgas. In tegenstelling tot ethaan is zowel etheen als ethyne op basis van bindingsenergie instabiel ten opzichte van de vorming van vaste koolstof en gasvormige waterstof:
Hoewel dit bij etheen geen bijzondere problemen lijkt op te leveren, kan een explosieve ontleding van etheen tot koolstof en waterstof optreden als het gas wordt samengeperst tot een volume van 20: \: \kg cm}^{-2}). Zelfs met vloeibare etheen (bp 83) moet voorzichtig worden omgegaan. Ethyne wordt in de handel niet onder druk gebruikt, tenzij het met een inert gas is vermengd en in robuuste apparatuur wordt gehanteerd. Ethyne brandt met zuivere zuurstof om een zeer hete vlam te geven die veel voor lassen wordt gebruikt. Daartoe wordt het gas onder ongeveer 15 kg cm2 opgelost in 2-propanon (aceton, 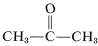 , bp 56,5) en in cilinders verpakt met diatomeeënaarde.
, bp 56,5) en in cilinders verpakt met diatomeeënaarde.
Waarom is ethyleen zoveel minder stabiel dan etheen of ethaan? Ten eerste zijn de C-C-bindingen niet zo sterk als de H-H-bindingen. Daarom is er meestal een stabiliteitswinst te verwachten als \ce{C-H} bindingen worden gemaakt ten koste van \ce{C-C}} bindingen; etheen en ethaan hebben elk meer \ce{C-H}} bindingen dan etheen heeft. Ten tweede heeft etheen zes elektronen tussen de twee koolstofatomen en deze elektronen ondervinden een aanzienlijke onderlinge interelektronische afstoting. Dit verklaart waarom de gemiddelde bindingssterkte voor de drievoudige binding van een alkyne 200/3 = 67 alkalibindingen is, vergeleken met 146/2 = 73 alkalibindingen voor de dubbele binding van een alkeen en 83 alkalibindingen voor een normale enkele binding van een alkaan.
- John D. Robert en Marjorie C. Caserio (1977) Basic Principles of Organic Chemistry, second edition. W. A. Benjamin, Inc. , Menlo Park, CA. ISBN 0-8053-8329-8. Deze inhoud is auteursrechtelijk beschermd onder de volgende voorwaarden: “You are granted permission for individual, educational, research and non-commercial reproduction, distribution, display and performance of this work in any format.”