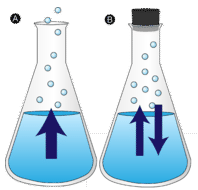
Verdamping
Een plas water die ongemoeid wordt gelaten, verdwijnt uiteindelijk. De vloeibare moleculen ontsnappen naar de gasfase en worden waterdamp. Verdampen is het proces waarbij een vloeistof wordt omgezet in een gas. Verdamping is de omzetting van een vloeistof in zijn damp beneden de kooktemperatuur van de vloeistof. Als het water in een gesloten vat wordt bewaard, krijgen de waterdampmoleculen geen kans om naar de omgeving te ontsnappen en verandert het waterniveau dus niet. Terwijl sommige watermoleculen verdampen, condenseert een even groot aantal waterdampmoleculen terug naar de vloeibare toestand. Condensatie is de verandering van toestand van een gas in een vloeistof.
Om een vloeistofmolecuul te laten ontsnappen naar de gastoestand, moet het molecuul voldoende kinetische energie hebben om de intermoleculaire aantrekkingskrachten in de vloeistof te overwinnen. Bedenk dat een gegeven vloeistofmonster moleculen zal bevatten met een breed scala aan kinetische energieën. Vloeistofmoleculen die deze bepaalde drempel kinetische energie hebben ontsnappen aan het oppervlak en worden damp. Als gevolg daarvan hebben de overblijvende vloeistofmoleculen nu een lagere kinetische energie. Wanneer de verdamping plaatsvindt, daalt de temperatuur van de overblijvende vloeistof. Je hebt de effecten van verdampingskoeling waargenomen. Op een warme dag absorberen de watermoleculen in je transpiratie lichaamswarmte en verdampen van het oppervlak van je huid. Het verdampingsproces laat de overgebleven transpiratie koeler achter, die op haar beurt meer warmte van je lichaam absorbeert.
Een bepaalde vloeistof zal sneller verdampen wanneer deze wordt verwarmd. Dit komt doordat het verhittingsproces ertoe leidt dat een grotere fractie van de moleculen van de vloeistof de nodige kinetische energie heeft om aan het oppervlak van de vloeistof te ontsnappen. Onderstaande figuur toont de kinetische energieverdeling van vloeistofmoleculen bij twee temperaturen. Het aantal moleculen dat de vereiste kinetische energie heeft om te verdampen, wordt getoond in het gearceerde gebied onder de kromme aan de rechterkant. De vloeistof met de hogere temperatuur heeft meer moleculen die in de dampfase kunnen ontsnappen dan de vloeistof met de lagere temperatuur

De Mount Everest in de Himalaya, op de grens tussen China en Nepal, is met zijn 29.029 voet het hoogste punt op aarde. De hoogte levert veel praktische problemen op voor klimmers. Het zuurstofgehalte van de lucht is veel lager dan op zeeniveau, waardoor het noodzakelijk is zuurstofflessen mee te nemen (hoewel enkele klimmers de top zonder zuurstof hebben bereikt). Een ander probleem is het koken van water voor het bereiden van voedsel. Terwijl water op zeeniveau bij 100 graden kookt, ligt het kookpunt op de top van de Mount Everest bij 70 graden. Dit verschil maakt het erg moeilijk om een fatsoenlijk kopje thee te zetten (wat sommige Britse klimmers zeker frustreerde).