Reële en Ideale Gassen
Een ideaal gas is een gas dat de gaswetten volgt onder alle omstandigheden van temperatuur en druk. Om dit te doen, zou het gas zich volledig moeten houden aan de kinetisch-moleculaire theorie. De gasdeeltjes zouden geen volume moeten innemen en zij zouden geen enkele aantrekkingskracht op elkaar moeten uitoefenen. Aangezien geen van deze voorwaarden waar kan zijn, bestaat er niet zoiets als een ideaal gas. Een echt gas is een gas dat zich niet gedraagt volgens de aannames van de kinetisch-moleculaire theorie. Gelukkig gedragen echte gassen zich bij de temperatuur en druk die men gewoonlijk in een laboratorium aantreft, meestal zeer goed als ideale gassen.
Onder welke omstandigheden gedragen gassen zich dan het minst ideaal? Wanneer een gas onder hoge druk wordt gezet, worden de moleculen dichter bij elkaar geduwd omdat de lege ruimte tussen de deeltjes kleiner wordt. Een afname van de lege ruimte betekent dat de veronderstelling dat het volume van de deeltjes zelf verwaarloosbaar is, minder geldig is. Wanneer een gas wordt afgekoeld, zorgt de afname van de kinetische energie van de deeltjes ervoor dat ze langzamer gaan bewegen. Als de deeltjes met lagere snelheid bewegen, zijn de aantrekkingskrachten tussen hen prominenter aanwezig. Een andere manier om het te bekijken is dat voortdurende afkoeling van het gas het uiteindelijk in een vloeistof zal veranderen en een vloeistof is zeker geen ideaal gas meer (zie vloeibare stikstof in de figuur hieronder). Samenvattend: een echt gas wijkt het meest af van een ideaal gas bij lage temperaturen en hoge drukken. Gassen zijn het meest ideaal bij hoge temperatuur en lage druk.

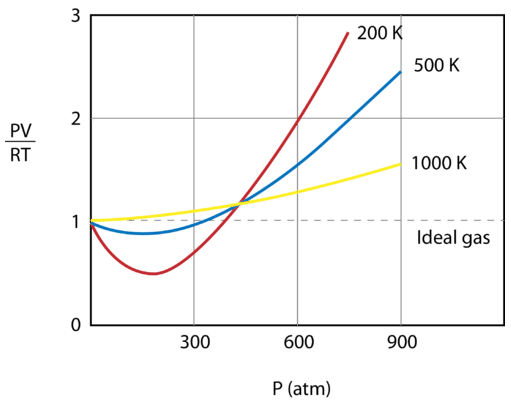
De figuur hieronder toont een grafiek van \(\frac{PV}{RT}\) uitgezet tegen de druk voor \(1 \: \text{mol}\) van een gas bij drie verschillende temperaturen – \(200 \: \text{K}\), \(500 \: \text{K}\), en 1000 \: \…en 1000. Een ideaal gas zou bij alle temperaturen en drukken een waarde van 1 voor die verhouding hebben en de grafiek zou gewoon een horizontale lijn zijn. Zoals te zien is, zijn er afwijkingen van een ideaal gas. Als de druk begint te stijgen, zorgen de aantrekkingskrachten ervoor dat het volume van het gas kleiner is dan verwacht en dat de waarde van de verhouding kleiner wordt dan 1. Als de druk blijft toenemen, wordt het volume van de deeltjes groter en stijgt de waarde van \(\frac{PV}{RT}}) tot boven 1. Merk op dat de afwijkingen van de idealiteit het grootst zijn voor het gas bij 200 K en het kleinst voor het gas bij 1000 K.
De idealiteit van een gas hangt ook af van de sterkte en het type van de intermoleculaire aantrekkingskrachten die tussen de deeltjes bestaan. Gassen met zwakke aantrekkingskrachten zijn idealer dan gassen met sterke aantrekkingskrachten. Bij dezelfde temperatuur en druk is neon idealer dan waterdamp omdat de atomen van neon alleen worden aangetrokken door zwakke dispersiekrachten, terwijl de moleculen van waterdamp worden aangetrokken door relatief sterkere waterstofbruggen. Helium is een idealer gas dan neon omdat het kleinere aantal elektronen betekent dat de dispersiekrachten van helium nog zwakker zijn dan die van neon.