Bindingsterkte: Covalente bindingen
Stabiele moleculen bestaan omdat covalente bindingen de atomen bij elkaar houden. We meten de sterkte van een covalente binding aan de hand van de energie die nodig is om ze te verbreken, dat wil zeggen, de energie die nodig is om de gebonden atomen te scheiden. Voor het scheiden van een paar gebonden atomen is energie nodig; hoe sterker een binding, hoe groter de energie die nodig is om hem te verbreken. De energie die nodig is om een bepaalde covalente binding in een mol gasmoleculen te verbreken, wordt de bindingsenergie of de bindingsdissociatie-energie genoemd. De bindingsenergie voor een diatomisch molecuul, (D_{X-Y}), wordt gedefinieerd als de standaard enthalpieverandering voor de endotherme reactie:
Bij voorbeeld, de bindingsenergie van de zuivere covalente H-H binding, (Delta_{H-H}), is 436 kJ per mol verbroken H-H bindingen:
Het verbreken van een binding vereist altijd energie die aan het molecuul moet worden toegevoegd. Bij het maken van een binding komt altijd energie vrij.
Moleculen met drie of meer atomen hebben twee of meer bindingen. De som van alle bindingsenergieën in zo’n molecuul is gelijk aan de standaard enthalpieverandering voor de endotherme reactie waarbij alle bindingen in het molecuul worden verbroken. Bijvoorbeeld, de som van de vier C-H bindingsenergieën in CH4, 1660 kJ, is gelijk aan de standaard enthalpieverandering van de reactie:
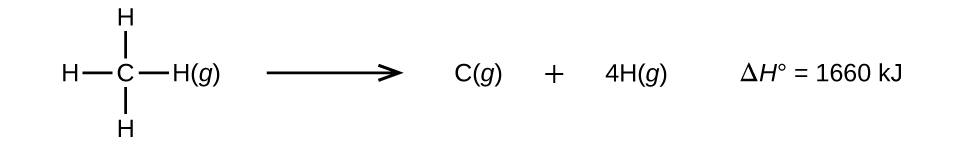
De gemiddelde C-H bindingsenergie, (D_{C-H}), is 1660/4 = 415 kJ/mol omdat er vier mol C-H bindingen per mol van de reactie worden verbroken. Hoewel de vier C-H bindingen in het oorspronkelijke molecuul gelijkwaardig zijn, hebben ze niet elk dezelfde energie nodig om te verbreken; zodra de eerste binding is verbroken (waarvoor 439 kJ/mol nodig is), zijn de resterende bindingen gemakkelijker te verbreken. De waarde van 415 kJ/mol is het gemiddelde, niet de exacte waarde die nodig is om een binding te verbreken.
De sterkte van een binding tussen twee atomen neemt toe naarmate het aantal elektronenparen in de binding toeneemt. In het algemeen neemt de lengte van de binding af naarmate de sterkte van de binding toeneemt. Zo vinden we dat drievoudige bindingen sterker en korter zijn dan dubbele bindingen tussen dezelfde twee atomen; evenzo zijn dubbele bindingen sterker en korter dan enkele bindingen tussen dezelfde twee atomen. De gemiddelde bindingsenergie voor een aantal veel voorkomende bindingen staat in tabel (Pagina-index 2), en een vergelijking van bindingslengtes en -sterkten voor een aantal veel voorkomende bindingen staat in tabel (Pagina-index 2). Wanneer een atoom bindt aan verschillende atomen in een groep, neemt de bindingssterkte meestal af naarmate we lager in de groep komen. Bijvoorbeeld, C-F is 439 kJ/mol, C-Cl is 330 kJ/mol, en C-Br is 275 kJ/mol.
| Bond | Bondsenergie | Bond | Bondsenergie | Bond | Bondsenergie | Bondsenergie | |
|---|---|---|---|---|---|---|---|
| H-H | 436 | C-S | 260 | F-Cl | 255 | ||
| H-C | 415 | C-Cl | 330 | F-Br | 235 | ||
| H-N | 390 | C-Br | 275 | Si-Si | 230 | ||
| H-O | 464 | C-I | 240 | Si-P | 215 | ||
| H-F | 569 | N | 160 | Si-S | 225 | ||
| H-Si | 395 | (\mathrm{N=N}) | 418 | Si-Cl | 359 | ||
| H-P | 320 | (\mathrm{N≡N}) | 946 | Si-Br | 290 | ||
| H-S | 340 | N-O | 200 | Si-I | 215 | ||
| H-Cl | 432 | N-F | 270 | P-P | 215 | ||
| H-Br | 370 | N-P | 210 | P-S | 230 | ||
| H-I | 295 | N-Cl | 200 | P-Cl | 330 | ||
| C-C | 345 | N-Br | 245 | P-Br | 270 | ||
| (\mathrm{C=C}}) | 611 | O-O | 140 | P-I | 215 | ||
| (\mathrm{C≡C}) | 837 | (\mathrm{O=O}) | 498 | S | 215 | ||
| C-N | 290 | O-F | 160 | S-Cl | 250 | ||
| (\mathrm{C=N}}) | 615 | O-Si | 370 | S-Br | 215 | ||
| (\mathrm{C≡N}}) | 891 | O-P | 350 | Cl-Cl | 243 | ||
| C-O | 350 | O-Cl | 205 | Cl-Br | 220 | ||
| (\mathrm{C=O}) | 741 | O-I | 200 | Cl-I | 210 | ||
| (\mathrm{C≡O}) | 1080 | F-F | 160 | Br-Br | 190 | ||
| C-F | 439 | F-Si | 540 | Br-I | 180 | ||
| C-Si | 360 | F-P | 489 | I-I | 150 | ||
| C-P | 265 | F-S | 285 |
| Bond | bindingslengte (Å) | bindingsenergie (kJ/mol) |
|---|---|---|
| C-C | 1.54 | 345 |
| (\mathrm{C=C}}) | 1.34 | 611 |
| (\mathrm{C≡C}) | 1.20 | 837 |
| C-N | 1.43 | 290 |
| (\mathrm{C=N}}) | 1.38 | 615 |
| (\mathrm{C≡N}) | 1.16 | 891 |
| C-O | 1.43 | 350 |
| (\mathrm{C=O}}) | 1.23 | 741 |
| (\mathrm{C≡O}) | 1.13 | 1080 |
We kunnen bindingsenergieën gebruiken om bij benadering enthalpieveranderingen te berekenen voor reacties waar enthalpie’s van vorming niet beschikbaar zijn. Uit dit soort berekeningen kunnen we ook afleiden of een reactie exotherm of endotherm is.
- Een exotherme reactie (ΔH negatief, geproduceerde warmte) ontstaat wanneer de bindingen in de producten sterker zijn dan die in de reactanten.
- Een endotherme reactie (ΔH positief, geabsorbeerde warmte) ontstaat wanneer de bindingen in de producten zwakker zijn dan die in de reactanten.
De enthalpieverandering, ΔH, voor een chemische reactie is ongeveer gelijk aan de som van de energie die nodig is om alle bindingen in de reactanten te verbreken (energie “in”, positief teken) plus de energie die vrijkomt wanneer alle bindingen in de producten worden gevormd (energie “uit”, negatief teken). Wiskundig kan dit als volgt worden uitgedrukt:
In deze uitdrukking betekent het symbool “de som van” en D staat voor de bindingsenergie in kilojoule per mol, wat altijd een positief getal is. De bindingsenergie wordt verkregen uit een tabel en zal afhangen van het feit of de betreffende binding een enkelvoudige, dubbele of drievoudige binding is. Bij de berekening van enthalpiecoëfficiënten op deze manier is het dus belangrijk dat we de binding in alle reactanten en producten in aanmerking nemen. Omdat D-waarden meestal gemiddelden zijn voor één type binding in veel verschillende moleculen, geeft deze berekening een ruwe schatting, geen exacte waarde, voor de enthalpie van de reactie.
Bedenk de volgende reactie:
of
Om twee mol HCl te vormen, moet één mol H-H bindingen en één mol Cl-Cl bindingen worden verbroken. De energie die nodig is om deze bindingen te verbreken is de som van de bindingsenergie van de H-H binding (436 kJ/mol) en de Cl-Cl binding (243 kJ/mol). Tijdens de reactie worden twee mol H-Cl bindingen gevormd (bindingsenergie = 432 kJ/mol), waarbij 2 × 432 kJ vrijkomt; ofwel 864 kJ. Omdat de bindingen in de producten sterker zijn dan die in de reactanten, komt bij de reactie meer energie vrij dan er verbruikt wordt:
-2D_{H-Cl}}
&={-2(432)=-185:kJ}
Deze overtollige energie komt als warmte vrij, dus de reactie is exotherm. Tabel T2 geeft een waarde voor de standaard molaire enthalpie van de vorming van HCl(g), ƒ(ΔH^circ_ce f), van -92,307 kJ/mol. Twee keer die waarde is -184,6 kJ, wat goed overeenkomt met het eerder verkregen antwoord voor de vorming van twee mol HCl.
Voorbeeld: Using Bond Energies to Approximate Enthalpy Changes
Methanol, CH3OH, may be an excellent alternative fuel. Bij de hoge-temperatuurreactie van stoom en koolstof ontstaat een mengsel van de gassen koolmonoxide, CO, en waterstof, H2, waaruit methanol kan worden gemaakt. Bereken met behulp van de bindingsenergieën in tabel ΔH bij benadering de enthalpieverandering, ΔH, voor de reactie hier:
Oplossing
Voreerst moeten we de Lewisstructuren van de reactanten en de producten schrijven:
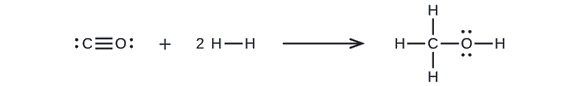
Hieruit zien we dat ΔH voor deze reactie de energie omvat die nodig is om een C-O drievoudige binding en twee H-H enkelvoudige bindingen te verbreken, alsmede de energie die vrijkomt bij de vorming van drie C-H enkelvoudige bindingen, een C-O enkelvoudige binding en een O-H enkelvoudige binding. We kunnen dit als volgt uitdrukken (via Vergelijking \ref{EQ3}):
-}
end {align*}]
Met behulp van de bindingsenergiewaarden in Tabel \(\PageIndex{2}}) krijgen we:
&={-107:kJ}
>-eind {align*}]
We kunnen deze waarde vergelijken met de waarde die berekend is op basis van de gegevens van ΔH^irc_ce f:¢(ΔH^circ_ce f) uit Appendix G:
&=-\7367>&=mathrm{-90.5:kJ}
>end {align*}
Merk op dat er een vrij groot verschil is tussen de waarden die met de twee verschillende methoden zijn berekend. Dit komt omdat D-waarden het gemiddelde zijn van verschillende bindingssterkten; daarom geven ze vaak slechts een ruwe overeenkomst met andere gegevens.
Oefening (PaginaIndex{1})
Ethylalcohol, CH3CH2OH, was een van de eerste organische chemische stoffen die door mensen opzettelijk werden gesynthetiseerd. Het heeft vele toepassingen in de industrie, en het is de alcohol in alcoholische dranken. Het kan worden verkregen door de fermentatie van suiker of worden gesynthetiseerd door de hydratatie van ethyleen in de volgende reactie:

Bereken met behulp van de bindingsenergieën in tabel (\PageIndex{2}) een geschatte enthalpieverandering, ΔH, voor deze reactie.
Samenvatting
Video \(\PageIndex{2}\): Een overzicht van atoombindingen.
Covalente bindingen worden gevormd wanneer elektronen worden gedeeld tussen atomen en worden aangetrokken door de kernen van beide atomen. Bij zuivere covalente bindingen worden de elektronen gelijkelijk gedeeld. Bij polaire covalente bindingen worden de elektronen ongelijk verdeeld, omdat het ene atoom een sterkere aantrekkingskracht uitoefent op de elektronen dan het andere.
De sterkte van een covalente binding wordt gemeten aan de hand van de dissociatie-energie van de binding, dat wil zeggen, de hoeveelheid energie die nodig is om die specifieke binding in een molecuul moleculen te verbreken. Meervoudige bindingen zijn sterker dan enkelvoudige bindingen tussen dezelfde atomen. De enthalpie van een reactie kan worden geschat op basis van de energie-input die nodig is om bindingen te verbreken en de energie die vrijkomt wanneer nieuwe bindingen worden gevormd.
Key Equations
- Bindingsenergie voor een diatomisch molecuul: \(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Enthalpy change: ΔH = ƩVerbindingen verbroken – ƩVerbindingen gevormd
Voetnoten
- Deze vraag is afkomstig uit het Advanced Placement Examen Scheikunde en wordt gebruikt met toestemming van de Educational Testing Service.
Glossary
bindingsenergie (ook, bindingsdissociatie-energie) energie die nodig is om een covalente binding in een gasvormige stof te verbreken
Contributors
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) en Richard Langley (Stephen F. Austin State University) met bijdragende auteurs. Tekstboekinhoud geproduceerd door OpenStax College is gelicenseerd onder een Creative Commons Naamsvermelding Licentie 4.0 licentie. Gratis te downloaden op http://cnx.org/contents/85abf193-2bd…[email protected]).
- Adelaide Clark, Oregon Institute of Technology
- Fuse School, Open Educational Resource gratis, onder een Creative Commons-licentie: Naamsvermelding-NietCommercieel CC BY-NC (Bekijk Licentieakte: https://creativecommons.org/licenses/by-nc/4.0/)
- Crash Course Chemistry: Crash Course is een divisie van Complexly en video’s zijn gratis te streamen voor educatieve doeleinden.
Feedback
Heeft u feedback te geven over deze tekst? Klik hier.
Een typefout gevonden en extra krediet nodig? Klik hier.