Editor-in-Chief: C. Michael Gibson, M.S., M.D. ; Medewerkend hoofdredacteur(s)/hoofdredacteuren: Aparna Vuppala, M.B.B.S.
Disclaimer
WikiDoc GEEFT GEEN GARANTIE VAN GELDIGHEID. WikiDoc is geen professionele zorgverlener, noch is het een geschikte vervanging voor een erkende zorgverlener. WikiDoc is bedoeld als een educatief hulpmiddel, niet als een hulpmiddel voor enige vorm van zorgverlening. De educatieve inhoud op WikiDoc medicijnpagina’s is gebaseerd op de bijsluiter van de FDA, inhoud van de National Library of Medicine en praktijkrichtlijnen / consensusverklaringen. WikiDoc promoot niet de toediening van medicijnen of apparaten die niet in overeenstemming zijn met de etikettering. Lees hier onze volledige disclaimer.
Overzicht
Butalbital is een combinatie die door de FDA is goedgekeurd voor de behandeling van voor de verlichting van het symptomencomplex van spanningshoofdpijn (of spiercontractie). Veel voorkomende bijwerkingen zijn onder meer duizeligheid en gastro-intestinale stoornissen waaronder misselijkheid, braken en winderigheid, toxische epidermale necrolyse en erythema multiforme.
Indicaties en dosering voor volwassenen
FDA-goedgekeurde indicaties en doseringen (volwassenen)
Hoofdpijn
- Butalbital, aspirine en cafeïne tabletten zijn geïndiceerd voor de verlichting van het symptomencomplex van spanningshoofdpijn (of spiersamentrekkingen).
- Er is geen bewijs ter ondersteuning van de werkzaamheid en veiligheid van butalbital, aspirine en cafeïne bij de behandeling van meervoudig terugkerende hoofdpijn. Voorzichtigheid is hier geboden omdat butalbital een gewoontevormend middel is dat mogelijk kan worden misbruikt.
Off-Label gebruik en dosering (volwassenen)
Guideline-ondersteund gebruik
Er is beperkte informatie over Off-Label Guideline-ondersteund gebruik van butalbital bij volwassen patiënten.
Niet door de richtlijn ondersteund gebruik
Er is beperkte informatie over het Off-Label niet door de richtlijn ondersteund gebruik van Butalbital bij volwassen patiënten.
Pediatrische indicaties en dosering
Door de FDA gelabelde indicaties en doseringen (pediatrisch)
Er is beperkte informatie over het door de FDA gelabelde gebruik van Butalbital bij pediatrische patiënten.
Off-Label gebruik en dosering (pediatrisch)
Guideline-ondersteund gebruik
Er is beperkte informatie over Off-Label, Guideline-ondersteund gebruik van Butalbital bij pediatrische patiënten.
Niet door richtlijnen ondersteund gebruik
Er is beperkte informatie over off-label niet door richtlijnen ondersteund gebruik van Butalbital bij pediatrische patiënten.
Contra-indicaties
- Overgevoeligheid voor aspirine, cafeïne of barbituraten. Patiënten met porfyrie.
Waarschuwingen
Drugsafhankelijkheid:
- Langdurig gebruik van barbituraten kan leiden tot drugsafhankelijkheid, gekenmerkt door psychische afhankelijkheid, en minder vaak, lichamelijke afhankelijkheid en tolerantie. De misbruikverantwoordelijkheid van butalbital, aspirine en cafeïne is vergelijkbaar met die van andere barbituraat-bevattende geneesmiddelencombinaties. Voorzichtigheid is geboden bij het voorschrijven van medicatie aan patiënten met een bekende neiging tot het innemen van excessieve hoeveelheden geneesmiddelen, hetgeen niet ongewoon is bij patiënten met chronische spanningshoofdpijn.
Gebruik bij ambulante patiënten:
- Butalbital, aspirine en cafeïne kunnen de geestelijke en/of lichamelijke vermogens aantasten die vereist zijn voor het uitvoeren van potentieel gevaarlijke taken, zoals het besturen van een auto of het bedienen van machines. De patiënt moet dienovereenkomstig worden gewaarschuwd. De depressieve effecten van butalbital op het centraal zenuwstelsel kunnen additief zijn met die van andere depressiva voor het centraal zenuwstelsel. Gelijktijdig gebruik met andere sedativa-hypnotica of alcohol dient te worden vermeden. Wanneer een dergelijke gecombineerde therapie noodzakelijk is, kan het nodig zijn de dosis van een of meer middelen te verlagen.
Voorzorgsmaatregelen
- Salicylaten dienen met uiterste voorzichtigheid te worden gebruikt bij aanwezigheid van een maagzweer of stollingsafwijkingen.
Bijwerkingen
Ervaringen met klinische proeven
- De meest voorkomende bijwerkingen zijn slaperigheid en duizeligheid. Minder vaak voorkomende bijwerkingen zijn duizeligheid en gastro-intestinale stoornissen zoals misselijkheid, braken en flatulentie. Een enkel geval van beenmergsuppressie is gemeld bij het gebruik van butalbital, aspirine en cafeïne. Er zijn verscheidene gevallen van dermatologische reacties gemeld, waaronder toxische epidermale necrolyse en erythema multiforme.
Postmarketingervaring
Er is beperkte informatie over Postmarketingervaring van Butalbital in het geneesmiddellabel.
Gedragsinteracties
Er is beperkte informatie over Butalbital Drug Interactions in het geneesmiddeletiket.
Gebruik bij specifieke populaties
Zwangerschap
Zwangerschapscategorie (FDA): C
- Er is onvoldoende onderzoek verricht bij dieren om te bepalen of dit geneesmiddel de vruchtbaarheid bij mannetjes of vrouwtjes beïnvloedt, teratogeen potentieel heeft, of andere nadelige effecten heeft op de foetus. Hoewel er geen goed gecontroleerde studies bij zwangere vrouwen zijn, bevat meer dan twintig jaar marketing- en klinische ervaring geen positief bewijs van nadelige effecten op de foetus. Hoewel er geen duidelijk omschreven risico is, kan op grond van deze ervaring de mogelijkheid van incidentele of subtiele schade aan de menselijke foetus niet worden uitgesloten. Butalbital, aspirine en cafeïne mogen bij zwangere vrouwen alleen worden gebruikt wanneer dit duidelijk nodig is.
Zwangerschapscategorie (AUS): Er zijn geen richtlijnen van de Australian Drug Evaluation Committee (ADEC) voor het gebruik van Butalbital bij zwangere vrouwen.
Labor and Delivery
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital tijdens de bevalling.
Nursing Mothers
- De effecten van butalbital, aspirine en cafeïne op zuigelingen van zogende moeders zijn niet bekend. Salicylaten en barbituraten worden uitgescheiden in de moedermelk van zogende moeders. De serumniveaus bij zuigelingen worden verondersteld niet significant te zijn bij therapeutische doses.
Pediatrisch gebruik
- Veiligheid en werkzaamheid bij pediatrische patiënten jonger dan 12 jaar zijn niet vastgesteld.
Geriatisch gebruik
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital bij geriatrische patiënten.
Gender
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital bij specifieke geslachtspopulaties.
Race
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital bij specifieke raciale bevolkingsgroepen.
Renal Impairment
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital bij patiënten met een nierfunctiestoornis.
Hepatic Impairment
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital bij patiënten met een leverfunctiestoornis.
Vrouwen in de vruchtbare leeftijd en mannen
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital bij vrouwen in de vruchtbare leeftijd en mannen.
Geïmmuniseerde patiënten
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital bij patiënten in de vruchtbare leeftijd en mannen.
Geïmmuniseerde patiënten
Er zijn geen FDA-richtlijnen voor het gebruik van Butalbital bij patiënten in de vruchtbare leeftijd.
Toediening en monitoring
Toediening
- Oraal
Monitoring
Er is beperkte informatie over Monitoring van Butalbital in het geneesmiddellabel.
IV-compatibiliteit
Er is beperkte informatie over IV-compatibiliteit van butalbital in het geneesmiddeletiket.
Overdosering
- De toxische effecten van acute overdosering van butalbital, aspirine en cafeïne zijn voornamelijk toe te schrijven aan de barbituraatcomponent en, in mindere mate, aspirine. Omdat de toxische effecten van cafeïne alleen in zeer hoge doseringen optreden, is de mogelijkheid van significante cafeïnegiftigheid door overdosering van butalbital, aspirine en cafeïne onwaarschijnlijk. Symptomen van acute barbituraatvergiftiging zijn slaperigheid, verwardheid en coma; ademhalingsdepressie; hypotensie; shock. Symptomen die kunnen worden toegeschreven aan acute aspirinevergiftiging zijn hyperpneu; zuur-basestoornissen met ontwikkeling van metabole acidose; braken en buikpijn; tinnitus; hyperthermie; hypoprothrombinemie; rusteloosheid; delirium; convulsies. Acute cafeïnevergiftiging kan slapeloosheid, rusteloosheid, tremor en delirium veroorzaken; tachycardie en extrasystolen. De behandeling bestaat voornamelijk uit het beheersen van de barbituraatvergiftiging en het corrigeren van het zuur-base-evenwicht als gevolg van salicylose. Braken moet mechanisch of met braakmiddelen worden geïnduceerd bij de patiënt bij bewustzijn. Maagspoeling kan worden toegepast als de faryngeale en laryngeale reflexen aanwezig zijn en als er minder dan 4 uur is verstreken sinds de inname. Een gebufferde endotracheale buis moet worden ingebracht vóór lavage van de maag van de bewusteloze patiënt en wanneer dit nodig is voor ondersteunde beademing. Diurese, alkaliniseren van de urine en correctie van elektrolytstoornissen moeten worden bereikt door toediening van intraveneuze vloeistoffen zoals 1% natriumbicarbonaat in 5% dextrose in water. Zorgvuldige aandacht moet worden besteed aan het handhaven van een adequate longventilatie. Correctie van hypotensie kan de toediening van levartherenolbitartraat of fenylefrinehydrochloride via intraveneuze infusie noodzakelijk maken. In ernstige gevallen van intoxicatie kunnen peritoneale dialyse, hemodialyse of wisseltransfusie levensreddend zijn. Hypoprothrombinemie dient te worden behandeld met vitamine K, intraveneus.
Er is beperkte informatie met betrekking tot Chronische overdosering van Butalbital in het geneesmiddeletiket.
Farmacologie
Er is beperkte informatie met betrekking tot Butalbital Farmacologie in het geneesmiddeletiket.
Werkingsmechanisme
- Pharmacologisch gezien combineert butalbital, aspirine en cafeïne de pijnstillende eigenschappen van aspirine met de anxiolytische en spierverslappende eigenschappen van butalbital.
De klinische werkzaamheid van butalbital, aspirine en cafeïne bij spanningshoofdpijn is vastgesteld in dubbelblind, placebogecontroleerd, multiclinisch onderzoek. Een factorial design studie vergeleek butalbital, aspirine, en cafeïne met elk van de hoofdbestanddelen. Deze studie toonde aan dat elk bestanddeel bijdraagt aan de werkzaamheid van butalbital, aspirine en cafeïne bij de behandeling van de doelsymptomen van spanningshoofdpijn (hoofdpijn, psychische spanning, en spiercontractie in het hoofd-, nek- en schoudergebied). Voor elk symptoom en het symptomencomplex als geheel werd aangetoond dat butalbital, aspirine en cafeïne significant betere klinische effecten hebben dan elk van de componenten alleen.
Structuur
- Het gedrag van de afzonderlijke bestanddelen wordt hieronder beschreven.
- De systemische beschikbaarheid van aspirine na een orale dosis is sterk afhankelijk van de doseringsvorm, de aanwezigheid van voedsel, de maagledigingstijd, de pH-waarde van de maag, maagzuurremmers, buffermiddelen en de deeltjesgrootte. Deze factoren hebben niet noodzakelijkerwijs invloed op de mate van absorptie van de totale hoeveelheid salicylaten, maar meer op de stabiliteit van aspirine vóór de absorptie.
- Tijdens het absorptieproces en na de absorptie wordt aspirine voornamelijk gehydrolyseerd tot salicylzuur en verdeeld over alle lichaamsweefsels en -vloeistoffen, met inbegrip van foetaal weefsel, moedermelk en het centrale zenuwstelsel (CZS). De hoogste concentraties worden aangetroffen in plasma, lever, niercortex, hart en longen. In plasma is ongeveer 50%-80% van het salicylzuur en zijn metabolieten losjes gebonden aan plasma-eiwitten.
- De klaring van totale salicylaten is onderhevig aan een saturabele kinetiek; de eerste-orde eliminatiekinetiek is echter nog steeds een goede benadering voor doses tot 650 mg. De plasmahalfwaardetijd voor aspirine is ongeveer 12 minuten en voor salicylzuur en/of totale salicylaten is ongeveer 3,0 uur.
- De eliminatie van therapeutische doses vindt plaats via de nieren in de vorm van salicylzuur of andere biotransformatieproducten. De renale klaring wordt sterk bevorderd door een alkalische urine, zoals die wordt geproduceerd door gelijktijdige toediening van natriumbicarbonaat of kaliumcitraat.
- De biotransformatie van aspirine vindt voornamelijk plaats in de hepatocyten. De belangrijkste metabolieten zijn salicylurinezuur (75%), de fenol- en acylglucuroniden van salicylaat (15%), en gentisinezuur en gentisurinezuur (1%). De biologische beschikbaarheid van de aspirinecomponent butalbital, aspirine en cafeïne is gelijkwaardig aan die van een oplossing, behalve dat de absorptiesnelheid langzamer is. Een piekconcentratie van 8,80 mcg/mL werd 40 minuten na een dosis van 650 mg verkregen.
- Butalbital wordt goed geabsorbeerd uit het maagdarmkanaal en zal zich naar verwachting over de meeste weefsels in het lichaam verspreiden. Barbituraten kunnen in het algemeen in moedermelk voorkomen en passeren gemakkelijk de placentabarrière. Ze worden in uiteenlopende mate gebonden aan plasma- en weefseleiwitten en de binding neemt direct toe als functie van de lipideoplosbaarheid.
- Eliminatie van butalbital vindt voornamelijk plaats via de nieren (59%-88% van de dosis) in de vorm van onveranderd geneesmiddel of metabolieten. De plasmahalfwaardetijd bedraagt ongeveer 35 uur. Urinaire excretieproducten omvatten het oorspronkelijke geneesmiddel (ongeveer 3,6% van de dosis), 5-isobutyl-5-(2,3-dihydroxypropyl)barbituurzuur (ongeveer 24% van de dosis), 5-allyl-5(3-hydroxy-2-methyl-1-propyl)barbituurzuur (ongeveer 4,8% van de dosis), producten met de barbituurzuurring gehydrolyseerd met excretie van ureum (ongeveer 14% van de dosis), alsmede niet-geïdentificeerde materialen. Van het in de urine uitgescheiden materiaal was 32% geconjugeerd.
- De biologische beschikbaarheid van de butalbitalcomponent van butalbital, aspirine en cafeïne is gelijkwaardig aan die van een oplossing, afgezien van een afname van de absorptiesnelheid. Een piekconcentratie van 2020 ng/mL wordt ongeveer 1,5 uur na een dosis van 100 mg bereikt.
- De in vitro plasma-eiwitbinding van butalbital is 45% over het concentratiebereik van 0,5 tot 20 mcg/mL. Dit valt binnen het bereik van de plasma-eiwitbinding (20% tot 45%) die is gerapporteerd met andere barbituraten zoals fenobarbital, pentobarbital en secobarbitalnatrium. De verhouding plasma/bloedconcentratie was bijna eenparig, wat erop wijst dat er geen preferentiële verdeling van butalbital in plasma of bloedcellen plaatsvindt. (zie OVERDOSERING voor informatie over toxiciteit).
- Zoals de meeste xanthines wordt cafeïne snel geabsorbeerd en gedistribueerd in alle lichaamsweefsels en -vloeistoffen, met inbegrip van het CZS, foetale weefsels en moedermelk.
- Caffeïne wordt snel geklaard door metabolisme en uitscheiding in de urine. De plasmahalfwaardetijd bedraagt ongeveer 3,0 uur. Hepatische biotransformatie voorafgaand aan de uitscheiding resulteert in ongeveer gelijke hoeveelheden 1-methyl-xanthine en 1-methyluurzuur. Van de 70% van de dosis die in de urine is teruggevonden, was slechts 3% onveranderd geneesmiddel.
- De biologische beschikbaarheid van de cafeïnecomponent voor butalbital, aspirine en cafeïne is gelijk aan die van een oplossing, met uitzondering van een iets langere tijd tot de piek. Een piekconcentratie van 1660 ng/mL werd verkregen in minder dan een uur voor een dosis van 80 mg
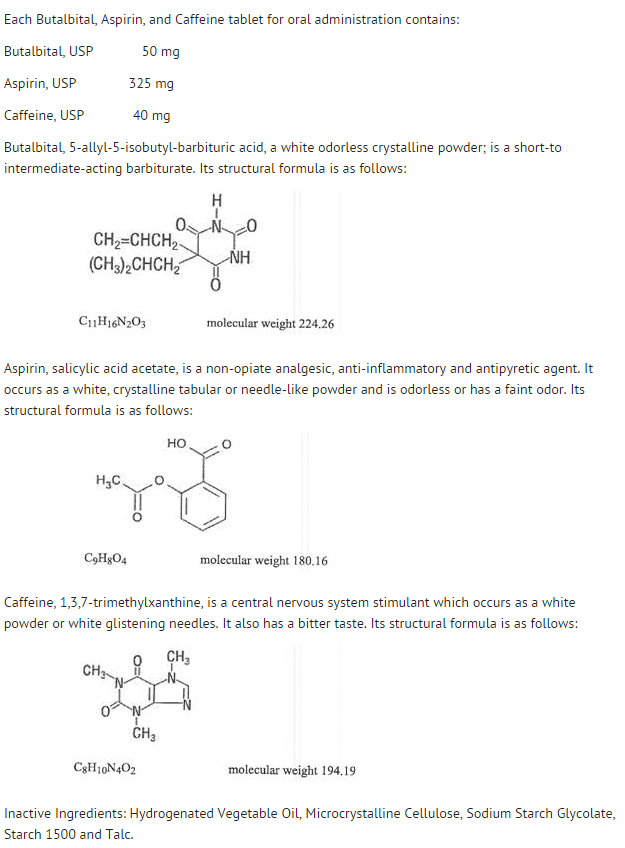
- Butalbital, Aspirine, en Cafeïne Tabletten, USP 50 mg/325 mg/40 mg zijn witte, ronde, niet gescoorde, samengedrukte tabletten met de opdruk “West-ward 785”.
- Bewaren bij 20-25oC (68-77oF) . Beschermen tegen licht en vocht.
- Doseren in dichte, lichtbestendige verpakking zoals gedefinieerd in de USP met een kindveilige sluiting.
- Een wisselwerking tussen alcohol en Butalbital is niet vastgesteld. Overleg met uw arts over de effecten van het gebruik van alcohol in combinatie met deze medicatie.
Farmacodynamiek
Er is beperkte informatie over de farmacodynamiek van Butalbital in het etiket van het geneesmiddel.
Farmacokinetiek
Aspirine:
Butalbital:
Cafeïne:
Nonklinische toxicologie
Er is beperkte informatie met betrekking tot niet-klinische toxicologie van Butalbital in het geneesmiddeletiket.
Klinische studies
Er is beperkte informatie met betrekking tot klinische studies van Butalbital in het geneesmiddeletiket.
Hoe geleverd
Flessen van 30 tablettenFlessen van 50 tablettenFlessen van 100 tablettenFlessen van 500 tablettenFlessen van 1000 tablettenVerpakkingen met 100 tabletten
Opslag
Er is beperkte informatie over de opslag van Butalbital in het etiket van het geneesmiddel.
Images
Drug Images
Drug Name: Butalbital, Acetaminophen and Caffeine
Ingrediënt(en): BUTALBITAL, ACETAMINOPHEN, CAFFEINE
Imprint: West;ward;787
Dosering: 50 mg
Kleur(en): Blauw
Vorm: Rond
Grootte (mm): 11
Score: 1
NDC:01431787
Drogisterijetiket Auteur: West-Ward Pharmaceutical Corp
Deze pilafbeelding is afkomstig van de National Library of Medicine’s PillBox.

Drugsnaam: Butalbital, Aspirine en Cafeïne
Ingrediënt(en): BUTALBITAL, ASPIRINE, CAFFEINE
Imprint: Westward;785
Dosering: 50 mg
Kleur(en): Wit
Vorm: Rond
Grootte (mm): 11
Score: 1
NDC:01431785
Geneesmiddelenetiket Auteur: West-ward Pharmaceutical Corp
Deze pilafbeelding is afkomstig van de National Library of Medicine’s PillBox.

Drugsnaam: Butalbital, Aspirine, en Cafeïne
Ingrediënt(en): BUTALBITAL, ASPIRINE, CAFFEINE
Imprint: WATSON;3219
Dosage: 50 mg
Kleur(en): Groen, Geel
Vorm: Capsule
Grootte (mm): 22
Score: 1
NDC:05913219
Geneesmiddelenetiket Auteur: Watson Laboratories, Inc.
Deze pilafbeelding is afkomstig van de PillBox van de National Library of Medicine.
Drug Name: Butalbital, Aspirine en Cafeïne Tabletten
Ingrediënt(en): ASPIRINE, BUTALBITAL, CAFFEINE
Imprint: West;ward;785
Dosering: 50 mg
Kleur(en): Wit
Vorm: Rond
Grootte (mm): 7
Score: 1
NDC:06032548
Drogisterijetiket Auteur: Qualitest
Deze afbeelding van de pil is afkomstig van PillBox van de National Library of Medicine.
Package and Label Display Panel
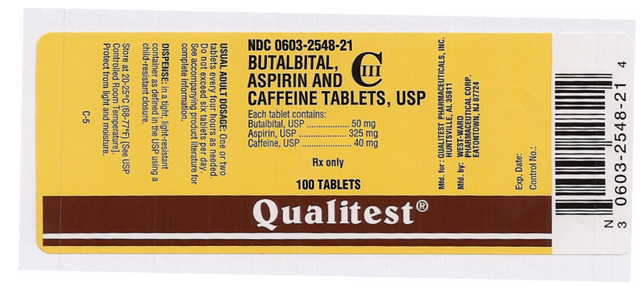
Deze afbeelding van het FDA-etiket is afkomstig van de National Library of Medicine.

Deze afbeelding van het FDA-etiket is verstrekt door de National Library of Medicine.
Patient Counseling Information
Er is beperkte informatie over Patient Counseling Information van Butalbital in het geneesmiddeletiket.
Voorzorgsmaatregelen met alcohol
Brand Names
Er is beperkte informatie over Butalbital Brand Names in het geneesmiddeletiket.
Look-Alike Drug Names
Er is beperkte informatie over Butalbital Look-Alike Drug Names in het geneesmiddeletiket.