Wat is Kobalt
Kobalt (uitspraak: KO-bolt) is een hard, glanzend zilverachtig-blauw element dat behoort tot de groep van overgangsmetalen, en het wordt weergegeven door het chemische symbool Co . Het is chemisch actief en kan vele verbindingen vormen. Het is een ferromagnetisch metaal dat kan worden gemagnetiseerd en wordt gelegeerd met nikkel en aluminium om krachtige magneten te produceren .

Cobalt Symbool
Isotopen
Het heeft één stabiele, in de natuur voorkomende isotoop, 59Co en 28 radio-isotopen waarvan de meest stabiele 60Co, 57Co, 56Co, en 58Co zijn met halveringstijden van respectievelijk 5,2714 jaar, 271,8 dagen, 77,27 dagen, en 70,86 dagen . De halfwaardetijden van de andere radio-isotopen zijn minder dan 18 uur.
Waar wordt kobalt gevonden
Kobalt komt van nature voor in combinatie met andere elementen in de minerale ertsen zoals cobaltiet (een sulfide die kobalt, arseen, ijzer en nikkel bevat), erythriet (gehydrateerd kobaltarsenaat), en skutterudiet (kobaltarsenaat) . Het wordt over het algemeen verkregen als een bijproduct van koper en nikkel mijnbouw .
De mangaanknollen gevonden op de oceaanbodem zijn enorme reserves van overgangsmetalen, die tonnen kobalt bevatten . De top 3 van landen die over kobaltreserves beschikken zijn de Democratische Republiek Congo (DRC), Australië en Cuba, terwijl de top 3 van producenten bestaat uit de DRC, China en Zambia.

Kobalt
Geschiedenis
Oorsprong van zijn naam: De naam is afgeleid van “kobald”, Duits voor “kabouter” en van “cobalos”, een Grieks woord dat “mijn” betekent .
Wie ontdekte het: Het element werd gevonden door de Zweedse chemicus en mineraloog Georg Brandt .
Wanneer en hoe werd het ontdekt
In de graftombe van Toetanchamon, de oude Egyptische farao die regeerde gedurende 1361-1352 v.Chr., bevond zich een diepblauw glazen voorwerp dat van kobalt was gemaakt . In China werd kobalt blauw gebruikt voor het maken van aardewerk glazuur .
Afgezien van zijn oude oorsprong, dateert de ontdekking ervan in de recente tijden uit de jaren 1730 toen Georg Brandt geïnteresseerd was in een blauw erts uit een aantal van de lokale mijnen . Uiteindelijk slaagde hij erin te bewijzen dat het blauwe erts een nieuw metaal bevatte. Hij beschreef de eigenschappen ervan en publiceerde de resultaten in 1739 .
Zijn ontdekking was controversieel, omdat andere chemici zijn bevindingen vele jaren betwistten . Echter, zijn collega Zweedse chemicus Torbern Bergman voerde verdere studies en bevestigde Georg Brandt’s ontdekking in 1780 .
Cobalt identificatie |
|||
| Atoomnummer | 27 | ||
| CAS nummer | 7440-48-4 | ||
| Positie in het periodiek systeem | Groep | Periode | Blok |
| 9 | 4 | d | |
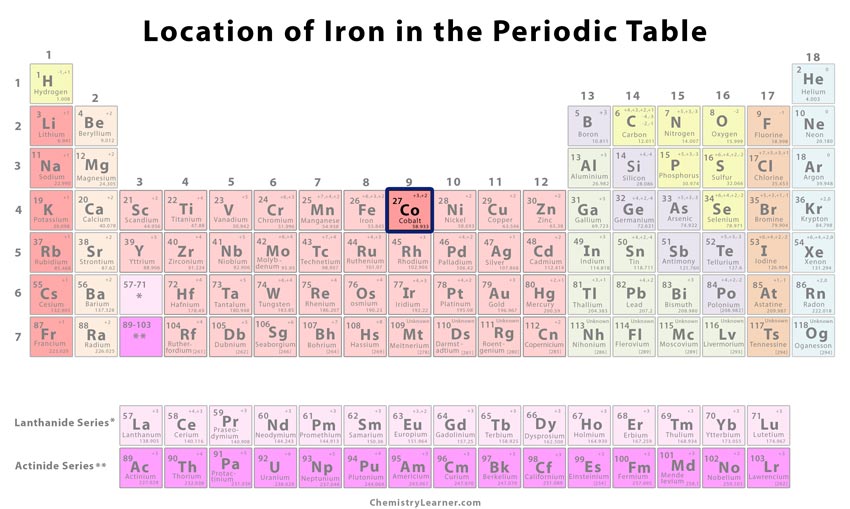
Waar staat kobalt in het Periodiek Systeem
Eigenschappen en kenmerken van kobalt
Algemene eigenschappen |
||||||||||||||||
| Relatieve atoommassa | 58.933 | |||||||||||||||
| Atomaire massa | 58,933 amu | |||||||||||||||
| Molaire massa | 58,9331950 ± 0,0000050 g/mol | |||||||||||||||
| Moleculair gewicht | 58.933 g/mol | |||||||||||||||
Fysische eigenschappen |
||||||||||||||||
| Kleur | Zilverblauw, blauwachtig wit | |||||||||||||||
| Smeltpunt/vriespunt | 1495 °C, 2723 °F | |||||||||||||||
| kookpunt | 2927 °C, 5301 °F | |||||||||||||||
| dichtheid | 8.86 g cm-3 | |||||||||||||||
| Staat van materie bij kamertemperatuur (vast/vloeibaar/gas) | Vast | |||||||||||||||
| Hardheid | ||||||||||||||||
| – Brinell | 700 MPa | |||||||||||||||
| – Mohs | 5 | |||||||||||||||
| – Vickers | 1043 MPa | |||||||||||||||
| Elektrisch geleidingsvermogen | 1.7 X 107 S/m | |||||||||||||||
| Ionische lading | 3+ | |||||||||||||||
| Thermische (warmte) geleidbaarheid | 100 W/(m K) | |||||||||||||||
| Specifieke warmte | 421 J kg-1 K-1 | |||||||||||||||
| Bulkmodulus | Onbekend | |||||||||||||||
| Shear modulus | Onbekend | |||||||||||||||
| Young’s modulus | Onbekend | |||||||||||||||
| Verdampingsdruk | ||||||||||||||||
| – Temperatuur (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Druk (Pa) | – | – | – | 2.09 X 10-10 | 1.00 X 10-6 | 4.19 X 10-4 | 0.0379 | 1.15 | 16 | – | – | |||||
Chemische eigenschappen |
||||||||||||||||
| Oxidatietoestanden | 3, 2, 0, -1 | |||||||||||||||
| Isotopen | Isotoop | Massa | Aantal (%) | Halfwaardetijd | Vertalingswijze | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
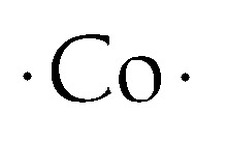
Kobalt Lewis Punt Structuur
Atomaire gegevens van Kobalt (Element 27)
| Valence elektronen | 9 | |||||||
| Kwantumgetallen | ||||||||
| – n | 3 | |||||||
| – ℓ | 2 | |||||||
| – mℓ | -1 | |||||||
| – ms | -1/2 | |||||||
| Elektronenconfiguratie (edelgasconfiguratie) | 3d74s2 | |||||||
| Atoomstructuur | ||||||||
| – Aantal elektronen | 27 | |||||||
| – Aantal neutronen | 32 | |||||||
| – Aantal protonen | 27 | |||||||
| Radius van atoom | ||||||||
| – Atoomstraal | 2.00 Å | |||||||
| – Covalente radius | 1.18 Å | |||||||
| Elektronegativiteit (Pauling-schaal) | 1.88 | |||||||
| Elektronenaffiniteit | 63.873 kJ mol-1 | |||||||
| Ionisatie-energie (kJ mol-1) | 1e | 2e | 3e | 4e | 5e | 6e | 7e | 8e |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |
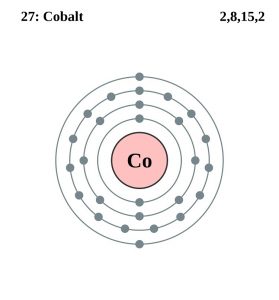
Kobalt elektronenconfiguratie (Bohr model)
Waar wordt kobalt voor gebruikt
- Kobalt wordt gelegeerd voor gebruik in gasturbine generatoren en jet turbines vanwege zijn sterkte bij hoge temperatuur en weerstand tegen corrosie .
- Kobalt wordt af en toe gebruikt bij galvaniseren vanwege zijn hardheid en aantrekkelijke uiterlijk.
- Het wordt algemeen gebruikt als kathodemateriaal in lithium-ionbatterijen.
- Kobaltzouten worden gebruikt om intens blauwe kleuren in glas, porselein, aardewerk, email, en verf te geven.
- Radioactieve 60Co wordt gebruikt voor de behandeling van kanker, en in voedsel bestraling voor het bestrijden van ziekteverwekkers en het verlengen van de houdbaarheid .
- Stellite super-legeringen, samengesteld uit chroom, kobalt, en wolfraam, worden gebruikt voor het maken van hoge temperatuur en hoge slijtage bestendige snijgereedschappen .
Cobalt Toxicity and Health Effects
Cobalt vergiftiging kan plaatsvinden wanneer u per ongeluk innemen, inademen, of hebben het in contact met de huid in grote hoeveelheden . In grote hoeveelheden kan kobalt kankerverwekkend zijn bij mensen en sommige dieren.
Het wordt in sporenhoeveelheden bij mensen gevonden en is een essentieel bestanddeel van vitamine B12 . Kleine doses kobalt worden ook gegeven aan sommige dieren om minerale tekorten bij hen te voorkomen .

Kobaltmineraal (Kobaltiet)
Belangrijke feiten
- Kobalt wordt grafisch voorgesteld door een ‘kobold’ of goblin (die door de middeleeuwse Duitse mijnwerkers als lastig werd beschouwd) met wat Chinees porselein op de achtergrond, verwijzend naar het gebruik ervan als aardewerkglazuur in het oude China .
- Kobalt kan zijn magnetische eigenschappen behouden tot een temperatuur (Curie-Punt) van 1.121 °C (2049.8 °F), de hoogste van alle ferromagnetische elementen .
- In 2010, Duitse wetenschappers gebruikten een kobaltatoom om de eerste foto’s van spin veranderende vast te leggen .
Prijs van kobalt
De kosten van zuiver kobalt is ongeveer $ 0,21 per gram, en in bulk, het kost ongeveer $ 0.044 per gram.
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm