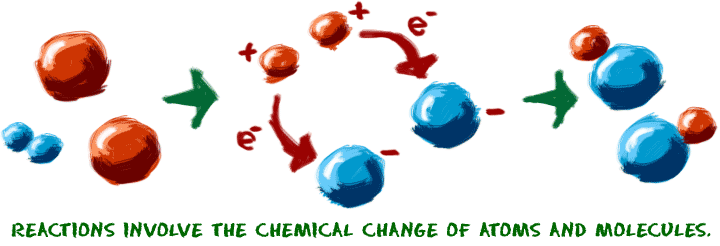
Laten we beginnen met het idee van een chemische reactie. Reacties treden op wanneer twee of meer moleculen op elkaar inwerken en de moleculen veranderen. Bindingen tussen atomen worden verbroken en gecreëerd om nieuwe moleculen te vormen. Dat is het. Welke moleculen zijn dat? Hoe werken ze op elkaar in? Wat gebeurt er? De mogelijkheden zijn oneindig.
Wanneer je chemische reacties probeert te begrijpen, stel je dan voor dat je met de atomen werkt. Stel je voor dat de bouwstenen recht voor je op tafel liggen. Soms gebruiken we ons scheikundespeelgoed om ons te helpen de beweging van de atomen te visualiseren. We pluggen de kleine connectoren, die chemische bindingen voorstellen, in en uit. Er zijn een paar belangrijke punten die je moet weten over chemische reacties:
1. Er moet een chemische verandering plaatsvinden. Je begint met één molecuul en verandert het in een ander. Chemische bindingen worden gemaakt of verbroken om een nieuw molecuul te maken. Een voorbeeld van een chemische reactie is het roesten van een stalen vuilnisbak. Dat roesten gebeurt doordat het ijzer (Fe) in het metaal zich verbindt met zuurstof (O2) in de atmosfeer. Chemische bindingen worden gemaakt en vernietigd om uiteindelijk ijzeroxide (Fe2O3) te maken.  Wanneer een koelkast of airconditioner de lucht afkoelt, vindt er geen reactie plaats in de luchtmoleculen. De verandering in temperatuur is een fysische verandering. Wanneer je een ijsblokje laat smelten, is dat een fysische verandering. Wanneer u bleekwater in de wasmachine doet om uw kleren schoon te maken, is er een chemische verandering die de moleculen in uw vlekken uiteen doet vallen.
Wanneer een koelkast of airconditioner de lucht afkoelt, vindt er geen reactie plaats in de luchtmoleculen. De verandering in temperatuur is een fysische verandering. Wanneer je een ijsblokje laat smelten, is dat een fysische verandering. Wanneer u bleekwater in de wasmachine doet om uw kleren schoon te maken, is er een chemische verandering die de moleculen in uw vlekken uiteen doet vallen.
2. Een reactie kan atomen, ionen, verbindingen of moleculen van een enkel element omvatten. Je moet onthouden dat een chemische reactie met alles kan gebeuren, zolang er maar een chemische verandering optreedt. Als je zuiver waterstofgas (H2) en zuiver zuurstofgas in een kamer zet, kunnen ze betrokken zijn bij een reactie waarbij water (H2O) wordt gevormd. Het zal echter in zeer zeer kleine hoeveelheden zijn. Als je een vonk zou toevoegen, zouden deze gassen betrokken raken in een heftige chemische reactie die zou resulteren in een enorme explosie (exotherm). Een andere chemische reactie kan zilverionen (Ag+) omvatten. Als je een oplossing met zilverionen mengt met een oplossing die chloride-ionen (Cl-ionen) bevat, ontstaat er een zilverchloride (AgCl)-neerslag dat uit de oplossing valt.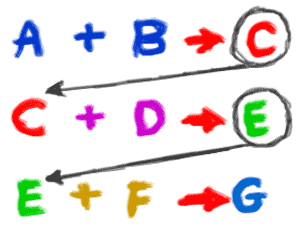 3. Afzonderlijke reacties vinden vaak plaats als onderdeel van een grotere reeks reacties. Wanneer een plant suikers maakt, kunnen er wel een dozijn chemische reacties plaatsvinden om de Calvijn-cyclus te doorlopen en uiteindelijk glucosemoleculen (C6H12O6) te maken (synthetiseren). Het roestvoorbeeld dat we eerder gebruikten, toonde alleen de oorspronkelijke reactanten en eindproducten van de chemische reactie. Er waren verschillende tussenreacties waarbij chemische bindingen werden gemaakt en vernietigd. Het voorbeeld van zilverchloride richtte zich alleen op de ionen. In werkelijkheid ontstonden de twee oplossingen toen twee zouten in water dissocieerden (zich in ionen splitsten).
3. Afzonderlijke reacties vinden vaak plaats als onderdeel van een grotere reeks reacties. Wanneer een plant suikers maakt, kunnen er wel een dozijn chemische reacties plaatsvinden om de Calvijn-cyclus te doorlopen en uiteindelijk glucosemoleculen (C6H12O6) te maken (synthetiseren). Het roestvoorbeeld dat we eerder gebruikten, toonde alleen de oorspronkelijke reactanten en eindproducten van de chemische reactie. Er waren verschillende tussenreacties waarbij chemische bindingen werden gemaakt en vernietigd. Het voorbeeld van zilverchloride richtte zich alleen op de ionen. In werkelijkheid ontstonden de twee oplossingen toen twee zouten in water dissocieerden (zich in ionen splitsten).
Wikipedia: Chemische reacties
Encyclopedia.com: Chemische reacties
Rhode Island College: Reactions