Elk elektron in een atoom kan uniek worden geïdentificeerd door een set van vier quantum getallen.

Hoewel de ontdekking ervan geavanceerde wiskunde vereiste, zijn het allemaal conventionele getallen: drie ervan kunnen slechts eenvoudige gehele getallen aannemen; het vierde is een eenvoudige breuk.
De eerste drie kwantumgetallen komen voort uit de golffunctie, Ψ, die wordt verkregen door de Schrödingervergelijking op te lossen.
Het vierde kwantumgetal, de elektronenspin, ontstaat door de ontdekking dat elektronen twee oriëntatiemogelijkheden hebben.
De getallen en hun definities zijn als volgt:
De kwantumgetallen
| Kwantumgetal | Naam | Mogelijke waarden | Informatie |
|---|---|---|---|
| n | principaal kwantumgetal | 1, 2, 3,…., n | Geeft aan welke energieschil door het elektron wordt bezet. Schillen die zich het dichtst bij de kern bevinden hebben de laagste waarde van n en de laagste potentiële energie.n is het eerste getal dat wordt geschreven in elektronenconfiguraties zoals die van magnesium: 1s2 2s2 2p6 3s2 |
| l | orbitaal impulsmomentkwantumgetal (ook wel azimutaal kwantumgetal genoemd) |
0, 1, 2,…., (n-1) | Definieert de energie-subschil – in systemen met meer dan één elektron hebben de subschalen verschillende energieën. l definieert de subshell-letter in elektronenconfiguraties. Bijvoorbeeld: 1s2 2s2 2p6 3s2 l = 0 geeft een s-subschil. l = 1 geeft een p-subschil. l = 2 geeft een d-subschil, enz. |
| ml | magnetisch quantumgetal | -l, (l+1), …, 0,…. , (l+1), l | Definieert de oriëntatie van de subshell orbitaal. De p-subschil, met l = 1, heeft drie ml-waarden: -1, 0, 1.Deze geven aan dat er drie p-banen bestaan, namelijk de orbitalen px, py en pz. De d-subschil, met l = 2, heeft vijf ml-waarden: -2, -1, 0, 1, 2.Deze geven aan dat er vijf d-banen bestaan. |
| ms | electron spin quantum number | -½ of +½ | Elektronen hebben twee mogelijke spin oriëntaties. |
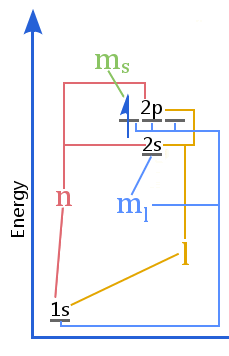
Het energieniveauschema toont de relatie tussen quantumgetallen versus de schillen, subschillen, orbitalen, en elektronspin in een atoom.
Geen enkel elektron in een atoom deelt alle vier quantumgetallen.Elk elektron kan uniek worden geïdentificeerd door zijn kwantumnummer – zie het Pauli uitsluitingsbeginsel.
De vormen van de banen worden niet gegeven door de kwantumnummers, maar zijn waarschijnlijkheidsdichtheden – driedimensionale kaarten van de ruimte rond de kern waar een elektron 99 procent van de tijd zal worden gevonden.De vorm van de banen wordt verkregen uit het kwadraat van de golffunctie, Ψ2. De precieze plaats en het precieze momentum van een elektron kunnen nooit worden bepaald – zie het onzekerheidsprincipe van Heisenberg.
