Chronic Traumatic Encephalopathy (CTE) is een kenmerkende, met het tau-eiwit geassocieerde neurodegeneratieve ziekte. Er is een toename van de CTE-diagnose bij atleten, vooral American footballspelers, en bij militaire veteranen in gevechtssituaties (1, 2). Hoewel CTE betrekkelijk kort geleden publiekelijk is erkend, werd het voor het eerst beschreven als het “boks dronken” syndroom in een klassiek artikel van Martland e.a. (3). Het rapport richtte zich op een aantal boksers die gedurende hun carrière herhaaldelijk klappen op hun hoofd hadden gekregen en die zich presenteerden met zowel psychiatrische symptomen als ernstige geheugen- en neurocognitieve tekorten, analoog aan typische dementiepatiënten (3). De naamgeving van de ziekte evolueerde naar “dementia pugilistica” (4), en uiteindelijk naar CTE in 1949 (5).
CTE heeft een uniek neuropathologisch kenmerk, bestaande uit accumulatie van gefosforyleerd tau (p-tau) in sulci en peri-vasculaire gebieden, microgliosis, en astrocytosis. Deze pathologische veranderingen leiden tot progressieve invaliderende neurodegeneratie. Op grond van het patroon van de pathologische progressie wordt CTE in vier verschillende stadia ingedeeld (figuur 1). In stadium I CTE lijken de hersenen grosso modo normaal, maar p-tau wordt aangetroffen op een beperkt aantal loci, vaak in de laterale en frontale cortex, alsook proximaal van kleine bloedvaten in de diepte van sulci. Er kan een gering aantal neurofibrillaire tangles (NFT’s) en neurieten in de locus coeruleus zijn. In stadium II kunnen gelokaliseerde macroscopische afwijkingen worden waargenomen. Op grove anatomische secties en neuro-imaging worden vergroting van de laterale ventrikels, cavum septum pellucidum met of zonder fenestratie, alsook bleekheid van de locus coeruleus en de substantia nigra waargenomen. Er zijn meerdere foci van p-tau in de diepte van de sulci, en er is een opkomend spreidingspatroon. In stadium III vertonen de meeste bruto pathologische secties macroscopische afwijkingen. Er is algemeen gewichtsverlies van de hersenen, milde atrofie van de frontale kwab en de temporale kwab, en verwijding van de ventrikels. De helft van de CTE-patiënten vertoont afwijkingen aan het septum, waaronder cavum septum pellucidum. De P-tau-pathologie breidt zich uit en omvat de frontale, temporale, pariëtale en insulaire cortex. In stadium IV is de vermindering van het hersengewicht dramatisch, en er zijn hersengewichten van 1.000 g gemeld (vergeleken met 1.300-1.400 g in normale hersenen). Er is ernstige atrofie van de frontale en mediale temporale kwabben, evenals van de voorste thalami. Er is ook atrofie van de witte stof tracten. De meerderheid van de patiënten in stadium vier heeft afwijkingen aan het septum. De verspreiding van de p-tau treft de meeste gebieden, met inbegrip van de calcarine cortex (7, 8). Afwijkingen in gefosforyleerd 43 kDa TAR DNA bindend eiwit (TDP-43) wordt ook gezien bij de meeste CTE patiënten. De parenchymale TDP-43 pathologie is ook progressief van aard, vergelijkbaar met het anatomische patroon van verspreiding van p-tau. TDP-43-immunoreactiviteit wordt in bijna alle gevallen van stadium IV van de ziekte aangetroffen (7).

Figuur 1. De bovenstaande afbeeldingen zijn een weergave van de vier stadia van CTE van McKee.
Het klinische fenotype van CTE is nog niet duidelijk gedefinieerd. In de volgende paragrafen wordt een overzicht gegeven van de pogingen tot karakterisering van de symptomen van CTE in de verschillende stadia van het ziekteproces (tabel 1). Volgens McKee’s classificatie is een typische CTE-patiënt in stadium I asymptomatisch, of klaagt over milde kortetermijngeheugenstoornissen en depressieve symptomen. Milde agressie kan worden waargenomen. In stadium II kunnen de stemmings- en gedragssymptomen bestaan uit gedragsuitbarstingen en ernstiger depressieve symptomen. In stadium III vertonen de patiënten gewoonlijk meer cognitieve stoornissen, zoals geheugenverlies, stoornissen in het executief functioneren, visuospatiële disfunctie en apathie. In stadium IV vertonen de patiënten vergevorderde taalstoornissen, psychotische symptomen zoals paranoia, motorische stoornissen en parkinsonisme.
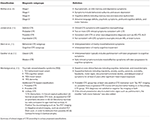
Tabel 1. Voorgestelde klinische classificaties van CTE.
Jordan et al. (10) waren een van de eersten die de ziekte klinisch karakteriseerden. Zij verdeelden de klinische presentaties van CTE in drie domeinen: gedrag/psychiatrisch, cognitief, en motorisch. Het gedrags- en psychiatrische domein omvatte agressie, depressie, apathie, impulsiviteit, waanideeën inclusief paranoia, en suïcidaliteit. Het cognitieve domein omvatte verminderde aandacht en concentratie, geheugen tekorten, executieve functionerings tekorten, visuospatiale disfunctie, taal tekorten, en dementie. De motorische kenmerken tenslotte bestonden uit dysarthrie, gangafwijkingen, ataxie en incoördinatie, spasticiteit, en kenmerken van parkinsonisme zoals tremor. Op basis van deze klinische kenmerken, alsmede de bestaande neuropathologische informatie, werden vier diagnostische subtypen gedefinieerd, namelijk “definitieve”, “waarschijnlijke”, “mogelijke” en “onwaarschijnlijke” CTE.
Stern e.a. (11), en verwante gevalsbeschrijvingen (14, 15), verschilden in hun beschrijving van een typische CTE-patiënt, waarbij zij de klinische presentatie in twee verschillende subtypen conceptualiseerden. Het eerste subtype vertoonde voornamelijk gedrags- en stemmingsveranderingen, en het andere presenteerde zich met voornamelijk cognitieve stoornissen. De grote meerderheid van het stemmings-/gedragssubtype ontwikkelde cognitieve stoornissen naarmate de ziekte voortschreed. Maar relatief weinig patiënten van de cognitieve groep vertoonden stemmings- of gedragsveranderingen in de loop van hun ziekte. In de studie van Stern e.a. (11) hadden de patiënten uit de cognitieve groep een significant grotere kans op het ontwikkelen van dementie. Zij waren ook significant ouder op het moment van de diagnose in vergelijking met de stemming/gedragsgroep patiënten. De gedragssubgroep van CTE-patiënten kan lijken op patiënten met een gedragsvariant van frontotemporale dementie (bvFTD), wat de klinische diagnose uitdagender maakt. Echter, typische bvFTD karakteristieke gedragsuitingen zoals apathie en ontremming worden vaak niet gezien bij CTE patiënten (11, 16). Gezien de inherente heterogeniteit van bvFTD, alsmede de vergelijkbare tauopathische aard van beide ziekten, vormt het onderscheiden van bvFTD en CTE een diagnostische uitdaging.
Van de gedragsmatige symptomen van CTE blijft de associatie tussen suïcide en CTE een onderwerp dat in de literatuur wordt bestudeerd. Eerdere studies, zoals de serie van vijf professionele atleten met een bevestigde diagnose van CTE gerapporteerd door Omalu et al. (17), hadden een sterke relatie gesuggereerd tussen CTE en zelfmoord. De auteurs suggereerden verder dat de etiologie van suïcidaal/parasuïcidaal gedrag in de CTE-populatie gedeeltelijk te wijten zou kunnen zijn aan tauopathie in de vorm van neurofibrillaire tangles en neuritische draden in strategische limbische hersenkernen zoals de locus ceruleus. Maroon et al. (18), onderzochten 153 pathologisch bevestigde gevallen van CTE gepubliceerd tussen 1954 en 2013. Zij rapporteerden dat de zelfmoordprevalentie in de CTE-populatie en de accidentele sterfgevallen 11,7 en 17,5% bedroeg, significant hoger dan de algemene bevolkingsniveaus van respectievelijk 1,5 en 4,8% (18). Voorstanders van de tegenovergestelde opvatting suggereren dat suïcides vooral in eerdere stadia van CTE zijn gerapporteerd, en dat het verband tussen ziekteprogressie en suïcide vooralsnog onduidelijk blijft (19).
In een meta-analyse van 158 casestudies door Gardner e.a. (12) werden de klinische symptomen van CTE onderverdeeld in “klassieke” versus “moderne” CTE-symptomen, om een onderscheid te maken tussen een oudere beschrijving van CTE-gevallen die zich vooral richtte op boksers, vergeleken met een meer geëvolueerde klinische beschrijving die ook van toepassing is op professionele American footballspelers. Terwijl de “klassieke” CTE-symptomen gewoonlijk dysartrie, bewegingsmoeilijkheden en later geheugenstoornissen omvatten, omvat het “moderne” CTE-plaatje ook neuropsychiatrische symptomen, zoals depressieve symptomen, paranoia, sociale terugtrekking en isolement, beoordelingsstoornissen en agressie. Cognitieve stoornissen zoals geheugenverlies, executieve dysfunctie, taal- en informatieverwerkingsstoornissen treden later in het ziekteproces op (12).
Omdat de definitie van CTE voornamelijk afhangt van pathologische kenmerken, is er een voorgestelde alternatieve klinische term van traumatisch encefalopathiesyndroom (TES) door Montenigro e.a. (13), die de klinische gevolgen van herhaalde TBI’s beschrijft. De auteurs baseerden deze classificatie op een overzicht van 202 gepubliceerde gevallen. TES is een meer omvattende diagnose en kan worden onderverdeeld in vier subcategorieën, waaronder TES gedrags-/stemmingsvariant, TES cognitieve variant, TES gemengde variant, en TES dementie. De voorgestelde TES-diagnose was gebaseerd op het bestaan van vijf algemene criteria, drie klinische kernkenmerken, en negen ondersteunende kenmerken. Met gebruikmaking van bestaande biomarkers* (tabel 1) werden aanvullende diagnostische kwalificaties voorgesteld, waaronder “waarschijnlijke”, “mogelijke” en “onwaarschijnlijke” CTE (9, 13). De voorgestelde TES-diagnose bevatte ook temporele kwalificaties en omvatte “progressief verloop”, “stabiel verloop” en “onbekend/consistent verloop”. Als de klinische presentatie ook motorische tekenen zoals parkinsonisme omvatte, werd de modifier “met motorische kenmerken” ook toegevoegd.
Naarmate ons begrip van CTE groeit, zijn er een aantal uitdagingen en kritieken die moeten worden aangepakt. Eén hypothese als alternatief voor het fenomeen CTE, is een verminderde “cognitieve reserve” theorie. Deze theorie stelt dat herhaaldelijk neurotrauma leidt tot een vermindering van de cognitieve reserve en een versnelling van de ontwikkeling van een onderliggende neurodegeneratieve aandoening (20, 21). Als deze theorie opgaat, zou dat betekenen dat CTE en AD zich in hetzelfde neuropathologische spectrum bevinden. Deze bewering verdient nadere analyse. Net als bij AD bestaan de Tau-isovormen bij CTE ook uit een mix van drie-repeat (3R) en vier-repeat (4R) isovormen. Volgens een recent rapport van Falcon e.a. (22) bevatten de tau-filamenten uit de hersenen van CTE-patiënten echter ook een unieke ß-helix regio met een hydrofobe holte, die niet aanwezig is in de hersenen van AD-patiënten. De holte bevat een extra cofactor waarvan gedacht wordt dat hij een functionele rol speelt bij de voortplanting van tau. Falcon e.a. (22) suggereren dat de locatie van tau-insluitingen in de nabijheid van bloedvaten, suggereert dat cofactoren die nodig zijn voor tau-assemblage de bloed-hersenbarrière kunnen passeren na hoofdletsel. De auteurs stellen verder dat het feit dat hersentrauma slechts bij een subgroep van de gewonde bevolking tot CTE leidt, te maken kan hebben met een hoger niveau van cofactoren bij de meer vatbare individuen. Deze cofactoren zouden een therapeutisch doelwit kunnen vormen voor het voorkomen van de vorming van tau en de ontwikkeling van CTE na verwonding (22).
Een alternatieve theorie stelt dat de psychiatrische symptomen zoals depressie en woede die bij CTE-patiënten worden gerapporteerd, onafhankelijk zijn van het CTE-ziekteproces en dat zij op een medeonderbouwde manier worden gerapporteerd. De voorstanders van deze hypothese hebben eerdere studies aangehaald, zoals die van Weir e.a. (23), waarin aan 1.063 voormalige NFL-spelers werd gevraagd of zij woedeaanvallen hadden ervaren. Er werd gerapporteerd dat 30,7% van de spelers in de leeftijd van 30-49 jaar, en 29,3% van de spelers in de leeftijd van 50 jaar of ouder, woede-uitbarstingen rapporteerden. De auteurs merkten echter ook op dat de gerapporteerde metingen van woede inderdaad lager waren dan die gerapporteerd voor de algemene Amerikaanse bevolking, die 54,8% bedroeg voor mannen tussen 30 en 49, en 47,2% voor mannen boven de leeftijd van 50 (23). Hoewel de argumenten betreffende de comorbiditeit van psychiatrische symptomen en neurodegeneratieve ziekten zoals CTE moeilijk te verifiëren zijn op basis van neuroimaging en neuropathologische bevindingen, kan men gelijkaardige argumenten toepassen op psychiatrische symptomen van om het even welke neurodegeneratieve aandoening zoals AD, bvFTD, de ziekte van Parkinson (PD) of amyotrofe laterale sclerose (ALS).
Een andere belangrijke bron van diagnostische verwarring is de klinische afbakening tussen CTE en verlengd post-concussief syndroom (PCS), vooral gezien eerdere rapporten die aangeven dat ~10-20% van de personen die hersenschuddingen oplopen, langdurige symptomen ervaren. Chronisch post-concussief syndroom (CPCS) verwijst naar aanhoudende PCS-symptomen die leiden tot verminderde functionele en vaak atletische prestaties die langer dan een jaar duren. CPCS-symptomen zijn onder meer hoofdpijn, duizeligheid, verminderde aandacht, geheugen en uitvoerende functiestoornissen, depressie en prikkelbaarheidssymptomen (10). King en Kirkwilliam bedachten de term “Permanente PCS” om te verwijzen naar diegenen met PCS-symptomen die gemiddeld 6,9 jaar na de eerste hersenschudding aanhouden. Bovendien rapporteerden zij dat een significant aantal permanente PCS patiënten (40-59%) ook premorbide of postmorbide neuropsychiatrische condities hadden zoals depressie, angst, PTSD, en/of pijn (24). Zoals betoogd door Jordan e.a. (10), is CPCS klinisch te onderscheiden van CTE, op basis van de temporele relatie tot de acute hersenschudding. Een grondige en nauwkeurige temporele anamnese blijft de sleutel bij de neurologische beoordeling. Bovendien is hoofdpijn een centraal kenmerk van CPCS, dat bij CTE niet vaak wordt gemeld. Hoewel betwistbaar, kunnen patiënten met McKee stadium I en II zich met hoofdpijn presenteren, wat de complexiteit van mogelijke overlapping van CTE & CPCS nog vergroot (9). De diagnose CPCS blijft controversieel, omdat het niet duidelijk is of deze tauopathisch van aard is. Daarom zijn de scheidslijnen van CPCS en McKee’s stadia I en II klinische kenmerken niet volledig gestold.
Een duidelijke genetische predisposities voor CTE zijn niet gerapporteerd. Wel is het ApoE4-gen, de bekendste risicofactor voor de ziekte van Alzheimer (25), in verband gebracht met grotere cognitieve stoornissen en een langduriger herstelperiode na traumatisch hersenletsel (TBI) (11). Een studie bij een groep boksers heeft ernstigere uitkomsten gerapporteerd bij personen die ten minste één ApoE4-allel droegen (26). Omgekeerd zou ApoE3 neuroprotectie kunnen bieden, zelfs in de aanwezigheid van progressieve CTE-pathologie (15). Een andere voorgestelde beschermende factor die in verband wordt gebracht met een gunstiger herstel na een TBI is cognitieve reserve, zoals gemeten door het premorbide IQ en het totale intracraniële volume (27). Andere genetische kandidaten voor verdere studie zijn het microtubule-geassocieerd eiwit tau (MAPT) gen, het progranuline (GRN) gen, en het chromosoom negen open reading frame 72 (C9ORF72) gen (11).
Het pathologische synergisme van tauopathie en neuroinflammatie wordt steeds meer erkend. Extracellulaire secretie van hypergefosforyleerd tau zou microglia en astrocyten activeren, wat leidt tot de productie van pro-inflammatoire cytokines zoals IL1β en TNFa, wat op zijn beurt leidt tot activering van tau-kinasen zoals p38 en cdk5, en verdere tau-fosforylering. Dit proces creëert een vicieuze eeuwigdurende tauopathie en neuroinflammaion cyclus (28). Gezien de sterke associatie tussen herhaald traumatisch hersenletsel en het risico op CTE (1), zou tijdige behandeling van TBI de ontwikkeling van CTE kunnen verminderen. De ontstekingsbevorderende aard van TBI is eerder gerapporteerd (13), en ontstekingsremmende middelen zoals minocycline met N-acetylcysteïne, een krachtige antioxidant, toegediend in acute tot subacute tijdvensters na TBI, bieden een veelbelovende therapeutische regeling (29, 30). De ontwikkeling van een tijdgevoelig protocol, dat lijkt op het behandelingsalgoritme voor ischemische beroerte, zou mogelijk het resultaat op lange termijn kunnen meten in het herstel na TBI en het voorkomen van de ontwikkeling van latere CTE-pathologie (29).
Er zijn momenteel geen ziektemodificerende medicijnen voor CTE, waardoor preventie de meest effectieve manier is om deze slopende neurodegeneratieve ziekte te bestrijden (31). Gezien de frequentie van botsingen met het hoofd bij contactsporten zoals American football, zal preventie van hoofdletsel een cultuuromslag vergen in de manier waarop de sport wordt onderwezen en beoefend. Training voor veilige trainingstechnieken, zoals veilig tackelen en slaan, terwijl roekeloze slagen bestraft worden, zal meetbare voordelen opleveren. Verdere veranderingen zijn onder meer het creëren van een veilige omgeving, waarin spelers worden aangemoedigd om symptomen te melden aan scheidsrechters, coaches en ook aan teamartsen. Verder zou het vaststellen van een neurocognitief basisprofiel kunnen worden gebruikt als een klinische referentiemarker om veranderingen in de neuropsychiatrische presentatie van spelers te volgen. Het is de taak van de teamartsen om spelers van het veld te halen die zelfs een licht ongecompliceerd TBI hebben opgelopen voor verdere beoordeling (32).
Er zijn een aantal bestaande CTE-gerelateerde uitdagingen die moeten worden aangepakt. Hoewel de incidentie van sportgerelateerde hersenschudding is gerapporteerd variërend van 1,6 miljoen tot 3,8 miljoen, blijft de incidentie en prevalentie van CTE grotendeels onbekend (33). Een verklaring voor dit gebrek aan kennis is wellicht te vinden in het feit dat sporters die worden blootgesteld aan cumulatieve subconcussieve klappen, die voldoende kracht uitoefenen om neuronale schade toe te brengen maar aanvankelijk geen openlijke klinische symptomen hebben, vaak niet tijdig worden beoordeeld of gediagnosticeerd (34). Grootschalige prospectieve studies, zoals het volgen van atleten met meervoudige TBI’s gedurende een vooraf bepaalde periode, zouden bijdragen aan ons begrip van het natuurlijke beloop en de fenomenologie van de ziekte. CTE komt via de massamedia steeds meer in de publieke belangstelling te staan. Er zijn voortdurende inspanningen nodig om deze verwoestende ziekte te diagnosticeren, te evalueren en te behandelen. De exponentiële vooruitgang in neuro-beeldvormingstechnieken en het begrip van de neuropathologische mechanismen van de ziekte zullen leiden tot een vroegere diagnose en tijdige behandelingsinterventies.
Bijdragen van de auteur
De auteur bevestigt de enige bijdrager te zijn van dit werk en heeft het goedgekeurd voor publicatie.
Conflict of Interest Statement
De auteur verklaart dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
De auteur erkent de grote steun, begeleiding en mentorschap van Dr. Stephen Strittmatter.
1. McKee AC, Cantu RC, Nowinski CJ, Hedley-Whyte ET, Gavett BE, Budson AE, et al. Chronic traumatic encephalopathy in athletes: progressive tauopathy after repetitive head injury. J Neuropathol Exp Neurol. (2009) 68:709-35. doi: 10.1097/NEN.0b013e3181a9d503
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Goldstein LE, Fisher AM, Tagge CA, Zhang XL, Velisek L, Sullivan JA, et al. Chronic traumatic encephalopathy in blast-exposed military veterans and a blast neurotrauma mouse model. Sci Transl Med. (2012) 4:134ra60. doi: 10.1126/scitranslmed.3003716
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Martland H. Dementia pugilistica. JAMA. (1928) 91:364-65. doi: 10.1001/jama.1928.02700150029009
CrossRef Full Text | Google Scholar
4. Millspaugh J. Dementia pugilistica. US Naval Med Bull. (1937) 35:303.
Google Scholar
5. Critchley M. Hommage a Clovis Vincent. Parijs: Maloine (1949).
Google Scholar
6. Mez J, Daneshvar DH, Kiernan PT, Abdolmohammadi B, Alvarez VE, Huber BR, et al. Clinicopathological evaluation of chronic traumatic encephalopathy in players of American football. JAMA. (2017) 318:360-70. doi: 10.1001/jama.2017.8334
PubMed Abstract | CrossRef Full Text | Google Scholar
7. McKee AC, Stein TD, Kiernan PT, Alvarez VE. De neuropathologie van chronische traumatische encephalopathie. Brain Pathol. (2015) 25:350-64. doi: 10.1111/bpa.12248
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKee AC, Cairns NJ, Dickson DW, Folkerth RD, Keene CD, Litvan I, et al. The first NINDS/NIBIB consensus meeting to define neuropathological criteria for the diagnosis of chronic traumatic encephalopathy. Acta Neuropathol. (2016) 131:75-86. doi: 10.1007/s00401-015-1515-z
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKee AC, Stern RA, Nowinski CJ, Stein TD, Alvarez VE, Daneshvar DH, et al. The spectrum of disease in chronic traumatic encephalopathy. Hersenen. (2013) 136:43-64. doi: 10.1093/brain/aws307
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Jordan BD. The clinical spectrum of sport-related traumatic brain injury. Nat Rev Neurol. (2013) 9:222-30. doi: 10.1038/nrneurol.2013.33
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Stern RA, Daneshvar DH, Baugh CM, Seichepine DR, Montenigro PH, Riley DO, et al. Klinische presentatie van chronische traumatische encephalopathie. Neurologie. (2013) 81:1122-9. doi: 10.1212/WNL.0b013e3182a55f7f
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gardner A, Iverson GL, McCrory P. Chronic traumatic encephalopathy in sport: a systematic review. Br J Sports Med. (2014) 48:84-90. doi: 10.1136/bjsports-2013-092646
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Montenigro PH, Baugh CM, Daneshvar DH, Mez J, Budson AE, Au R, et al. Clinical subtypes of chronic traumatic encephalopathy: literature review and proposed research diagnostic criteria for traumatic encephalopathy syndrome. Alzheim Res Ther. (2014) 6:68. doi: 10.1186/s13195-014-0068-z
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Mawdsley C, Ferguson F. Neurological disease in boxers. Lancet. (1963) 282:795-801. doi: 10.1016/S0140-6736(63)90498-7
CrossRef Full Text | Google Scholar
15. Omalu BI, DeKosky ST, Minster RL, Kamboh MI, Hamilton RL, Wecht CH. Chronic traumatic encephalopathy in a National Football League player. Neurochirurgie. (2005) 57:128-34. doi: 10.1227/01.NEU.0000163407.92769.ED
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Rascovsky K, Hodges JR, Knopman D, Mendez MF, Kramer JH, Neuhaus J, et al. Sensitivity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain. (2011) 134:2456-77. doi: 10.1093/brain/awr179
PubMed Abstract |Ref Full Text | Google Scholar
17. Omalu BI, Bailes J, Hammers JL, Fitzsimmons RP. Chronic traumatic encephalopathy, suicides and parasuicides in professional American athletes: the role of the forensic pathologist. Am J Forensic Med Pathol. (2010) 31:130-2. doi: 10.1097/PAF.0b013e3181ca7f35
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Maroon JC, Winkelman R, Bost J, Amos A, Mathyssek C, Miele V. Chronic traumatic encephalopathy in contact sports: a systematic review of all reported pathological cases. PLoS ONE. (2015) 10:e0117338. doi: 10.1371/journal.pone.0117338
CrossRef Full Text | Google Scholar
19. Iverson GL. Chronic traumatic encephalopathy and risk of suicide in former athletes. Br J Sports Med. (2014) 48:162-4. doi: 10.1136/bjsports-2013-092935
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Iverson GL, Gardner AJ, McCrory P, Zafonte R, Castellani RJ.Iverson A critical review of chronic traumatic encephalopathy. Neurosci Biobehav Rev. (2015) 56:276-93. doi: 10.1016/j.neubiorev.2015.05.008
CrossRef Full Text | Google Scholar
21. Randolph C. Chronische traumatische encefalopathie is geen echte ziekte. Arch Clin Neuropsychol. (2018) 33:644-8. doi: 10.1093/arclin/acy063
CrossRef Full Text | Google Scholar
22. Falcon B, Zivanov J, Zhang W, Murzin AG, Garringer HJ, Vidal R, et al. Novel tau filament fold in chronic traumatic encephalopathy encloses hydrophobic molecules. Nature. (2019) 568:420-3. doi: 10.1038/s41586-019-1026-5
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Weir DR, Jackson JS, Sonnega A, et al. National Football League Player Care Foundation Study of Retired NFL Players. Ann Arbor: University of Michigan Institute for Social Research (2009).
Google Scholar
24. King NS, Kirwilliam S. Permanente post-concussie symptomen na licht hoofdletsel. Brain Inj. (2011) 25:462-70. doi: 10.3109/02699052.2011.558042
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Ward A, Crean S, Mercaldi CJ, Collins JM, Boyd D, Cook MN, et al. Prevalentie van apolipoproteïne E4 genotype en homozygoten (APOE e4/4) onder patiënten bij wie de ziekte van Alzheimer is vastgesteld: een systematische review en meta-analyse. Neuroepidemiologie. (2012) 38:1-17. doi: 10.1159/000334607
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Jordan BD, Relkin NR, Ravdin LD, Jacobs AR, Bennett A, Gandy S. Apolipoproteïne Eε4 geassocieerd met chronisch traumatisch hersenletsel bij boksen. (1997) 278:136-40. doi: 10.1001/jama.278.2.136
CrossRef Full Text | Google Scholar
27. Stern Y. Cognitieve reserve bij veroudering en de ziekte van Alzheimer. Lancet Neurol. (2012) 11:1006-12. doi: 10.1016/S1474-4422(12)70191-6
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Laurent CL, Buée L, Blum D. Tau en neuroinflammatie: Welke impact voor de ziekte van Alzheimer en Tauopathieën? Biomed J. (2018) 41:21-33. doi: 10.1016/j.bj.2018.01.003
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Sangobowale MA, Grin’kina NM, Whitney K, Nikulina E, St., Laurent-Ariot K, Ho JS, et al. Minocycline plus N-acetylcysteïne verminderen gedragsgebreken en verbeteren de histologie met een klinisch bruikbaar tijdvenster. J Neurotrauma. (2018) 35:907-17. doi: 10.1089/neu.2017.5348
CrossRef Full Text | Google Scholar
30. Haber M, James J, Kim J, Sangobowale M, Irizarry R, Ho J, et al. Minocycline plus N-acteylcysteïne induceert remyelinisatie, beschermt synergetisch oligodendrocyten en modificeert neuroinflammatie in een ratmodel van mild traumatisch hersenletsel. J Cereb Blood Flow Metab. (2018) 38:1312-6. doi: 10.1177/0271678X17718106
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Livingston G, Sommerlad A, Orgeta V, Costafreda SG, Huntley J, Ames D, et al. Dementia prevention, intervention and care. Lancet. (2017) 390: 2673-734. doi: 10.1016/S0140-6736(17)31363-6
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Saulle M, Greenwald BD. Chronic traumatic encephalopathy: a review. Rehabil Res Pract. (2012). 2012: 816069. doi: 10.1155/2012/816069
PubMed Abstract |Ref Full Text | Google Scholar
33. Langlois JA, Rutland-Brown W, Wald MM. The epidemiology and impact of traumatic brain injury. J Head Trauma Rehabil. (2006) 21:375-8. doi: 10.1097/00001199-200609000-00001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Martini D, Eckner J, Kutcher J, Broglio SP. Subconcussive head impact biomechanics: comparing differing offensive schemes. Med Sci Sports Exerc. (2013) 45:755-61. doi: 10.1249/MSS.0b013e3182798758
PubMed Abstract | CrossRef Full Text | Google Scholar