Introduction
Meningiomen zijn de meest voorkomende primaire neoplasma’s van het centrale zenuwstelsel (CZS) en maken meer dan 37% uit van alle primaire hersentumoren (1). Beheersopties voor meningiomen omvatten observatie, chirurgie en radiotherapie (2, 3). Hoewel een minderheid van de meningeomen agressief is, met inbegrip van de WHO-graden II en III, is meer dan 80% WHO-graad I, en wordt vaak “goedaardig” genoemd (4). Zelfs meningeomen van WHO-klasse I kunnen echter recidiveren, waarbij eerdere studies een recidiefpercentage tot 47% aantoonden bij langdurige follow-up (4, 5). Meningeomenrecidief vereist vaak behandeling met extra chirurgie of salvage radiotherapie, wat kan leiden tot morbiditeit (6, 7). Bijgevolg is het vermogen om recidief te voorspellen een cruciaal onderdeel van het beheer van meningeomen van WHO-klasse I om aanbevelingen te kunnen doen met betrekking tot de frequentie van bewakingsbeeldvorming of het gebruik van adjuvante radiotherapie.
Naast de Simpson-graad die bij de resectie werd bereikt, is een aantal tumorkarakteristieken geëvalueerd als mogelijke voorspellers van recidief, met de nadruk op histopathologische bevindingen (8). Deze omvatten de MIB-1-index (een marker van celproliferatie), herseninvasie en de aanwezigheid van atypische histologische kenmerken, waaronder verhoogde cellulariteit, afschilfering, foci van spontane necrose en nucleaire atypie (9-13). De WHO-classificaties van 2016 maken inderdaad uitsluitend gebruik van pathologische bevindingen om de tumorgraad te bepalen, waarbij graad II wordt gedefinieerd door herseninvasie en verhoogde mitose boven 4/10 high powered field (HPF) (4). Bovendien resulteren drie atypische kenmerken samen in een verhoogde tumorgraad (4). In de toekomst zullen moleculaire kenmerken van meningeomen, die onlangs in verband zijn gebracht met het risico van recidief, in de toekomst waarschijnlijk worden gebruikt bij de indeling van meningeomen (14-16).
Terwijl de WHO-classificaties de beschikbare literatuur samenvatten om duidelijke scheidslijnen tussen tumorgraden te creëren, blijft de literatuur rond de WHO-rang I meningeomenrecidief gemengd. Hoewel bijvoorbeeld herseninvasie alleen al kan leiden tot een verhoging van de tumorgraad van WHO-klasse I-II, hebben een aantal latere studies geen verband gevonden tussen herseninvasie en recidief, wat de noodzaak onderstreept van aanvullend onderzoek naar voorspellers van recidief (10, 17, 18). De bruikbaarheid van de MIB-1 index bij het voorspellen van een meningioomrecidief is ook controversieel; een studie bij meningeomen van WHO-klasse I suggereerde alleen een hoger recidiefrisico bij een MIB-1 index van >3%, maar andere literatuur die alle WHO-graden omvatte, toonde een hogere incidentie van recidief aan bij >5% of >10% (9-11). Eerdere studies hebben ook een MIB-1 cutoff van >3% voorgesteld, alleen bij patiënten met een Simpson II of III resectie, wat de verscheidenheid in MIB-1 cutoffs en hun gebruik verder aantoont (13). Ter vergelijking: een beperkt aantal studies heeft de invloed van atypische kenmerken op het recidief van meningeomen van WHO graad I onderzocht; hoewel zij een hoger risico van recidief hebben gesuggereerd in tumoren van WHO graad I die atypische kenmerken vertonen bij pathologische analyse (9).
Het doel van deze studie was dan ook om klinische, radiografische en pathologische voorspellers van recidief in meningeomen van WHO graad I te onderzoeken. Gezien het gebrek aan consensus over het gebruik van MIB-1 in meningeomen van WHO graad I, gebruiken we ook recursieve partitieanalyse om een klinisch relevante cutoff voor de MIB-1 index te identificeren. Vervolgens identificeren we voorspellers van vroege en post-mediane recidieven in WHO graad I tumoren.
Methoden
Patiëntenpopulatie
Patiënten die van 2007 tot 2017 een behandeling ondergingen voor een WHO graad I meningioom, werden retrospectief geïdentificeerd met behulp van een institutionele database. Deze studie werd formeel goedgekeurd door de Institutional Review Board van de University of California, San Francisco (IRB#13-12587). Patiënten zonder MIB-1 indexwaarden beschikbaar in het elektronisch medisch dossier werden uitgesloten. In het begin van de studieperiode werd MIB-1 verkregen naar goeddunken van de behandelend neuropatholoog, maar naarmate de tijd verstreek, werd MIB-1 verkregen bij alle patiënten met meningioom WHO graad I.
Klinische gegevens
De demografische, klinische en behandelingskenmerken van de patiënt, histopathologische gegevens en klinische resultaten werden retrospectief beoordeeld en verzameld. De verzamelde klinische gegevens omvatten de leeftijd van de patiënt, het geslacht, de Karnofsky Performance Status (KPS) bij de behandeling, de klinische presentatie en de voorgeschiedenis van behandeling van meningeomen. Histopathologische gegevens omvatten MIB-1 index, afschilfering/verlies van architectuur, verhoogde cellulariteit, necrose, nucleaire atypie, en de aanwezigheid van botinvasie. Progesteronreceptor (PR), epitheliaal membraanantigeen (EMA), CD34, S100, gliale fibrillaire en zure proteïne (GFAP) kleuringresultaten werden verzameld indien beschikbaar. Pathologische gegevens werden ontleend aan het pathologierapport dat werd opgesteld op het moment van chirurgische ingreep. Locatie en grootte van de tumor en de aanwezigheid van preoperatief peritumoraal oedeem werden bepaald met behulp van preoperatieve MRI-beeldvorming. Anterior-posterior (AP), superior-inferior (SI), en transverse (TV) diameters werden verzameld. Het preoperatieve tumorvolume werd berekend met behulp van de vergelijking voor niet-sferisch tumorvolume. Het type behandeling werd op dezelfde wijze verzameld. De graad van Simpson werd bepaald aan de hand van het operatierapport. Bruto totale (GTR) en Subtotale resectie (STR) werden bepaald met behulp van postoperatieve magnetische resonantie beeldvorming (MRI) scans.
De primaire uitkomsten van belang waren tumorrecidief en de tijd tot het recidief. Het recidief werd op postoperatieve radiografie bepaald als een lokaal recidief of progressie van de resterende tumor. De tijd tot het recidief werd bepaald vanaf de datum van behandeling van de patiënt. De duur van de follow-up werd berekend vanaf de datum van behandeling tot het laatste bezoek aan de neurochirurgische kliniek. Secundaire uitkomsten waren vroege en post-mediane recidieven. Vroege recidief werd gedefinieerd als binnen 2 jaar na de eerste behandeling (19). Post-mediane recidief werd gedefinieerd als optredend >2 jaar na de initiële behandeling.
Statistische analyse
Chi-kwadraat en Student’s t-test werden gebruikt voor de vergelijking van categorische en continue variabelen, respectievelijk. Een multivariaat backward likelihood Cox regressiemodel voor recidief werd geconstrueerd met gebruikmaking van variabelen met p < 0,200 bij univariate analyse. Op dezelfde wijze werden multivariate backward likelihood binaire logistische modellen geconstrueerd om vroegtijdige en post-mediane recidief te voorspellen, gebruik makend van variabelen met p < 0,200 bij univariate analyse. Recursieve partitioneringsanalyse (RPA) werd gebruikt om de belangrijkste risicofactoren voor algeheel, vroeg en post-mediaan meningioomherval verder te identificeren. Een p < 0,050 werd gebruikt als drempel voor statistische significantie. Alle statistische analyses werden uitgevoerd met SPSS 26.
Results
Overall Patient Demographics and Clinical Outcomes
Overall patient demographics, histopathological features, and clinical outcomes can be seen in Table 1. In totaal werden 239 patiënten met meningeomen van WHO graad I in de studie opgenomen. De gemiddelde leeftijd was 60,0 jaar, en 69,5% van de patiënten was vrouw. Het meest voorkomende symptoom was hoofdpijn (30,5%), gevolgd door een focaal neurologisch defect (27,6%). De meerderheid van de patiënten onderging alleen chirurgie (98,3%), met 2 patiënten die elk een adjuvante bestralingstherapie (0,8%) of gammames (0,8%) behandeling ondergingen. Peritumoraal oedeem was aanwezig op de preoperatieve MRI’s van 38,1% van de patiënten. Het gemiddelde berekende tumorvolume was 30,6 cm3 (range = 0,23-215,73 cm3), en de gemiddelde grootste tumorafmeting was 3,8 cm (range = 0,6-11,3 cm). In totaal bevonden 91 (38,1%) tumoren zich op de schedelbasis, 57 (23,8%) waren convexiteitstumoren, 43 (18,0%) hadden een falx/parasagittale locatie, en 55 (23,0%) hadden een andere locatie. De meeste patiënten kregen een bruto totale resectie (63,6%). De incidentie van Simpson I, II, III, en IV resectie was respectievelijk 31,4, 29,7, 2,5, en 35,6%. Atypische kenmerken waren aanwezig bij een aantal patiënten; de meest voorkomende atypische kenmerken waren botinvasie (18,0%) en afschilfering/verlies van architectuur (8,4%). De gemiddelde follow-up bedroeg 41,1 maanden (bereik: 0-147 maanden).
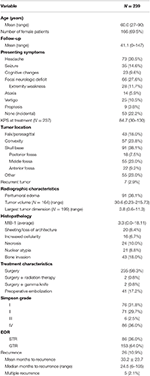
Tabel 1. Patiëntkenmerken, histopathologische kenmerken, radiografie en uitkomsten.
Voorspellers van WHO graad I Meningioomrecidief
In totaal 26 patiënten recidiveerden met een mediane tijd tot recidief van 24,5 maanden (tabel 1). Een vergelijking tussen patiënten met en zonder recidief is te vinden in Tabel 2. Er was geen verschil in leeftijd (60,2 vs. 58,8, p = 0,582) of vrouwelijk geslacht (61,5 vs. 70,4%, p = 0,353) tussen patiënten met tumoren die recidiveerden en patiënten die niet recidiveerden. De behandelingskenmerken waren vergelijkbaar tussen de groepen, waarbij de meeste patiënten in elke groep alleen werden geopereerd (100,0 vs. 98,1%, p = 1,000). Patiënten met recidiverende tumoren hadden echter een hogere incidentie van STR (61,5 vs. 32,7%, p = 0,004) en een lagere incidentie van Simpson graad I resectie (11,5 vs. 34,1%, p = 0,019). De incidentie van peritumoraal oedeem, tumorgrootte, en tumorvolume waren vergelijkbaar tussen de groepen. Bij histopathologische analyse vertoonden de patiënten met recidief een tendens naar verhoogde nucleaire atypie (19,2 vs. 7,5%, p = 0,061). Patiënten met recidief hadden ook een hogere gemiddelde follow-up (68,9 vs. 37,7 maanden, p = 0,001).
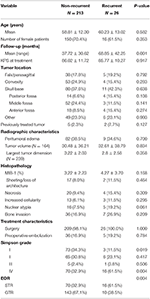
Tabel 2. Vergelijking van patiënten met recidiverende meningioma’s versus niet-recidiverende meningioma’s.
Een daaropvolgende achterwaartse waarschijnlijkheidscox-regressieanalyse bracht een onafhankelijk verband aan het licht tussen recidief en posterieure fossa tumorlocatie (HR = 5.25, CI 1,71-16,17, p = 0,004), MIB-1 index (HR = 1,18, CI 1,05-1,34, p = 0,008), nucleaire atypie (HR = 5,24, CI 1,73-15,92, p = 0,003), en STR (HR = 5,66, CI 1,30-13,92, p < 0,001; Tabel 3). Kaplan-Meier curven die de recidiefvrije overleving voor posterieure fossa locatie (p = 0,007), nucleaire atypie (p = 0,137), mate van resectie (p = 0,001), en MIB-1 >4,5% (p = 0,001) laten zien, worden getoond in Figuren 1A-D.
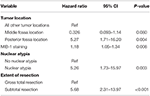
Tabel 3. Cox-regressieanalyse voor recidief.

Figuur 1. Kaplan Meier-curven van risicofactoren voor het opnieuw optreden van meningeomen van WHO graad I. (A) Nucleaire atypie (blauwe lijn) vs. geen nucleaire atypie (rode lijn) (X2 = 2,21, p = 0,137). (B) Locatie posterieure-fossa tumor (blauwe lijn) vs. andere locaties (rode lijn) (X2 = 10,36, p = 0,001). (C) MIB-1 index >4,5% (blauwe lijn) vs. ≤4,5% (rode lijn) (X2 = 6,17, p = 0,013). (D) STR (blauwe lijn) vs. GTR (rode lijn) (X2 = 10,46, p = 0,001).
Voorspellers van vroege vs. post-mediane WHO graad I Meningioomrecidief
Een vergelijking tussen niet-terugkerende patiënten en patiënten met tumoren die vroeg of post-mediane recidieven vertoonden, wordt gepresenteerd in Tabel 4. Patiënten met een vroeg recidief hadden een hogere incidentie van subtotale resectie (76,9 vs. 32,7%, p = 0,001). Zij vertoonden ook een tendens naar een hogere incidentie van nucleaire atypie (23,1 vs. 7,5%, p = 0,084) op histopathologisch onderzoek (Tabel 4). Patiënten met een post-mediane recidief neigden naar een hogere incidentie van posterieure fossa tumorlocatie (23,1 vs. 6,6%, p = 0,063) en een hogere incidentie van botinvasie (38,5 vs. 16,9%, p = 0,064) evenals een hogere MIB-1 index (5,55 vs. 3,22%, p = 0,098). Er was geen significant verschil tussen Simpson-gradering of GTR-percentages bij patiënten met een post-mediane recidief vs. niet-recidiverende patiënten (tabel 4).
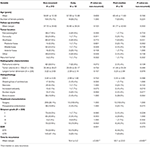
Tabel 4. Vroeg vs. post-mediane recidief.
Twee multivariate backward likelihood binaire logistische modellen werden gebruikt om voorspellers van vroeg vs. post-mediane recidief te identificeren (tabel 5). Onafhankelijke voorspellers van vroeg tumorherval waren nucleaire atypie op histopathologie (OR = 6,45, CI 1,34-31,07, p = 0,020) en STR (OR = 8,92, CI 2,18-36,46, p = 0,002). De enige onafhankelijke voorspeller van post-mediaal recidief was MIB-1 index (OR = 1,24, CI 1,05-1,45, p = 0,010), hoewel posterieure fossa locatie significantie benaderde (OR = 4,42, CI 0,954-20,49, p = 0,058; tabel 5).

Tabel 5. Binaire logistisch model voor post-mediane en vroege tumorrecidief.
Recursive Partitioning Analysis of Recurrence
RPA werd uitgevoerd om de belangrijkste risicofactoren van meningioomrecidief te identificeren (figuur 2). In overeenstemming met de cox-regressie analyse, was STR de eerste partitie bij het voorspellen van algehele recidief: 18,6% van de patiënten met een STR-resectie recidiveerde, vergeleken met 6,5% met een GTR. De volgende beslissingsknoop binnen alleen GTR patiënten betrof een MIB-1 afkapwaarde van 4,5%, aangezien 18,8% van de patiënten met een MIB-1 >4,5% recidief vertoonde tegenover 3,3% van de patiënten met een MIB-1 ≤4,5% (figuur 2A). Specifiek met betrekking tot het post-mediane recidief, identificeerde RPA het eerste beslissingsknooppunt als een MIB-1 cutoff van 5,83%: 22,2% van de patiënten met een MIB-1 >5,83% recidief vs. 3,3% van de patiënten met een MIB-1 ≤5,83%. De daaropvolgende beslissingsknoop maakte gebruik van een posterieure fossa tumor locatie: 13,3% van de patiënten met een posterieure fossa tumor recidiveerde versus 2,5% van de andere tumor locaties (Figuur 2B). RPA voor vroege recidieven identificeerde de omvang van de resectie als het primaire beslissingsknooppunt: 11,6% van de patiënten met STR recidief vs. 2,0% van de GTR patiënten. Het volgende beslissingsknooppunt was de falx of parasagittale locatie: 36,4% van de falx- of parasagittale tumoren recidiveerde tegenover 8,1% van de andere tumorlocaties (figuur 2C).
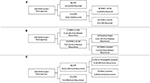
Figuur 2. Recursieve partitieanalyse die de belangrijkste risicofactoren voor (A) algemeen recidief, (B) post-mediane recidief en (C) vroeg recidief aangeeft.
Discussie
Key Results
HO graad I meningioomrecidief is onafhankelijk geassocieerd met MIB-1 index, posterieure fossa tumorlocatie, de aanwezigheid van nucleaire atypie, en STR. Meer specifiek werd een MIB-1 index van 4,5% geïdentificeerd als een klinisch relevante cutoff voor de risico-stratificatie van patiënten met meningeomen van WHO graad I na GTR. Patiënten met een >4,5% MIB-1 index en GTR van hun meningeoom van WHO graad I hadden een vergelijkbaar risico op recidief als de patiënten met een STR. Verdere analyse wees uit dat MIB-1 een kritische factor was die geassocieerd was met post-mediane recidief, terwijl de mate van resectie de belangrijkste factor was voor vroege recidief.
Predictors of WHO Grade I Meningioma Recurrence
Eerdere studies hebben op vergelijkbare wijze de relatie beoordeeld tussen histopathologische kenmerken, klinische kenmerken en recidief in alle meningioma WHO-graden. In een studie van 901 patiënten (716 WHO graad I, 174 graad II, en 11 graad III), Gousias et al. tonen een hoger risico op recidief aan bij meningiomen met een MIB-1 index van >10%, hogere WHO graad, tumorgrootte >6 cm, petroclivale of caverneuze sinus locatie, en multipliciteit (11). Gousias et al. onderzochten echter niet de relatie tussen de aanwezigheid van atypische kenmerken op histologie en tumorrecidief. Specifiek voor meningeomen van WHO graad I gebruikten Marciscano et al. een cohort van 148 patiënten met meningeomen van WHO graad I met een volledige pathologische analyse om variabelen te identificeren die geassocieerd zijn met recidief, met de nadruk op de impact van atypische pathologische kenmerken op het risico van recidief (9). Interessant is dat zij de aanwezigheid van atypische kenmerken identificeren als een onafhankelijke risicofactor naast MIB-1 index >3% en Simpson resectie. In onze studie worden chirurgische GTR en nucleaire atypie, een atypisch kenmerk, eveneens als onafhankelijke voorspellers van herval genoemd (tabel 3), hoewel wij elk atypisch kenmerk onafhankelijk hebben beoordeeld. Wij houden ook rekening met de plaats van de tumor in ons cox-regressiemodel, waarbij de plaats van de tumor in de fossa posterior verder wordt geïdentificeerd als een onafhankelijke risicofactor voor herval. Hoewel Marciscano et al. de locatie van de tumor niet opnamen in hun analyse van voorspellers van progressie, tonen Gousias et al. op vergelijkbare wijze de petroclivale locatie van de tumor aan als een risicofactor voor recidief, zij het wanneer alle WHO-meningioomgraden in aanmerking worden genomen (9, 11). Het hogere risico van recidief geassocieerd met de locatie in de fossa posterior kan te wijten zijn aan de verhoogde prevalentie van NF2 mutaties in de fossa posterior (14, 15, 20), hoewel wij niet in staat zijn om dit volledig te onderzoeken omdat wij in onze instelling niet routinematig genetische tests op meningeomen uitvoeren. Hoe dan ook, aanvullende studies met grotere WHO graad I meningioompatiëntencohorten zijn nodig om deze relatie te onderzoeken.
MIB-1 Index en WHO graad I Meningioomrecidief
Gelijkaardig aan eerdere studies (9, 11, 13, 21) evalueerden we vervolgens ook de relatie tussen de MIB-1 index van een tumor en zijn risico op recidief. Wij evalueerden eerst de MIB-1 index in een cox-regressiemodel voor algemeen recidief, zoals eerder besproken. In overeenstemming met eerdere studies vonden wij dat een hogere MIB-1 index onafhankelijk geassocieerd was met een algemeen verhoogd risico op herval. Gezien de discrepanties in afkapwaarden voor MIB-1 tussen de literatuur en de interlaboratoriumvariabiliteit, evalueerden wij MIB-1 aanvankelijk als een continue variabele. Vervolgens trachtten wij de cutoff voor MIB-1 index in onze patiëntenpopulatie te bepalen door gebruik te maken van RPA om het totale recidief te modelleren, waarbij een MIB-1 cutoff waarde van 4,5% bij patiënten met GTR werd vastgesteld (figuur 2A). Interessant genoeg hadden deze patiënten een gelijkaardig risico op recidief als patiënten met een STR, wat de bruikbaarheid van MIB-1 bij patiënten na GTR aantoont. Perry et al. identificeren op vergelijkbare wijze een MIB-1 index van 4,2% als geassocieerd met recidief na GTR bij univariate analyse, zij het wanneer alle meningeoomgraden in aanmerking worden genomen (22).
Het recidiefpercentage van 18,8% bij patiënten met een GTR en MIB-1 >4,5%, benadrukt de noodzaak van nauwlettend toezicht op deze patiënten of zelfs de overweging van adjuvante bestralingstherapie, afhankelijk van de voorkeur van de patiënt. Adjuvante bestraling na resectie van meningeomen van WHO graad I blijkt het recidief te verminderen, vooral na STR (23-25), hoewel observatie na STR de standaardpraktijk blijft (8). In een studie van 92 meningeomen van WHO graad I toonden Soyuer et al. een progressievrije overleving (PFS) van 91% aan bij patiënten die na STR adjuvante radiotherapie hadden gekregen, wat aanzienlijk hoger was dan de PFS van 38% bij patiënten die geen adjuvante radiotherapie hadden gekregen (24). Aangezien de patiënten in onze studie met een STR een vergelijkbaar risico op recidief hadden als de patiënten met een GTR en MIB-1 >4,5%, kan adjuvante radiotherapie voor beide groepen redelijk zijn. Er zijn echter grotere studies nodig om onze MIB-1 cutoff en de bijbehorende klinische implicaties verder te valideren. Prospectieve studies die het gebruik van adjuvante radiotherapie bij meningeomen van WHO graad I onderzoeken, zijn ook nodig.
Voorspellers van vroege en post-mediane WHO graad I Meningioomrecidief
Gezien de trend naar een later recidief bij patiënten met een verhoogd MIB >4.5% (figuur 1C), onderzochten we vervolgens de verschillen in voorspellers tussen patiënten die vroeg recidiveerden (gedefinieerd als binnen 2 jaar na behandeling) of post-mediaan (degenen die >2 jaar na behandeling recidiveerden). Weinig studies in de literatuur hebben voorspellers van vroege recidieven bij meningeomen onderzocht. Een studie door Budohoski et al. identificeert parafalcine locatie, STR, en peritumoraal oedeem op radiografische beeldvorming als voorspellers van vroege recidief in een cohort van 220 atypische meningiomen (26). Een soortgelijke studie van Maillo et al., bij meningeomen van WHO graad I, maakte gebruik van interfase fluorescentie in situ hybridisatie (FISH) en pathologische kenmerken om risicofactoren voor vroegtijdig recidief (gedefinieerd als 2,5 jaar na behandeling) te identificeren en vond dat grotere tumorgrootte, karyotype afwijkingen, leeftijd van de patiënt, en afwijkingen van chromosoom 10 geassocieerd waren met een verhoogd risico op recidief (19). De auteurs hielden echter geen rekening met de aanwezigheid van atypie op pathologie of MIB-1 index. Gebruikmakend van een cohort van WHO graad I meningeoom patiënten met meer korrelige pathologische en klinische gegevens, identificeerden wij de mate van resectie en nucleaire atypie op pathologie als onafhankelijke voorspellers van vroegtijdig recidief op binaire logistische regressie modellering (Tabel 5). RPA onthulde eveneens het belang van de omvang van de resectie in de risico-stratificatie van patiënten voor een vroegtijdig recidief (Figuur 2C). Interessant is dat het ook het verhoogde risico geassocieerd met falx/parasagittale tumor lokalisatie aan het licht bracht, overeenkomend met de bevindingen van Budohoski et al. (26). De enige significante voorspeller van post-mediane tumorrecidief op binaire logistische regressie modellering was MIB-1 index, hoewel posterieure fossa locatie van de tumor significantie benaderde. Dit werd verder aangetoond op RPA (figuur 2B). Verrassend genoeg was de omvang van de resectie geen onafhankelijke voorspeller van post-mediane recidieven, aangezien de meerderheid van de post-mediane recidieven een GTR had ondergaan. Post-mediane recidieven kunnen wijzen op een categorie van WHO graad I meningeomen die moleculair agressiever is en recidiveert ondanks GTR, gezien hun verhoogde MIB-1 index en posterieure fossa locatie. Vroege recidieven zijn significant meer beïnvloed door de omvang van de resectie en vertegenwoordigen daarom waarschijnlijk de verdere groei van residuele tumor in tegenstelling tot het recidief van een eerder volledig geresecteerde tumor, zoals gezien wordt bij post-mediane recidieven. Onze resultaten vertegenwoordigen dus mogelijk twee verschillende moleculaire WHO graad I meningioom subtypes. Toekomstige studies met grotere patiëntencohorten en moleculaire tumordata zijn echter nodig om de onderliggende verschillen in moleculaire veranderingen tussen vroege en post-mediane recidieven verder te onderzoeken.
Limitaties
De beperkingen van onze studie omvatten de retrospectieve aard en de lage incidentie van recidief. Onze studie omvat ook patiënten die in 2007 zijn begonnen en omspant als gevolg daarvan zowel de 2007 als 2016 WHO CNS classificatieschema’s. De enige significante verandering tussen de twee classificaties was echter de toevoeging van herseninvasie als enig criterium voor WHO graad II status. Bij slechts twee van de patiënten in ons cohort werd herseninvasie vastgesteld bij pathologische analyse, en geen van beide patiënten kwam terug. Bijgevolg denken wij niet dat de opname van patiënten die volgens het classificatieschema van 2007 werden ingedeeld, een significante invloed op onze bevindingen heeft gehad. Bovendien is onze studie gebaseerd op de pathologische rapporten na de initiële resectie, zonder een centrale revisie van de pathologische objectglaasjes. Dit kan leiden tot een verhoogde variabiliteit in de pathologische variabelen, zoals nucleaire atypie en andere gelijkaardige pathologische bevindingen die interobservervariabiliteit kunnen vertonen (27, 28). MIB-1 is echter een relatief objectieve maat met een lagere interobservervariabiliteit tussen pathologen die dezelfde methode binnen een pathologielaboratorium gebruiken (29). De praktijkpatronen met betrekking tot MIB-1 testen veranderden ook gedurende de periode van de studie van individuele voorkeur van pathologen, die varieerde afhankelijk van de patholoog, tot testen bij alle patiënten. Factoren waarmee pathologen rekening hielden bij hun beslissing om MIB-1 testen uit te voeren, waren onder meer de atypische kenmerken die in onze studie werden opgenomen, waardoor hun mogelijke invloed op onze bevindingen werd geminimaliseerd. Bovendien zijn alle meningioma’s in onze studie van WHO graad I. Bijgevolg menen wij dat een eventuele vertekening van de studie op basis van deze veranderingen in de praktijkpatronen minimaal is. Tenslotte, hoewel wij gedetailleerde klinische en pathologische kenmerken hebben opgenomen, ontbreekt in ons patiëntencohort informatie over genetische en moleculaire veranderingen van de tumor, waarvan is aangetoond dat deze een significante invloed hebben op de tumoruitkomsten (15, 30-32). Er blijft dus behoefte bestaan aan aanvullende grote multi-institutionele studies met moleculaire/genetische gegevens in aanvulling op de traditionele pathologische en klinische variabelen bij het voorspellen van algeheel recidief van meningeomen van WHO graad I. Dit omvat overweging van moleculaire/genetische prognosticatoren, zoals genoombrede methyleringspatronen (33, 34), TERT-promotormutaties (35), en aanvullende tumormoleculaire gegevens Gezien onze bevindingen is toekomstig onderzoek naar unieke genetische/moleculaire, klinische en pathologische voorspellers van vroege en latere recidieven ook gerechtvaardigd, gezien de potentiële impact op de therapeutische besluitvorming door artsen.
Niettemin biedt onze studie een gedetailleerd inzicht in klinische en histopathologische voorspellers van recidief, specifiek in meningeomen van WHO graad I. Bovendien identificeren we patiënten met een MIB-1 >4,5% als patiënten met een hoog risico op recidief na GTR. Wij gebruiken onze gegevens ook om inzicht te verschaffen in verschillen tussen vroege en post-mediane WHO graad I meningioma recidieven, waarmee mogelijk verschillende moleculaire WHO graad I meningioma subgroepen kunnen worden geïdentificeerd. Onze resultaten suggereren dat patiënten met een verhoogde MIB-1 index en nucleaire atypie op pathologische analyse, posterior fossa locatie van hun tumor, en STR een hoger risico lopen op recidief en moeten worden overwogen voor nauwere follow-up of zelfs adjuvante radiotherapie. Bovendien hebben patiënten met een MIB-1 van meer dan 4,5% een vergelijkbaar risico op recidief als degenen die STR van hun tumoren hebben ondergaan en moeten mogelijk ook worden overwogen voor adjuvante radiotherapie.
Conclusie
Er blijft een schaarste aan literatuur over specifieke voorspellers van recidief in meningeomen van WHO graad I. De bevindingen van deze studie tonen aan dat de locatie van de tumor in de achterste fossa, de MIB-1-index, atypie van de kernen en de mate van resectie onafhankelijk geassocieerd zijn met het recidief van meningeomen van graad I. Wij tonen ook aan dat patiënten met een MIB-1 >4,5% en GTR een vergelijkbaar risico op recidief hebben als patiënten met een STR. Ten slotte toonde differentiële analyse van vroege en post-mediane recidieven de associatie aan van MIB-1 index en posterieure fossa locatie in post-mediane recidieven, terwijl vroege recidieven meer significant beïnvloed werden door de omvang van de resectie. Aanvullende studies die onze bevindingen valideren en waarin moleculaire/genetische gegevens worden opgenomen zijn nodig om aanvullende voorspellers van recidief in meningeomen van WHO graad I te identificeren. Dergelijke studies zouden een nauwkeuriger kader kunnen bieden voor de risicostratificatie van patiënten en kunnen helpen bij de therapeutische besluitvorming, met inbegrip van de mogelijkheid van adjuvante radiotherapie.
Data Availability Statement
De ruwe gegevens die de conclusies van dit artikel ondersteunen, zullen door de auteurs beschikbaar worden gesteld, zonder onnodig voorbehoud.
Ethics Statement
De studies met menselijke deelnemers werden beoordeeld en goedgekeurd door de UCSF Institutional Review Board. Schriftelijke geïnformeerde toestemming voor deelname was niet vereist voor deze studie in overeenstemming met de nationale wetgeving en de institutionele eisen.
Author Contributions
AH: conceptualisering, methodologie, formele analyse, onderzoek, schrijven-origineel ontwerp, schrijven-review en redactie, en visualisatie. JY: conceptualisering, methodologie, en schrijven-revisie en redactie. IK en SS: onderzoek. J-SC: visualisatie en formele analyse. DR en MM: schrijven, herlezen en bewerken. SM: schrijven – herzien en bewerken, conceptualisering en methodologie. MA: schrijven-beoordelen en bewerken, en supervisie. Alle auteurs hebben bijgedragen aan het artikel en hebben de ingediende versie goedgekeurd.
Conflict of Interest
De auteurs verklaren dat het onderzoek is uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
De reviewer BB verklaarde een co-auteurschap in het verleden met de auteurs DR, MM, en SM aan de behandelende redacteur.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Medische behandeling van meningiomen. Huidige status, mislukte behandelingen, en veelbelovende horizonten. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Vooruitgang in multidisciplinaire therapie voor meningiomen. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. De 2016 World Health Organization classificatie van tumoren van het centrale zenuwstelsel: een samenvatting. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Long-term 25-year follow-up of surgically treated parasagittal meningiomas. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Verminderde overleving en neurologische problemen op lange termijn bij goedaardig meningioom. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. Een overzicht van meningiomen. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomas: knowledge base, treatment outcomes, and uncertainties. Een RANO review. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Benigne meningiomen (WHO graad I) met atypische histologische kenmerken: correlatie van histopathologische kenmerken met klinische uitkomsten. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Brain invasion in otherwise benign meningiomas does not predict tumor recurrence. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited: aggressive surgery and its place in modern meningioma management. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Klinische en histopathologische analyse van proliferatieve potentiëlen van recidiverende en niet-recidiverende meningiomen. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Significance of Simpson grading system in modern meningioma surgery: integration of the grade with MIB-1 labeling index as a key to predict the recurrence of WHO Grade I meningiomas – clinical article. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Genetic landscape of meningioma. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Clinical potential of meningioma genomic insights: a practical review for neurosurgeons. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molecular profiling predicts meningioma recurrence and reveals loss of DREAM complex repression in aggressive tumors. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion in meningiomas: incidence and correlations with clinical variables and prognosis. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Brain invasion assessability in meningiomas is related to meningioma size and grade, and can be improved by extensive sampling of the surgically removed meningioma specimen. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Vroege recidieven in histologisch goedaardige/grade I meningiomen zijn geassocieerd met grote tumoren en coëxistentie van monosomie 14 en del(1p36) in de voorouderlijke tumorcelkloon. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlaties tussen genomische subgroep en klinische kenmerken in een cohort van meer dan 3000 meningiomen. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopathologische kenmerken voorspellend voor lokale controle van atypisch meningioom na chirurgie en adjuvante radiotherapie. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. The prognostic significance of MIB-1, p53, and DNA flow cytometry in completely resected primary meningiomas. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Chirurgisch resultaat op lange termijn en biologische prognostische factoren bij patiënten met schedelbasismeningiomen: klinisch artikel. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Radiotherapie na chirurgie voor benigne cerebrale meningioom. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Risk group-adapted adjuvant radiotherapy for WHO grade I and II skull base meningioma. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predictors of early progression of surgically treated atypical meningiomas. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Histopathologic features predicting recurrence of meningiomas following subtotal resection. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. Het histopathologisch spectrum van menselijke meningiomen. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. MIB-1 telmethoden in meningioma’s en overeenkomst tussen pathologen. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Genetic alterations associated with progression and recurrence in meningiomas. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Moleculair biologische determinaties van meningioom progressie en recidief. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Genetic changes with prognostic value in histologically benign meningiomas. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. DNA methylering in de maligne transformatie van meningiomen. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Methylation markers of malignant potential in meningiomas. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. The prognostic significance of TERT promoter mutations in meningioma: a systematic review and meta-analysis. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar