Introduction
Rijst heeft een complexe wortelarchitectuur met een mix van embryonale en post-embryonale wortels. De kiemwortel komt als eerste te voorschijn tijdens het ontkiemen, kort daarna gevolgd door embryonale kernwortels (Rebouillat et al., 2009; Coudert et al., 2010). De eerste adventieve post-embryonale wortels die het resultaat zijn van shoot apical meristem activiteit verschijnen enkele dagen na de ontkieming van de zaailing. Onvoorziene wortels worden ook coronaire wortels of kroonwortels genoemd en worden gedurende het hele leven van een plant geproduceerd.
De interne anatomie van de rijstwortel is goed beschreven, vooral in de zaailingstadia (Rebouillat et al., 2009). Verschillende concentrische weefsels (van de periferie tot de stele) bevinden zich tussen de opperhuid en de vaatweefsels (Figuur 1). Deze weefsels, die samen het “grondweefsel” worden genoemd, worden soms ook de “cortex” genoemd (Lux et al., 2004). Hier behouden wij de generieke term, d.w.z., grondweefsel, om de exodermale, sclerenchyma, corticale, en endodermale weefsels te beschrijven. Wij verwijzen naar de “cortex” als het weefsel dat zich tussen de endodermis en de sclerenchyma bevindt.
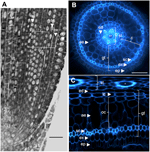
Figuur 1. Anatomie van een 6-dagen-oude Nipponbare kiemwortel. (A) Longitudinale doorsnede van een gefixeerde en in paraplast ingebedde kiemwortel. Balk = 100 μm. (B) Dwarsdoorsnede van een verse kiemwortel, geobserveerd onder UV-licht. Bar = 50 μm. (C) Polair getransformeerd beeld van B. Weefsellagen zijn als volgt gelabeld: stele (st), grondweefsel (gt), bestaande uit verschillende cellagen: een laag endodermis (ed), verschillende lagen cortex (c), een laag sclerenchyma (sc), en een laag exodermis (ex). De endodermale (ed) en exodermale (ex) lagen zijn gemakkelijk te herkennen aan de afwezigheid/afname van fluorescentie in de celwandcentra van deze cellen. De kiemwortel wordt beschermd door één laag opperhuid (ep). Er kunnen twee soorten corticale lagen worden onderscheiden: de binnenste cortex (ic), die naast de endodermis (ed) ligt, en de buitenste cortex (oc), die uiteindelijk het aerenchym (ae) zal vormen. Let in de stele op de aanwezigheid van een groot centraal metaxylem (cx) omgeven door 6 metaxylem (x) vaten.
Grondweefsel bestaat uit verschillende lagen weefsels die dezelfde parenchymachtige oorsprong hebben maar verschillende specifieke kenmerken die verschillende en belangrijke structurele en functionele rollen spelen in wortels. Zo zijn de exodermis en endodermis apoplastische barrières die het radiale transport van water en nutriënten van de bodem naar de fotosynthetische organen regelen, een eigenschap die meestal wordt geleverd door de afzetting van suberinelamellen en de differentiatie van de secundaire celwand (Gregory, 2006). Sclerenchyma zijn lignified cellen die een kritische barrière vormen voor sommige metalen en mogelijk een mechanische ondersteunende rol spelen (Huang et al., 2012). In tegenstelling tot deze drie eenlagige weefsels, bestaat het corticale weefsel in de rijstwortel uit vier of vijf lagen. Dit weefsel, dat ook de middencortex of mesodermis wordt genoemd, wordt gekenmerkt door de schizogene vorming van ruimtes, wat leidt tot de vorming van aerenchym in rijst (Justin en Armstrong, 1991; Kawai et al., 1998). Aerenchym speelt een belangrijke rol bij de tolerantie tegen overstromingen en zorgt voor een continue zuurstoftoevoer van de scheut naar de wortel, waardoor wortelgroei onder anoxische omstandigheden mogelijk wordt. De cortex heeft een belangrijke maar variabele functie in de wortelfysiologie van talrijke soorten en is betrokken bij opslag, overstromingstolerantie of symbiotische interacties (Lux et al., 2004).
De kiemwortel en kroonwortels produceren drie soorten zijwortels: kleine zijwortels (SLR’s) en twee soorten grote zijwortels (Kawata en Shibayama, 1965; Kono et al., 1972; Rebouillat et al., 2009). Deze indeling is gebaseerd op (i) worteldiameter: SLR’s zijn de kleinste (50-60 μm) en L-LLR’s zijn de grootste (120-150 μm), (ii) vertakkingen, die alleen bij LLR’s worden waargenomen, (iii) de aanwezigheid van een centraal metaxyleemvat alleen bij LLR’s, en (iv) de aanwezigheid van een sclerenchyma-laag alleen bij L-LLR’s (Kono et al., 1972; Kawata et al., 1977; Rebouillat et al., 2009). Ondanks deze classificatie blijft de identiteit van de interne wortelweefsels in zijwortels, vooral in SLR’s, onzeker. Rebouillat et al. (2009) en Kawata et al. (1977) beweerden immers allebei dat het grondweefsel van de SLR bestond uit de endodermis, sclerenchyma en exodermis (van binnen naar buiten), terwijl Kono et al. (1972), de binnen-cortex sclerenchymatous cell layer werd beschreven als afwezig in SLRs en T-LLRs.
Om dit dilemma op te lossen, en om de ontwikkeling en functie van bepaalde weefsels in het algemeen te bestuderen, is het gebruik van identiteitsmerkers nodig. De meeste tot nu toe gebruikte weefselmerkers zijn morfologische merkers of histochemische kleurstoffen, die een bruikbare manier bieden om de celidentiteit te karakteriseren. Berberine onthult de aanwezigheid van suberine in celwanden, dat bijna uitsluitend wordt aangetroffen in de Casparian stroken die elke individuele endodermis cel omgeven en is dus een goede indirecte merker van endodermale identiteit (Brundett et al., 1988). In A. thaliana werden ook weefselspecifieke merkers ontwikkeld door gebruik te maken van weefselspecifieke promotors gefuseerd met reportergenen (GUS en/of GFP) in genetisch gemodificeerde planten. Zo wordt de SCARECROW-promotor gebruikt als een endodermale identiteitsmerker (Sugimoto et al., 2010). QC25 en QC46 enhancer trap GUS lijnen (Sabatini et al., 2003) en QHB in rijst (Kamiya et al., 2003) werden ook geïdentificeerd als quiescent center (QC) merkers op basis van hun QC-specifieke expressie. Ondanks de belangstelling voor deze merkers zijn er slechts enkele beschikbaar en bijna uitsluitend in A. thaliana. Zij hebben ook nadelen. Zo is de geschiktheid van het gebruik van de SCARECROW (SCR) promoter als “endodermis” merker betwistbaar wanneer specifieke vragen over de rol van SCR en SHORT ROOT (SHR) in de differentiatie van grondweefsel aan de orde worden gesteld. De SCR- en SHR-genen zijn immers per se betrokken bij de vorming van de endodermis/cortex (Wu en Gallagher, 2014). In A. thaliana zijn de enige beschikbare wortel cortex markers de Co2 en Co3 promoters (Heidstra et al., 2004; Ten Hove et al., 2010). In rijst worden deze cortex merkers nog niet gebruikt omdat er geen duidelijke orthologs voor de Co2 en Co3 genen zijn. Tot dusver zijn in rijst alleen indirecte morfologische merkers gebruikt, zoals aerenchymvorming voor corticale identiteit (Rebouillat et al., 2009).
Een andere klasse merkers zijn commercieel verkrijgbare antilichamen gericht tegen plantencelwanden (http://www.plantprobes.net/index.php). Deze merkers zijn in het verleden nauwelijks gebruikt, maar hun doeltreffendheid is aangetoond. Zo werden de celwandantilichamen CCRC-M2 en JIM13 gebruikt in A. thaliana om aan te tonen dat de enkele laag inwendig weefsel van de shr-mutant corticale identiteit had, terwijl de grondweefsellaag van de scr-mutant meerdere identiteiten vertoonde (Di Laurenzio et al., 1996; Helariutta et al., 2000). Deze markers hebben vele voordelen: hun eenvoud en de mogelijkheid van het combineren van secundaire antilichamen gekoppeld aan verschillende fluorochromen om overlapping met auto-fluorescentie te beperken, ze vereisen geen genetische transformatie en ze kunnen worden gebruikt om andere klassen van markers aan te vullen.
In dit artikel beschrijven we eerst een eenvoudige medium-throughput protocol voor immunolabeling verse vibratome weefseldoorsneden. Met behulp van dit protocol, we gescreend radiale secties van rijst radikels met een grote bibliotheek van 174 celwand antilichamen. Onder deze, identificeerden wij acht cortex-specifieke markers en aangetoond dat rijst twee types van corticale weefsels met verschillende identiteit bezit. We noemden deze lagen de binnenste en buitenste cortex op basis van hun respectieve anatomische positie in de wortelsecties. Om de bruikbaarheid van deze cortex-specifieke markers aan te tonen, hebben wij de identiteit van de grondweefsels van zijwortels opgehelderd met behulp van drie van deze antilichamen. In SLRs in het bijzonder, tonen we aan dat de interne weefsellaag een buitenste corticale identiteit heeft. Ons protocol is generiek genoeg om te worden gebruikt voor de ontwikkeling van weefselmerkers in elke soort zonder de noodzaak om transgene planten te genereren. Dit protocol kan gemakkelijk worden aangepast met verse scheut, blad, wortel, of elk weefsel in andere planten en vertegenwoordigt een eenvoudige en gemakkelijke manier om weefsel-specifieke markers te identificeren. Bovendien kunnen deze markers worden gebruikt in combinatie met andere moleculaire markers.
Results
Immunoprofiling of Cell Wall Antibodies in Rice Root Radial Sections Reveals Specific Antibodies for Cortex Layers
Met het oog op het identificeren van antilichaam-gebaseerde markers voor corticale cellen, hebben we eerst een protocol voor medium throughput immunolabeling van radiale secties van verse rijstwortels (zie Materials and Methods en Supplementary Figure 1 voor details). Vervolgens hebben we een scherm met monoklonale antilichamen tegen celwand componenten (van de Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) en Paul Knox Cell Wall lab (Universiteit van Leeds, UK), zie Materialen en Methoden voor details)) om cortex markers te identificeren. Van de 174 geteste antilichamen werden er slechts 12 als cortex-specifiek beschouwd. Wij testten hun herhaalbaarheid door twee extra experimenten uit te voeren en concludeerden dat acht antilichamen vergelijkbare en robuuste profielen vertoonden onder de drie replicaten (figuur 2). Vijf antilichamen (JIM7, M14, M38, M130, en M131) gaven hetzelfde immunolabelingpatroon in de cortex. Alleen niet-aangrenzende celwanden werden gelabeld, wat resulteert in een enkelvoudige “ruitvorm” labeling van alle corticale cellen. Voor de drie andere antilichamen (LM5, M133, en M107), werd de labeling gedetecteerd in de cortex en soms de sclerenchyma cellen, met name met de LM5 en M107 antilichamen. Het signaal was homogeen op de cortexcelwand, maar was veel zwakker in de binnenste cortexlagen (de cortexlaag die grenst aan de endodermale laag) dan in de buitenste cortexlagen. Al deze antilichamen met profielen die complementair zijn aan corticale weefsels zijn dus specifieke merkers die kunnen worden gebruikt om de corticale celidentiteit te analyseren. Bovendien zijn de twee verschillende corticale labels, het definiëren van twee subcorticale gebieden, suggereren dat de buitenste en binnenste lagen een verschillende moleculaire identiteit die werd onthuld door deze antilichamen hebben.
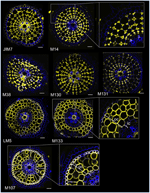
Figuur 2. Identificatie van acht specifieke cortex antilichamen (JIM7, M14, M38, M130, M131, LM5, M133, en M107) onder de 174 gescreend van de monoklonale celwand antilichaam bibliotheek. Voor elk antilichaam werden samengevoegde beelden van dwarsdoorsneden verkregen onder een confocale microscoop na immunohistologische labeling: in geel, antilichaampatroon bij 561 nm, en in blauw, celwand-autofluorescentie onder UV-licht. Vijf antilichamen (JIM7, M14, M38, M130, en M131) vertonen een vergelijkbaar profiel binnen alle corticale cellagen die gekleurd zijn (ruitvormen). Drie antilichamen (LM5, M133, en M107) homogeen gelabeld corticale celwanden. Merk op dat voor deze antilichamen, binnenste corticale (ic) lagen zijn niet gekleurd in vergelijking met buitenste corticale (oc) lagen. Inzetstukken zijn close-ups van de overeenkomstige beelden. Bars = 20 urn.
Sommige specifieke kenmerken van deze twee subcorticale lagen werden gemarkeerd wanneer de “polaire transformator” plugin van de ImageJ software (http://imagej.nih.gov/ij/) werd gebruikt om de beelden van de wortel secties (Figuren 1B,C; Schneider et al., 2012; Lartaud et al., 2014) te bekijken. De binnenste cellen werden gekenmerkt door een dikke celwand in vergelijking met de buitenste cellen, die verschillende luchthoudende holten vertoonden als gevolg van celwandfusie. De binnenste corticale cellen vertoonden ook een afgeplatte vorm die leek op endodermale cellen, in tegenstelling tot de buitenste cellen, die ronder waren. In dit getransformeerde beeld, de radiale celwand die van de binnenzijde van de cel naar de buitenzijde loopt, is de autofluorescentie van de endodermale en exodermale cellen niet zichtbaar, vermoedelijk door de aanwezigheid van Casparian stroken. Evenzo, maar in mindere mate, waren kleine gaatjes vrijgesteld van autofluorescentie ook zichtbaar op de radiale celwanden van de binnenste corticale cellen.
Alle zijworteltypes bezitten alleen buitencorticaal weefsel
Om de bruikbaarheid van de cortex-markers aan te tonen en celidentiteiten te karakteriseren, hebben we de drie rijst zijworteltypes (L-LLR, T-LLR en SLR) gelabeld met drie van deze antilichamen (M107, M133, en M14). Omdat L-LLR’s zich niet vaak ontwikkelen op petrischalen, werden voor dit experiment zijwortels verzameld van rijstzaailingen die gedurende 2 weken onder hydrocultuur werden gekweekt. We analyseerden eerst de grond weefsel organisatie van elk type zijwortel door het observeren van de autofluorescentie van de celwanden in de transversale en polaire aanzichten van de wortel secties (figuur 3). Deze eerste analyse onthulde een enigszins verschillende interne radiale anatomie voor de drie types van laterale wortels. Net als bij de onder UV-licht bekeken wortelsecties kunnen de endodermale en exodermale weefsels worden geïdentificeerd door de fluorescentie-uitdoving in het midden van de radiale celwanden. Deze twee weefsels waren in alle zijwortels aanwezig. Tussen de endodermis en exodermis waren verschillende weefsellagen aanwezig in de L-LLR’s en T-LLR’s, terwijl de SLR’s slechts één (niet-geïdentificeerde) cellaag bezaten. De anatomie van de L-LLR’s leek op die van de zaadwortels en buiten de endodermis waren verschillende lagen corticaal weefsel gemakkelijk te herkennen bij de vorming van aerenchymweefsel. Bovendien werd ook een sclerenchyma-laag waargenomen, bestaande uit dicht opeengepakte cellen met brede celwanden. Afhankelijk van het experiment was deze cellaag niet altijd volledig ontwikkeld. In de T-LLR-secties leek de uitwendige laag op corticaal weefsel en de inwendige laag op de enkele (niet-geïdentificeerde) SLR-laag.
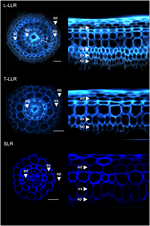
Figuur 3. Weefselsamenstelling van de Large Lateral Root-types (Large-LLR en Thin-LLR) en Small Lateral Root (SLR). Zaailingen werden gedurende 2 weken onder hydrocultuuromstandigheden opgekweekt. Celwandautofluorescentie van dwarsdoorsneden en polair getransformeerd beeld onder UV-licht. De weefsels zijn als volgt gelabeld: epidermis (ep), exodermis (ex), cortex (c), endodermis (ed). Merk op dat de epidermis (ep) vaak gefragmenteerd was in de loop van het experiment. Bars = 20 um.
Om de cel lagen aanwezig in de SLR en T-LLR grondweefsels te identificeren en om de corticale identiteit te bevestigen in de L-LLRs, we immunolabeled laterale wortel secties met drie cortex-specifieke antilichamen (M107, M133 en M14; figuur 4). De M107 en M133 antilichamen labelden alle cellagen gelegen tussen de endodermis en exodermis in alle laterale wortels. Gebaseerd op radikelkleuring voor deze antilichamen, gaf deze observatie aan dat deze cellagen sclerenchyma of corticale identiteit zouden kunnen hebben. Het feit dat M14 deze lagen ook van een immunolabel voorzag, met name in de SLR-secties, toont echter duidelijk aan dat deze lagen een buitenste corticale identiteit hadden.

Figuur 4. Samengevoegde beelden van de grote zijworteltypes (Large-LLR en Thin-LLR) en kleine zijwortelsecties (Small Lateral Root, SLR), geïmmunolabeld met M107, M133 en M14. Zaailingen werden gekweekt onder hydrocultuur omstandigheden gedurende 2 weken. In geel, antilichaam labeling bij 561 nm, en in blauw, autofluorescentie onder UV-licht. De weefsels zijn als volgt gelabeld: epidermis (ep), exodermis (ex), cortex (c), endodermis (ed). Merk op dat de epidermis (ep) vaak gefragmenteerd was in de loop van het experiment. Bars = 20 μm.
Variaties in het aantal buitenste corticale cellagen (één in de SLR’s, twee in de T-LLR’s, drie in de L-LLR’s en vier tot vijf in de kiemwortel) spelen een belangrijke rol in de rijstworteldiameters (Figuur 5).
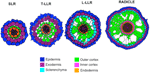
Figuur 5. Schematische voorstelling van de laterale wortel- en kiemwortelweefsels.
Conclusies
Er zijn reeds verschillende termen gebruikt om subcorticale gebieden in planten te kwalificeren. Zo is de aanwezigheid van een “binnenste” gelignificeerde cortexlaag, vergelijkbaar met de hier bestudeerde, al beschreven in wilde rijst (Yang et al., 2014). In maïs zijn de twee corticale domeinen anders gedefinieerd (Baluška et al., 1993). Het “binnenste” domein vormt aerenchyma, dat hier overeenkomt met de buitenste cortex, en de “middelste-buitenste” cortex is een lignified steunweefsel, dat sclerenchyma zou kunnen zijn. In Arabidopsis is ook een “middelste cortex” cellaag, gelegen tussen de corticale monolaag en de endodermis, beschreven (Baum et al., 2002; Paquette en Benfey, 2005). Recente resultaten suggereren dat deze cortexlaag, waarvan de vorming wordt gereguleerd door onder andere GA, oxidatieve stress, en SHR en SCR, een rol speelt in abiotische tolerantie (Paquette en Benfey, 2005; Cui en Benfey, 2009; Pauluzzi et al., 2012; Wu en Gallagher, 2014). Interessant is dat deze laag ook wordt beschreven als een helix-achtige laag met een typische vorm (Baum et al., 2002). Zou deze Arabidopsis “midden cortex” laag functioneel en structureel vergelijkbaar zijn met de binnenste cortex laag van de rijst radikel? In longitudinale en transversale doorsneden van rijst vormt de binnenste corticale laag gewoonlijk ook een helix, wat suggereert dat deze twee weefsellagen vergelijkbaar zouden kunnen zijn. In Arabidopsis is de “middencortex”-laag afkomstig van een periclinale deling van de endodermis, die tussen 7 en 14 dagen na de ontkieming weg van de QC verschijnt (Paquette en Benfey, 2005). Nieuwe instrumenten zullen nodig zijn om deze belangrijke parameters in rijst te verifiëren. Zo is er tot nu toe geen mutant beschreven die de timing van de vorming van deze laag beïnvloedt. Bovendien is ook technische vooruitgang nodig bij de beeldvorming van het QC in rijst. Niettemin bieden onze cortex-specifieke merkers een nieuw instrument om de functie en het moleculaire netwerk te vergelijken dat betrokken is bij de vorming van de binnenste cortex (rijst) versus de “middelste cortex” (Arabidopsis). In ons laboratorium wordt gewerkt aan de identificatie van de moleculaire determinanten van binnenste en buitenste cortexvorming, met SCR en SHR rijst-orthologs als eerste kandidaten voor de regulatie van cortexvorming in rijstwortels (Pauluzzi et al, 2012).
Materialen en Methoden
Plantmateriaal
Zaaiplanten van zes dagen
Zaden van de Oryza sativa L. ssp. japonica Nipponbare cultivar werden verticaal gekweekt in steriele petrischalen (Corning, 431301; 20 × 20 cm) onder gecontroleerde omstandigheden (dag/nachtritme: 12/12 uur, 28/25°C, lichtintensiteit: 500 μE m-2 s-1). Eerst werden de zaden aan de oppervlakte gesteriliseerd door ze gedurende ~1 min. in 70% ethanol te spoelen. Daarna werd de ethanol vervangen door een oplossing van 40% bleekmiddel in gedistilleerd water met drie druppels tween 80 (Sigma-Aldrich P4780-500 mL). De zaden werden gedurende 30 minuten onder zacht roeren in deze oplossing geweekt en vervolgens ten minste viermaal gespoeld met steriel gedestilleerd water. Heet (~50°C) in een autoclaaf gesteriliseerd Murashige en Skoog (MS/2) medium op halve sterkte (250 ml) wordt in petrischaaltjes gegoten, en gedurende ~45 min. gestold gelaten. Het MS/2-medium bestaat uit 2,15 g.L-1 MS-medium basaalzoutmengsel (Duchefa Biochemie, M0221), 75 mg.L-1 MS-vitaminemengsel (Duchefa Biochemie, M0409), en 8 g.L-1 agarose type II (Sigma-Aldrich, A6877). Steriele zaden worden vervolgens in het verharde MS/2-medium geduwd met de kiemwortel naar beneden gericht. De wortels werden na 6 dagen groei geoogst.
Vier weken oude planten
Na 3 dagen ontkieming in water werden de zaailingen overgebracht naar een hydrocultuursysteem onder gecontroleerde omstandigheden (dag/nachtritme: 12/12 uur, 28/25°C, lichtintensiteit: 500 μE m-2 s-1, relatieve vochtigheid: 55%). Het hydrocultuursysteem bestaat uit een plastic doos van 50 liter met 30 liter hydrocultuuroplossing, waarop een schuimmatras van 1 cm dik is gelegd. De schuimmatras is doorboord met openingen om de stengelbasis van de zaailingen te behouden. Het hydroponisch medium bestaat uit (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM), en KH2PO4 (0,6 mM). De oplossing wordt belucht door een pomp die op de bodem van de plastic box is geplaatst en om de 10 dagen wordt ververst. De pH werd aangepast en gehandhaafd op 5,4 ± 0,2.
Fresh Root Sectioning
De uiteinden van groeiende radikels of zijwortels (2 cm) werden gesneden met een scherp mes en evenwijdig aan elkaar geplaatst om de wortelpunten uit te lijnen (Supplementaire figuren 1A,B). Ze werden ingebed in een druppel 3% gesmolten agarose (50 ° C; Supplementaire figuur 1C). Patches met wortelpunten werden ingevoegd in een 3 × 1 × 1-cm goed gevuld met 3% gesmolten agarose (Supplementaire figuur 1D). Na verharding, werden blokken verkleind en gelijmd op een vibratome plaat te worden gesneden. De vibratome (Hm650v (Thermo Scientific Microm)) parameters waren snelheid 30, frequentie 70, amplitude 0,8, en dikte 60 pm (Supplementary Figuur 1E). Secties werden overgebracht ofwel op kamer dia’s (Lab-teak 177402) voor immunokleuring (Supplementary Figuur 1F), of op dia’s bevochtigd met 1X alkalisch fosfaat buffer (PBS, Sigma-Aldrich P3813) voor observation.
Immunolocalisatie
De secties geplaatst op de kamer dia’s (drie per kamer) werden eerst gespoeld in 0,1 M glycine aangevuld met 1X PBS en vervolgens tweemaal in 1X PBS, elk gedurende 10 minuten. De weefsels werden vervolgens ondergedompeld in een PBS-oplossing met 5% boviene foetaal serum (blokkeeroplossing, Thermo Fisher 37520) bij 4 ° C gedurende de nacht onder agitatie. Primaire antilichamen, verdund 1/10 in deze blokkeeroplossing, werden ’s nachts bij 4°C onder agitatie aangebracht. De secties werden vervolgens 3 keer gespoeld in PBS 1X gedurende 10 min. De wortelsecties werden gedurende 2 uur geïncubeerd met het secundaire antilichaam, 500-voudig verdund in de blokkeeroplossing, onder agitatie. Deze antilichamen werden gekoppeld aan een fluorofoor, Alexa 546 anti-rat antilichaam (Invitrogen A11081) of Alexa 546 anti-muis antilichaam (Invitrogen A11060). Vervolgens werden de coupes driemaal gespoeld in 1X PBS onder agitatie, telkens gedurende 10 min. De kamers werden verwijderd en enkele druppels mowiol-montagemedia (Sigma-Aldrich 81381) werden toegevoegd. Een dekglaasje werd geplaatst op de wortel secties, die mochten drogen gedurende 36 uur bij 4 ° C in het donker.
Paraplast Fixatie
Radicles gekweekt op petrischalen gedurende 6 dagen werden gefixeerd in 4% paraformaldehyde (in PBS 1X) overnacht bij 4 ° C en tweemaal gespoeld met PBS 1X (Jackson, 1991). De gefixeerde weefsels werden gedehydrateerd in ethanol, geklaard in Histochoice Clearing Agent (HistoClear, Sigma Aldrich), en ingebed in Paraplast (Fisher). De weefsels werden gesneden (6 pm dik) op een Leica RM2255 microtoom en gemonteerd op SuperfrostPlus dia’s (Fisher).
Microscopie
Bright field en autofluorescentie waarnemingen werden uitgevoerd met behulp van een Leica DM4500 microscoop. Voor autofluorescentie werden beelden gemaakt met het “A”-filterblokje (excitatiebereik: UV; excitatiefilter: BP 340-380; onderdrukkingsfilter: LP 425). Immungekleurde coupes werden geobserveerd met confocale microscopen: Zeiss LSM 510 of Leica SP8. De celwanden werden eerst gevisualiseerd met autofluorescentie. Het secundaire antilichaam werd gevisualiseerd met een Helium/Neon laser bij respectievelijk 543 of 561 nm. Foto’s werden genomen met een kleur Retiga 2000R camera (QIMAGING, Canada) met Volocity beeldacquisitie software (Improvision, UK).
Author Contributions
SH, FD, MB, CB: acquisitie van gegevens; SH, CP, AD analyse van gegevens; SH, EG, CP, AD: opstellen van het manuscript.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
Wij danken MRI (Montpellier RIO Imaging plateform), PHIV en La Gaillarde Plateforms voor hun technische ondersteuning voor immunolokalisatie en / of confocale en multiphoton beeldvorming. SH wordt ondersteund door een CIRAD PhD fellowship.
Aanvullend materiaal
Het aanvullend materiaal voor dit artikel kan online worden gevonden op: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Afkortingen
ae, aerenchym; c, cortex; ed, endodermis; ep, epidermis; ex, exodermis; gt, grondweefsel; ic, binnenste cortex; L-LLR, groot-type grote zijwortel; oc, uitwendige cortex; sc, sclerenchyma; SLR, kleine zijwortel; st, stele; T-LLR, dun-type grote zijwortel; x, xyleem.
Baluška, F., Brailsford, R.W., Hauskrecht, M., Jackson, M.B., and Barlow, P.W. (1993). Cellular dimorphism in the maize root cortex: involvement of microtubules, ethylene and gibberellin in the differentiation of cellular behaviour in postmitotic growth zones. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). Apicale organisatie en maturatie van de cortex en vasculaire cilinder in Arabidopsis thaliana (Brassicaceae) wortels. Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). A Berberine-aniline blue fluorescent staining procedure for suberin, lignin, and callose in plant tissue. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., and Gantet, P. (2010). Genetische controle van wortelontwikkeling in rijst, het modelgraan. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). Interactie tussen SCARECROW, GA en LIKE HETEROCHROMATIN PROTEIN 1 in grondweefselpatroon in de Arabidopsis wortel. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). Het SCARECROW gen reguleert een asymmetrische celdeling die essentieel is voor het genereren van de radiale organisatie van de Arabidopsis wortel. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Plant Wortels: Growth, Activity, and Interaction with Soils. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., and Scheres, B. (2004). Mozaïek analyses met behulp van gemarkeerde activerings- en deletieklonen ontrafelen Arabidopsis SCARECROW actie in asymmetrische celdeling. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). Het SHORT-ROOT gen controleert radiale patroonvorming van de Arabidopsis wortel via radiale signalering. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). Een leucine-rich repeat receptor-like kinase gen is betrokken bij de specificatie van buitenste cellagen in rijstwortels. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). “In-situ hybridization in plants” in Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Evidence for the involvement of ethylene in aerenchyma formation in adventitious roots of rice (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., and Matsuoka, M. (2003). Isolation and characterization of a rice WUSCHEL-type homeobox gene that is specifically expressed in the central cells of a quiescent center in the root apical meristem. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., and Uchimiya, H. (1998). Cellular dissection of the degradation pattern of cortical cell death during aerenchyma formation of rice roots. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., and Yamazaki, K. (1977). On the structure of the crown root and the lateral root, and the vessel connection between them, in rice plants. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., and Shibayama, B. (1965). On the lateral root primordia formation in the crown roots of rice plant. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., and Yamada, N. (1972). Studies on the developmental physiology of the lateral roots in rice seminal roots. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: een gesuperviseerde beeldanalyse tool voor rijstwortel anatomische parameter kwantificering. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). Root cortex: structural and functional variability and responses to environmental stress. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., and Benfey, P. N. (2005). Rijping van het grondweefsel van de wortel wordt gereguleerd door gibberelline en SCARECROW en vereist SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., and Périn, C. (2012). Surfen langs de wortel grondweefsel gennetwerk. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Moleculaire genetica van rijstwortelontwikkeling. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW is betrokken bij de positionering van de stamcel niche in de Arabidopsis wortel meristeem. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., and Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 jaar beeldanalyse. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., and Meyerowitz, E. M. (2010). Arabidopsis regeneratie van meerdere weefsels optreedt via een wortelontwikkeling pathway. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., and Heidstra, R. (2010). SCHIZORIZA codeert voor een nucleaire factor die de asymmetrie van stamceldelingen in de Arabidopsis wortel reguleert. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., and Gallagher, K. L. (2014). De beweging van de niet-cel-autonome transcriptiefactor, SHORT-ROOT vertrouwt op het endomembraan systeem. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., and Seago, J. L. (2014). Anatomie en histochemie van wortels en scheuten in wilde rijst (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar