Bij Exelead benaderen we contractproductie met een gerichte expertise op het gebied van liposomale en PEG-gekoppelde formuleringen voor de behandeling van zeldzame ziekten en kleine of achtergestelde bevolkingsgroepen. Wij zijn gespecialiseerd in de ontwikkeling en productie van parenterale geneesmiddelen op basis van lipiden, en ons team heeft meer dan 20 jaar ervaring in het werken met een breed scala aan preklinische, klinische en commerciële klanten voor contract manufacturing.
Wat zijn liposomen, en hoe worden ze gebruikt bij de levering van geneesmiddelen?
Liposomen zijn gespecialiseerde leveringsvehikels die meerdere rollen vervullen bij het verbeteren van de mogelijkheden van actieve farmaceutische ingrediënten (API’s). Ten eerste kunnen ze een geneesmiddel beschermen tegen detectie door het immuunsysteem van het lichaam, door biologische membranen na te bootsen en het geneesmiddel meer tijd te geven om de beoogde bestemming te bereiken. Ten tweede helpen ze bij het solubiliseren van zeer lipofiele geneesmiddelenmoleculen of moduleren ze de farmacokinetiek en de biodistributie van de API, waardoor bijwerkingen tot een minimum worden beperkt en het veiligheidsprofiel van het product wordt verbeterd.
Liposomen bezitten een unieke vesiculaire structuur. Deze vesikels bestaan uit een lipide-bilaag die zich vormt in de vorm van een holle bol met daarin een waterige fase. Als zodanig kan elke interessante lading in liposomen worden ingekapseld, hetzij in het waterige compartiment (als het wateroplosbaar/hydrofiel is), hetzij in de lipide-bilaag (als het vetoplosbaar/lipofiel is).
Enkele van de primaire lipiden die worden gebruikt om liposomen te maken zijn fosfolipiden en sfingolipiden. Deze twee categorieën lipiden zijn uniek in die zin dat zij een kopgroep hebben die van water houdt/hydrofiel is en een staartgroep die van water houdt/lipofiel is. Door hun amfifiele aard assembleren deze moleculen zich spontaan tot liposomen en andere unieke 3D-structuren wanneer zij aan waterige oplossingen worden toegevoegd. De vorm of morfologie van de 3D-structuren is afhankelijk van een groot aantal verschillende factoren, bijvoorbeeld de samenstelling van de lipiden, de temperatuur, de pH of de aanwezigheid van andere buffers, zouten en suikers in het water.

Image Source: Chem Libre Texts
Hoe werkt een geneesmiddel in op het lichaam en komt het beschikbaar voor gebruik wanneer het is geformuleerd als een liposomaal geneesmiddel?
De afgelopen jaren hebben liposomen aanzienlijke aandacht getrokken als een vertrouwde klasse van geneesmiddelenafleveringsmiddelen. Hun zelf-gesloten structuren kunnen meerdere geneesmiddelen in één keer inkapselen, waarbij ingesloten lading wordt beschermd tegen hydrolyse en afbraak. Bovendien kunnen doelproteïnen en functionele liganden op het buitenste omhulsel van de lipide bilaag nieuwe functionaliteiten toevoegen, waardoor liposomen gericht de cellen kunnen binnenkomen, hetzij via antilichamen of receptorgerichte liganden. Deze liganden hechten zich aan celreceptoren die in bepaalde zieke cellen overgeëxpresseerd zijn, waardoor het geneesmiddel door het celmembraan kan binnendringen.
“Liposomen beschermen geladen geneesmiddelmoleculen tegen externe degradatie, en hun gelijkenis met biologische membranen biedt unieke mogelijkheden om geneesmiddelmoleculen in cellen of subcellulaire compartimenten af te leveren … Bovendien kunnen verschillende fysisch-chemische eigenschappen van liposomen – waaronder hun grootte, lading en functionele liganden aan het oppervlak – worden gewijzigd, wat resulteert in functionaliteiten die specifieke geneesmiddelentaken bevorderen. Deze voordelen hebben van liposomen een toonaangevend platform voor medicijnafgifte gemaakt met een breed scala aan toepassingen in de kliniek.”
– Liposoom-achtige nanostructuren voor medicijnafgifte | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Typisch worden liposomen vervaardigd als steriele injectables voor aflevering aan de bloedbaan, en afgifte van het geneesmiddel vindt plaats wanneer lipidenveloppen afbreken – wat kan gebeuren in een extracellulaire of intracellulaire omgeving.
Verschillende strategieën zijn toegepast om conventionele liposomen te ontwerpen met getriggerde afgiftecapaciteiten, waardoor de therapeutische werkzaamheid wordt verbeterd door de liposomen de ingekapselde API of “lading” te laten afgeven op basis van een stimulusrespons. Deze afgifte wordt ofwel veroorzaakt door conventionele afbraak van de liposomen, ofwel door actieve stimuli en omgevingsfactoren, waaronder thermische energie, pH-gradiënt en schuifspanning.1
Formuleringen die zijn afgestemd op afgifte in intracellulaire omgevingen kunnen pH-gevoelige lipiden bevatten die de liposomale structuur veranderen of afbreken in zure compartimenten, waardoor het ingekapselde geneesmiddel kan vrijkomen. Als alternatief worden soms thermogevoelige of fotogevoelige componenten opgenomen om afbraak en structuurmodulatie mogelijk te maken als gevolg van veranderingen in temperatuur of reactie op licht van bepaalde golflengten.
Liposoomachtige dragers van geneesmiddelen kunnen er in vele verschillende variëteiten zijn, die een breed scala van biochemische en biofysische eigenschappen vertonen. Hoewel dit voordelig is en deze op lipiden gebaseerde deeltjes in staat stelt nuttige toepassingen te vinden in honderden verschillende omgevingen, maakt het aantal potentiële variaties een strenge fabricagecontrole noodzakelijk.2
Exelead produceert al sinds het begin van de jaren negentig geneesmiddelen op basis van lipiden, te beginnen met Abelcet. Amfotericine B, het actieve ingrediënt in Abelcet, wordt vastgehouden in een lipidencomplex en versmelt selectief met schimmelmembranen om de ziektecellen aan te pakken.
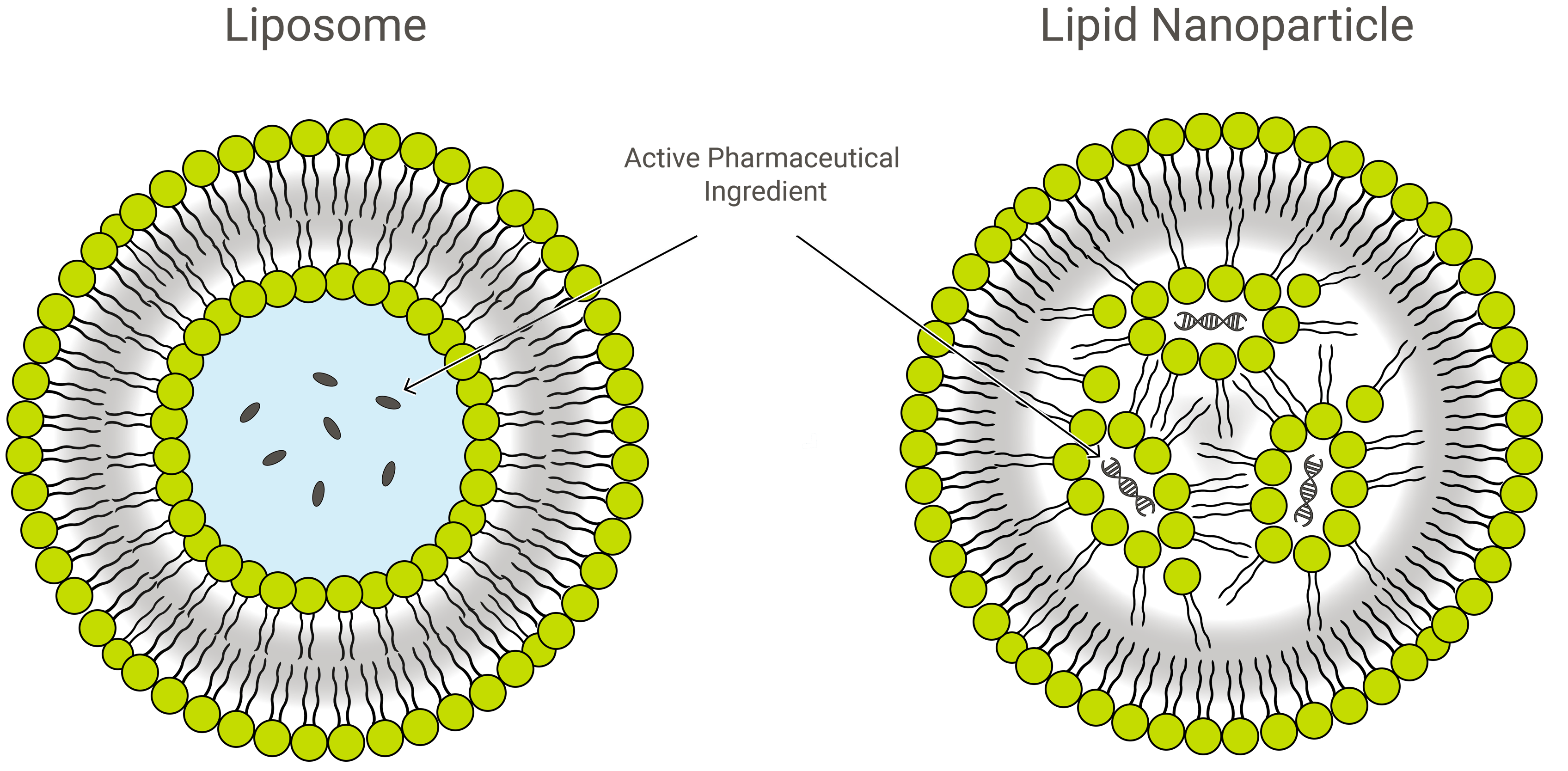
Liposomen vs. lipidenanodeeltjes
Liposomen en lipidenanodeeltjes (LNPs) lijken qua ontwerp op elkaar, maar verschillen enigszins qua samenstelling en functie. Beide zijn lipide nanovormingen en uitstekende voertuigen voor de levering van geneesmiddelen, die lading van belang binnen een beschermende, buitenste laag van lipiden vervoeren. In toepassing, echter, kunnen LNPs een verscheidenheid van vormen aannemen.
LNPs zijn liposoomachtige structuren, speciaal gericht op het inkapselen van een grote verscheidenheid aan nucleïnezuren (RNA en DNA); en als zodanig zijn zij het meest populaire niet-virale gentoedieningssysteem. Exelead ontwikkelt en produceert LNPs om verschillende soorten genetische payloads in te kapselen, waaronder siRNA, mRNA en saRNA.
Traditionele liposomen omvatten een of meer ringen van lipide bilayer rond een waterige zak, maar niet alle LNPs hebben een aaneengesloten bilayer die hen zou kwalificeren als lipide vesicles of liposomen. Sommige LNP’s hebben een micelle-achtige structuur, waarbij ze geneesmiddelmoleculen inkapselen in een niet-waterige kern.
PEGylering van LNP’s en liposoomachtige geneesmiddelafgiftestructuren
LNP’s zijn hoofdzakelijk samengesteld uit kationische lipiden (zie gentherapie hieronder) samen met andere lipidebestanddelen. Deze omvatten meestal neutrale fosfolipidemoleculen die behoren tot de klasse fosfatidylcholine (PC) en sterolen, zoals cholesterol. Een ander veel voorkomend lipide-ingrediënt is een zogenaamde gepegyleerde fosfolipide – een polyethyleenglycol (PEG) polymeer dat covalent is gehecht aan de hoofdgroep van een fosfolipide.

gepegyleerde fosfolipiden worden gebruikt in veel op lipiden gebaseerde geneesmiddelendragers, voornamelijk omdat zij een zogenaamd “stealth” effect hebben op het geneesmiddel wanneer dit in het lichaam circuleert. Het menselijk immuunsysteem is gedreven om het lichaam te beschermen tegen elk vreemd voorwerp, en medicinale nanodeeltjes zijn geen uitzondering. Om te helpen bij de leveringsefficiëntie en om meer circulatietijd toe te staan voor ladingmoleculen om de beoogde ziektesites te bereiken, wordt PEG toegevoegd om deze nanodeeltjes af te schermen door te voorkomen dat bloedplasma-eiwitten in het liposoomoppervlak worden geabsorbeerd, waardoor de circulatielevensduur in de bloedbaan wordt verlengd.1
Het tweede voordeel van PEGylering is een boost in stabiliteit voor liposoom-achtige nanostructuren. Conventionele liposomen, vooral die kleiner dan 200 nm, kunnen op zichzelf onstabiel zijn en hebben de neiging met elkaar te versmelten om de oppervlaktespanning te verminderen. Dit kan leiden tot verlies van het ingekapselde geneesmiddel of tot ongunstige vermenging van de lading van verschillende vesikels. Een van de manieren waarop geneesmiddelenfabrikanten hebben geleerd dit probleem te ondervangen is door de buitenkant van liposomen te bedekken met polymeren zoals PEG.
Deze met stealth uitgeruste nanodeeltjes hebben geresulteerd in een nieuwe generatie liposomale formuleringen en meerdere klinisch goedgekeurde producten. PEG-geylateerde liposomen en LNPs zijn momenteel het nieuwe paradigma voor de meeste kankertherapieën.
LNPs in gentherapie
Een lange tijd was de meest effectieve manier om op genen gebaseerde therapeutica aan menselijke cellen toe te dienen het gebruik van een virus dat was gemodificeerd om medicinale lading te dragen in plaats van schadelijke, zichzelf replicerende genen. Deze methode wordt vandaag de dag nog steeds af en toe gebruikt en wordt virale gentoediening genoemd. Niet-virale gentoediening is echter de laatste 20 jaar populair geworden wegens de verbeterde veiligheidsprofielen, de lagere percentages van ongunstige immunogene reacties en de gemakkelijke fabricage. Een van de belangrijkste aanjagers van deze beweging is de ontwikkeling van dragers op basis van lipiden en polymeren geweest, waarvan LNP’s de meest populaire zijn.
LNPs die worden gebruikt om genen af te leveren worden voornamelijk gesynthetiseerd met behulp van kationische, of positief geladen, lipiden die associëren met anionische, of negatief geladen, nucleïnezuren. Andere op lipiden gebaseerde componenten kunnen ook worden toegevoegd om de leveringsefficiëntie en de plaats van afgifte van de genetische lading te moduleren. LNPs bieden ook mechanische stabiliteit, gecontroleerde morfologie en smalle grootteverdeling.1
Anorganische materialen, organische materialen en hydrogels zijn elk onderzocht als kernen voor liposomale nanodeeltjes, ingekapseld in variërende aantallen lipidelagen die het omhulsel vormen. Een van de meest succesvolle varianten van deze hybride nanodeeltjes bevat PLA- of PGLA-polymeren binnen een lipidenmonolaag. Deze twee biokernpolymeren zijn bijzonder nuttig voor de toediening van geneesmiddelen omdat zij een gecontroleerde geneesmiddelafgifte vergemakkelijken.1

De hierboven afgebeelde nanodeeltjesformulering is een lipide-polymeerhybride met een hydrofobe PGLA-kern en een hydrofiele lipide-PEG-schil.
Een groeiend gebied
“Liposomen hebben een lange weg afgelegd om een klasse van gevalideerde medicijndragers te worden … Een toenemende variëteit van liposoom-achtige nanostructuren is in ontwikkeling, elk met unieke sterktes geschikt voor specifieke medicijnafgiftetaken. Ondertussen vordert het begrip van de interacties tussen deze nanostructuren en biologische systemen snel. Er is een aanzienlijke hoeveelheid informatie verkregen over hun circulatietijd, weefselaccumulatie en potentiële toxiciteit. Het is zeker dat liposoom-achtige nanodragers in de nabije toekomst een grotere rol zullen spelen voor medicijnafgifte.”
– Liposoom-achtige nanostructuren voor medicijnafgifte | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Terwijl er veel werk wordt verricht in de ontwikkeling van gecontroleerd vrijkomende, nano-gecompartimenteerde medicinale middelen, zijn liposomen en LNPs bijzonder veelbelovende opties. Deze structuren bieden een unieke, natuurlijk stabiele, celachtige morfologie voor nanomedicijnen, en zijn klaar om door te groeien naar meer geavanceerde therapeutische strategieën. Exelead gaat dergelijke uitdagingen aan, waaronder de ontwikkeling van nanogroepen die een reeks biologische geneesmiddelen en kleine moleculen bevatten.
Sinds liposomen eind jaren zestig voor het eerst als geneesmiddelafgiftesysteem werden voorgesteld, zijn er variaties in structuur en functionaliteit ontstaan, die waardevolle vooruitgang bieden in termen van ziektedoelstelling. LNP-geneesmiddelen zijn in de farmaceutische industrie opgedoken als therapieën voor de toediening van antikankermiddelen, antibiotica, gen-geneesmiddelen, anesthetica en ontstekingsremmers.3
“In klinische toepassingen zijn liposomale geneesmiddelen het nuttigst gebleken vanwege hun vermogen om zich “passief” te accumuleren op plaatsen met een verhoogde permeabiliteit van de vasculatuur, wanneer hun gemiddelde diameter in het ultrafilterbare bereik ligt (<200 nm in diameter), en vanwege hun vermogen om de bijwerkingen van de ingekapselde geneesmiddelen te verminderen ten opzichte van vrije geneesmiddelen. Dit heeft geleid tot een algehele toename van de therapeutische index, die werkzaamheid meet boven toxiciteit.”
– Liposomale geneesmiddelafgiftesystemen: van concept tot klinische toepassingen | Allen TM, Cullis PR 3
Toepassingen in gepersonaliseerde geneeskunde-een nieuw tijdperk in therapeutische strategieën
In tegenstelling tot traditionele, big-pharma benaderingen van de behandeling van ziekten, houdt gepersonaliseerde geneeskunde rekening met individuele verschillen in levensstijl, milieu, en biologie – met inbegrip van de genetica van een patiënt.
Dit is uiterst toepasbaar voor ziekten zoals kanker. Zelfs binnen één soort kanker verschillen tumortypes van patiënt tot patiënt, en als artsen de specifieke genetische mutatie begrijpen die een patiënt heeft ontwikkeld, kunnen ze specifiekere en preciezere behandelingen toepassen.4
Met de komst van gepersonaliseerde genetische therapieën kunnen artsen en wetenschappers een actief farmaceutisch ingrediënt – vaak RNA of DNA – effectief op maat maken voor het specifieke ziekteprofiel van een bepaalde patiënt of een kleine groep patiënten. Deze benadering van hyperspecifieke ziektetargeting verhoogt de werkzaamheid en vermindert ongewenste bijwerkingen voor groepen vergelijkbare patiënten.
LNPs als leveringsvehikels voor oligonucleotiden
Omdat zo veel van het groeiende gebied van gepersonaliseerde geneeskunde is gericht op genetische therapieën, zijn LNPs bijzonder nuttig geworden als een platform voor de levering van geneesmiddelen. Elk oligonucleotide zou theoretisch kunnen worden ingekapseld in een liposoom of LNP, maar siRNA zijn momenteel de meest voorkomende lading in dit soort geneesmiddelen.
In theorie kunnen segmenten van siRNA worden ontworpen om elk gen het zwijgen op te leggen, wat een opwindend concept is voor zowel artsen als onderzoekers. Helaas is de levering van vrij, niet-ingekapseld RNA in menselijke cellen moeilijk, omdat ze groot zijn, instabiel in serum en gevoelig voor nuclease degradatie.5
Weliswaar hebben onderzoekers pogingen ondernomen om siRNA in serum te stabiliseren door fosforothioaatkoppelingen toe te voegen, maar er zijn hoge doses nodig om genen bij mensen effectief het zwijgen op te leggen. LNPs hebben een oplossing voor dit probleem geboden door flexibele en gemakkelijke manieren van inkapseling te bieden, waarbij de siRNA-segmenten worden beschermd totdat zij hun beoogde bestemming bereiken en hun levering aan doelcellen wordt vergemakkelijkt.5
“LNPs die ioniseerbare kationische lipiden bevatten, hebben een aantal kenmerken die nodig zijn voor de systemische levering van polynucleïnezuren, waaronder kleine afmetingen, serumstabiliteit, lage oppervlakte zeta-potentialen bij fysiologische pH, en kationische lading bij zure pH-waarden (bv. in endosomen). Voorts kan, door gebruik te maken van “endogene” targetingprocessen als gevolg van associatie met ApoE na toediening, een zeer efficiënte opname in hepatocyten worden bereikt na i.v.-toediening, hetgeen leidt tot uitstekende gene silencing-mogelijkheden.”
– Lipide nanodeeltjes afgiftesystemen voor siRNA-gebaseerde therapeutica | Wan C, Allen TM, Cullis PR 5
Kleinere batchgroottes
Gepersonaliseerde geneesmiddelen worden vaak geproduceerd in kleine batchgroottes voor afzonderlijke patiënten of kleine populaties en kunnen vaak resulteren in minder dan een liter product. Traditionele productiepartijen voor gangbare geneesmiddelen produceren daarentegen vaak duizenden liters geneesmiddel op schaal. Gepersonaliseerde geneeskunde vereist een unieke aanpak, en elke batch moet worden vervaardigd onder strikte cGMP-omstandigheden.
Nadat gepersonaliseerde geneeskunde een prominente focus is geworden in de geneesmiddelenontwikkeling, hebben veel bedrijven in de farmaceutische productie-industrie hun pijplijnen aangepast om kleinere batches te kunnen verwerken die zijn bestemd voor kleine groepen patiënten, naast de traditionele, grootschalige productie van geneesmiddelen.
Bij Exelead zijn uitgebreide inspanningen verricht om deze small-batch therapeutica te kunnen verwerken, die vaak dure API en een snelle doorlooptijd vereisen. Patiënt- of antigeenspecifieke geneesmiddelen laten niet veel tijd over vanaf het moment dat de sequentie van de oligonucleotide is bepaald tot het moment dat het product bij ons geformuleerd moet worden. Deze korte-termijnvoorspellingen, soms slechts zes weken, vormen uitdagingen die we hebben kunnen overwinnen door onze bestaande systemen te verfijnen en innovatieve formuleringstechnieken op te nemen.
Wijdverbreide toepassingen
Terwijl gepersonaliseerde geneeskunde het potentieel heeft om bijna elke ziekte te behandelen, heeft het huidige onderzoek zich voornamelijk gericht op 1) immunotherapieën, 2) conventionele therapieën die worden aangevuld via farmacogenomica en 3) biomarker-gerelateerde kankerbehandelingen. Liposomen en LNPs hebben toepassing als leveringsvoertuigen voor elk van deze categorieën van geneesmiddelen, waardoor ze een onmisbare troef zijn in dit nieuwe gebied van farmaceutische ontwikkeling.

Reference Articles
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materialen voor biologie en geneeskunde. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Emerging Research and Clinical Development Trends of Liposome and Lipid Nanoparticle Drug Delivery Systems. Tijdschrift voor farmaceutische wetenschappen. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Liposomale geneesmiddelafgiftesystemen: From concept to clinical applications. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? US News: Gezondheidszorg. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Lipide nanodeeltjes afgiftesystemen voor siRNA-gebaseerde therapeutica. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Part 1: Evolution and Development into Theranostics. Farmacie en Therapeutica. 2010;35(10):560-576.