US Pharm. 2012;37(5):HS-2-HS-7.
Pijn is de meest voorkomende reden dat mensen medische hulp zoeken.1Een recente studie schat dat pijn tientallen miljoenen Amerikanen treft en de Verenigde Staten jaarlijks $635 miljard kost door een verhoogd gebruik van medische zorg en indirecte kosten door gemiste werkdagen en verlies van productiviteit.2 Beheersing van chronische pijn met medicijnen zoals opioïden is een gebruikelijke strategie, maar chronische pijn kan aanhouden of verergeren ondanks een agressieve opioïdtherapie. Dit artikel heeft als doel licht te werpen op het fenomeen van opioïden die worden voorgeschreven om pijn te behandelen maar die nieuwe of paradoxaal verergerende pijn veroorzaken. Deze conditie wordt opioïd-geïnduceerde hyperalgesie (OIH) genoemd. OIH kan meer formeel gedefinieerd worden als verhoogde nociceptieve sensitisatie veroorzaakt door blootstelling aan opioïden.3OIH verschilt duidelijk van tolerantie, verslaving, afhankelijkheid, en ziekte progressie. De klinische prevalentie van OIH is onbekend.4
Diagnose en presentatie
Een van de belangrijkste problemen bij het stellen van de juiste diagnose van OIH is de sterke gelijkenis van de aandoening met opioïdtolerantie. Tolerantie en OIH delen het kenmerk van een verminderde analgetische respons op de opioïdendosis, en zij delen waarschijnlijk veel van dezelfde cellulaire mechanismen.5Tolerantie kan worden overwonnen door de opioïdendosis te verhogen, terwijl dezelfde verhoging bij een patiënt met OIH resulteert in verergering van de pijn.4 Bovendien ontwikkelt tolerantie zich meestal langzaam in de loop van de tijd, terwijl de toename van pijn als gevolg van opioïdenbehandeling bij de OIH-patiënt relatief snel optreedt. Vaak verschilt OIH van tolerantie in die zin dat de pijnintensiteit sterker is dan aanvankelijk gemeld.6
Onbehandelde pijn is een andere mogelijkheid die moet worden uitgesloten. Als de therapie suboptimaal is, zou verhoging van de dosis moeten leiden tot pijnverlichting; als er sprake is van OIH, zou het tegenovergestelde waar moeten zijn. Voor een juiste diagnose van OIH moet de pijn verdwijnen zodra de behandeling met het betreffende opioïd wordt gestaakt.6 Om de zaak nog ingewikkelder te maken is hyperalgesie als gevolg van opioïdontwenning een goed gedocumenteerd fenomeen.7 Als zodanig zal het verdwijnen van de pijn na het staken van de behandeling met opioïden bij OIH niet onmiddellijk optreden en geduld vereisen. Dit stelt zowel de clinicus als de patiënt voor zijn eigen uitdagingen.
OIH heeft de neiging zich te presenteren met andere onderscheidende kenmerken (TABEL 1).Pijn geassocieerd met OIH heeft de neiging meer diffuus en van mindere kwaliteit te zijn, en noxious stimuli hebben de neiging pijnlijker te zijn dan normaal verwacht zou worden. Bij OIH manifesteert de pijn zich vaak in gebieden die verder reiken dan de plaats van verwonding of weefselbeschadiging. Pijn kan bij OIH aanhouden ondanks verwijdering van de oorspronkelijke bron van pijn of genezing van het beschadigde weefsel. Bij OIH kan, naarmate de behandeling met opioïden vordert, de pijn de illusie wekken erger te worden dan oorspronkelijk gemeld ondanks tijd, rust en andere maatregelen die normaal gesproken een klinisch relevante mate van genezing mogelijk zouden maken.5 Bovendien is allodynie aangetoond in een aantal humane en dierlijke studies naar OIH.8

Etiologie
Er zijn een aantal theorieën over de oorzaak van OIH. De theorie die het meest is onderzocht en momenteel de meeste aandacht krijgt, is het neuro-excitatoire model. Aangenomen wordt dat bepaaldeopioïden en hun metabolieten de N-methyl-D-aspartaat (NMDA) receptor agoniseren. Activering van de NMDA-receptor veroorzaakt een instroom van calcium waardoor de prikkelbaarheid van het neuron sterk toeneemt. Wanneer de NMDA-receptor en de corresponderende neuronen actiever zijn, kunnen zij gemakkelijker pijnprikkels doorgeven die worden geïnitieerd door circulerende stoffen of andere schadelijke prikkels. Glutamaat is de primaire endogene agonist van de NDMA receptor.9
Ondersteunend deze theorie van pronociceptie gemoduleerd door NMDA receptoractivatie zijn studies die verlichting van OIH aantonen na toediening vanNMDA receptor antagonisten. Deze antagonisten binden op niet-competitieve wijze aan de fencyclidine plaats op het NMDA kanaal en blokkeren de instroom van calcium die zou optreden wanneer de receptor glutamaat of een andereagonist bindt.10 Dierlijke en menselijke studies hebben aangetoond dat proefpersonen met OIH die ketamine kregen toegediend, een NMDA receptorantagonist, beter scoorden tijdens gecontroleerde pijn-stimulus testen. In één studie kregen ratten intrathecaal morfine-injecties gedurende een aantal dagen totdat zij OIH vertoonden die gevoelig was voor warmte. Toediening van dizocilpine, een NMDA remmer, was effectief in het tenminste gedeeltelijk terugdraaien van thermische hyperalgesie.5 Andere NMDA-receptorantagonisten, zoals dextromethorfan, hebben enig bewijs geleverd van het verlichten van hyperalgetische toestanden door remming van de NMDA-receptor.
Opioïden, zoals codeïne, hydromorfon en morfine, ondergaan een aantal biotransformaties als onderdeel van het normale stofwisselingsproces.Codeïne wordt gemetaboliseerd tot morfine door het CYP2D6-enzym. Morfine wordt gemetaboliseerd tot een aantal moleculen, maar het wordt voornamelijk gemetaboliseerd door glucuronidatie in morfine-3-glucuronide (M3G) en, in mindere mate, morfine-6-glucuronide (M6G) (FIGUUR 1).11
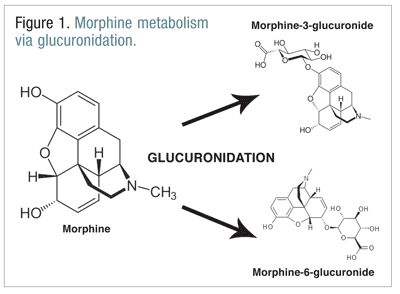
M6G is een therapeutisch belangrijke metaboliet. Het heeft een mu-receptbindingsaffiniteit die vergelijkbaar is met die van morfine en kan analgesie, ademhalingsdepressie en andere effecten veroorzaken die vergelijkbaar zijn met die van morfine. M3G is echter geen agonist voor de mu-receptor en heeft een geringe affiniteit voor de mu-receptor in vergelijking met morfine. In tegenstelling tot morfine, M6G en andere opioïden is M3G een NMDA-agonist. Door glucuronidatie wordt M3G omgezet met een snelheid die ongeveer zes maal zo hoog is als die van M6G.12 Van andere opioïden is bekend dat zij NMDA agonisten zijn en paradoxale neuroexcitatoire effecten hebben.6
Die de theorie ondersteunen dat OIH wordt veroorzaakt door activiteit van receptoren naast de mu opioïd receptor is het bewijs dat OIH niet wordt verlicht door toediening van een opioïd antagonist (b.v. naloxon). Bij patiënten die OIH ervaren terwijl ze een hoge dosis opioïden gebruiken, veroorzaakte toediening van naloxon een verergering van de pijn.13 Door de opioïden van de mu receptor te verdringen, voorkwam naloxon dat de opioïden de analgesie leverden die mogelijk was door mu receptor activatie, terwijl tegelijkertijd de hyperalgesie nu onaangetast bleef.14
Dynorfine kan ook betrokken zijn bij de ontwikkeling van OIH.15Dynorfine is een endogeen opioïd peptide dat zich voornamelijk bindt aan de kappa opioïd receptor en, in mindere mate, aan de mu opioïd en NMDAreceptoren. Aangenomen wordt dat dynorfine’s agonisme van de kappa opioidreceptor en de NMDAreceptor een rol speelt in de pronociceptie van OIH, ondanks de aanwezigheid van zuivere mu receptor agonisten. Studies hebben aangetoond dat het omkeren van dynorfine de analgetische effecten van morfine kan herstellen wanneer aan de proefpersonen een dynorfine-antiserum wordt toegediend. Bovendien is bekend dat dynorfine toeneemt bij langdurige toediening van opioïden. Dynorfine veroorzaakt ook het vrijkomen van excitatoire neuropeptiden op verschillende plaatsen in het centrale zenuwstelsel.
Behandelingsmogelijkheden
Als de diagnose van OIH eenmaal is gesteld, zijn er een aantal behandelingsmogelijkheden waaruit zorgvuldig moet worden gekozen. Ervan uitgaande dat de oorspronkelijke pijnlijke verwonding of weefselschade is verdwenen en de pijn aanhoudt ondanks – en dankzij – de opioïdbehandeling, is de meest rechtlijnige benadering het staken van het opioïd dat de pijn veroorzaakt. Dit dient geleidelijk te gebeuren om nadelige onttrekkingsverschijnselen te minimaliseren. Hierbij moet worden opgemerkt dat hyperalgesie waarschijnlijk al vroeg in het stoppingsproces kan verergeren.16 Dit levert een uitdagende ethische situatie op waarin de clinicus moeite kan hebben de patiënt ervan te overtuigen dat de medicatie die is voorgeschreven om de pijn te behandelen de pijn kan hebben veroorzaakt of verergerd en dat de pijn nog erger kan worden voordat hij uiteindelijk verdwijnt.17
Als de legitieme pijn aanhoudt en enige mate van analgesie met opioïden nodig is, moeten andere strategieën dan het volledig staken van de opioïden worden onderzocht. Patiënten die OIH ervaren, kunnen verlichting krijgen door de opioïdendosis te verlagen.4 Er zijn meldingen van patiënten die een aanvaardbaar evenwicht vinden tussen analgesie en verlichting van hyperalgesie na vermindering van de opioïdendosis.
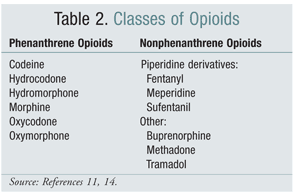
Switching van de ene structurele klasse van opioïden naar een andere is in sommige studies een effectieve optie geweest om OIH te verminderen. Studies tot op heden hebben aangetoond dat OIH sterker geassocieerd is met opioïden uit de fenantreen klasse (TABEL 2).4 Titratie van het fenantreen opioïd en omschakeling naar een ander opioïd kan leiden tot het oplossen van OIH. Codeïne, hydromorfon, morfine en structureel vergelijkbare opioïden ondergaan glucuronidatie als onderdeel van hun metabolisme. Vermijding van een NMDA receptor-activerende glucuronide metaboliet is mogelijk door over te schakelen op een opioïd dat structureel uniek is, zoals fentanyl. Op dit moment is OIH niet aangetoond in proeven met oxymorphone.4
Aanvulling van de opioïdtherapie met een cyclo-oxygenase 2 (COX-2)-remmer is een andere strategie die enige steun geniet. Door de prostaglandinesynthese te verminderen, kunnen COX-2 remmers de sensitisatie van pronociceptieve neuronen verminderen. Niet-steroïde anti-inflammatoire geneesmiddelen (NSAID’s) en COX-2 remmers blijken analgetische effecten te hebben onafhankelijk van hun vermogen om de prostaglandinesynthese perifeer te onderdrukken.9 COX-2 remmers hebben ook aangetoond dat ze de NMDA-receptor kunnen antagoneren. Centraal zijn NSAID’s in staat de NMDA-receptor te antagoneren door glutamaat, substance P en andere excitatoire aminozuren te blokkeren. Onafhankelijk hiervan kan NMDA receptoractivatie de expressie van COX-2 doen toenemen.18
Gezien de aandacht die de NMDA receptor heeft gekregen voor zijn rol in OIH, lijkt het antagoneren van deze receptor een redelijke behandelingsstrategie te zijn. Ketamine is veel onderzocht, maar de bijwerkingen kunnen ernstig zijn. Hoewel het NMDA antagoniseert en een verdovend effect geeft dat analgesie zou bevorderen, zijn bijwerkingen veel voorkomend, divers en ernstig.19 Deze effecten omvatten tachyaritmie, hypertensie, cognitieve stoornissen, en psychomimetische reacties, waaronder stemmingswisselingen, levendige dromen, delirium, hallucinaties, en sedatie. Ketamine is effectief in het omkeren van hyperalgesie en het vergroten van de effecten van opioïden bij patiënten die grote doses krijgen, maar de bijwerkingen ervan verhinderen dat het een levensvatbare behandelingsoptie is.
Dextromethorfan is een andere NMDA-receptorantagonist die is onderzocht voor de behandeling van OIH. Een combinatieproduct dat een 1:1 mengsel van morfine en dextromethorfan bevat is onderzocht.20 Studies hebben niet kunnen aantonen dat combinatietherapie een betere analgesie kan bereiken dan morfine alleen. Vergelijkbare therapiefalen traden op in een studie waarin een 2:1 mengsel van dezelfde middelen werd gebruikt.De studies zijn bekritiseerd omdat de hoeveelheid dextromethorfan onvoldoende zou zijn om de NMDA-receptor adequaat te antagoneren.21Wat onbekend blijft is de dosis dextromethorfan die nodig is om ofwel de analgesie van een opioïd te vergroten of de OIH veroorzaakt door NMDAreceptor activatie te voorkomen.
Methadon is een opioïd met unieke kwaliteiten die het een overtuigende optie maken voor de behandeling van pijn bij de patiënt met OIH. Naast de analgetische effecten door binding aan de mu opioïde receptor, is methadon een zwakke NMDA receptor antagonist.4 Er is gerapporteerd dat de toevoeging van zelfs een lage dosis methadon effectief is geweest voor het verminderen van hyperalgesie. In één geval verbeterde de toevoeging van een lage dosis methadon (10 mg tweemaal daags) de pijnstilling aanzienlijk, met een vermindering van de totale dosis opioïden met 40 tot 50 %.22 Overschakelen van het overtredende opioïdum op methadon is een populaire behandelingsstrategie geweest. Tramadol en meperidine hebben ook enige NMDA-receptorantagonistische activiteit.
Een andere behandelingsmodaliteit die enig potentieel heeft voor de behandeling van OIH is buprenorfine.23,24 Buprenorfine is een partiële opioïde agonist op de mu-receptor en heeft ook kappa-receptor antagonistische activiteit.4Dynorfine, een kappa-receptor agonist, staat erom bekend dat het toeneemt tijdens de behandeling met opioïden. Activering van de kappa receptor antagoniseert grotendeels de mu receptor-gemedieerde effecten van opioïden.25 Het klinisch nut van buprenorfine bij de behandeling van OIH moet nog volledig worden verklaard.
Conclusie: Looking Forward
Er moet nog veel werk verzet worden voordat verklaard kan worden dat OIH begrepen is. Het exacte cellulaire mechanisme en de signaalwegen die verantwoordelijk zijn voor dit verschijnsel zijn niet gedefinieerd. Om dit nog ingewikkelder te maken, zijn er tegenstrijdige rapporten over de vraag of specifieke componenten een sleutelrol spelen, of welke rol dan ook. Het grootste deel van het onderzoek naar het ophelderen van de pathofysiologie van OIH heeft betrekking gehad op het diermodel. Dit heeft enige waarde, maar informatie van het menselijke model is schaars.
Een zwak begrip van de oorzaak van een aandoening genereert een onzeker arsenaal van behandelingsmogelijkheden. De beste beschikbare strategie is het volledig staken van het problematische opioïd, maar dit is van weinig nut voor de patiënt die opioïd-achtige pijnstilling nodig heeft.Verscheidene andere behandelingsmodaliteiten zijn onderzocht, maar zij zouden alle baat hebben bij verder onderzoek. De meeste studies bij mensen hebben betrekking op perisoperatieve patiënten, herstellende drugsverslaafden en experimentele pijnmodellen. Deze studies zijn niet zonder waarde, maar deze populaties zijn geen afspiegeling van de chronische pijn populatie. Andere beperkingen van de beschikbare behandelingsmogelijkheden zijn onder andere de magere resultaten, buitensporige toxiciteit ondanks matig succes, en kleine studies die zwakke conclusies opleveren.
Op dit moment zijn een aantal klinische studies met de NMDA receptor antagonist memantine voor de behandeling van OIH gaande of gepland.26 Nog steeds zijn er tegenstrijdige berichten over de precieze rol van NMDA-receptoren in OIH. Verder onderzoek moet worden gedaan om de belangrijkste verantwoordelijke receptoren en mechanismen bij OIH vast te stellen. Uitbreiding van de steekproefomvang van studies zal helpen bij het ondersteunen van reeds getrokken conclusies over welke behandelingsmiddelen verantwoordelijk zijn voor OIH en effectief zijn voor de behandeling ervan. Het uitvoeren van studies die zich richten op chronische pijn, in plaats van modellen van acute pijn, kan klinisch relevante informatie opleveren voor de behandelaar.
Chapman en collega’s hebben specifieke vragen opgeworpen die beantwoord moeten worden voordat de diagnose OIH gesteld kan worden en een effectieve behandeling kan worden gegeven.27 Wat is de relatie van opioïdendosis en -duur tot OIH? Bij welk type pijn, of bij welk type patiënt, is er meer kans op het ontstaan van OIH? Dit zijn de vragen die richting moeten geven aan toekomstig klinisch onderzoek.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalence and characteristics of opioid use in the US adult population. Pain. 2008;138:507-513.
2. Institute of Medicine. Relieving Pain in America: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. Pain Physician. 2011;14:145-161.
5. Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Pain. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Opioïd-geïnduceerde hyperalgesie: is het klinisch relevant voor de behandeling van pijnpatiënten? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hyperalgesia during opioid abstinence: mediation by glutamate and substance P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioids and abnormal painperception: new evidence from a study of chronic opioid addicts andhealthy subjects. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Hyperalgesia mediated by spinal glutamateor substance P receptor blocked by spinal cyclooxygenase inhibition. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Targeting theN-methyl-D-aspartate receptor for chronic pain management. Preklinisch-dieronderzoek, recente klinische ervaring en toekomstige onderzoeksrichtingen. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Opioid metabolites. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morphine metabolites: clinical implications. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morphine hyperalgesia in mice isunrelated to opioid activity, analgesia, or tolerance: evidence formultiple diverse hyperalgesic systems. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Opioïd-geïnduceerde hyperalgesie: een kwalitatieve systematische review. Anesthesiologie. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin promotes abnormal pain and spinal opioid antinociceptive tolerance. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Associationsbetween heat pain perception and opioid dose among patients with chronicpain undergoing opioid tapering. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioid induced hyperalgesia: clinical implications for the pain practitioner. Pain Physician. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Activation of NMDA receptor is Associated with up-regulation of COX-2 expression in the spinal dorsalhorn during nociceptive inputs in rats. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamine: een introductie voor de pijn- en palliatieve geneeskunde arts. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (morphinesulfate/dextromethorphan hydrobromide combination) in the treatment ofchronic pain: three multicenter, randomized, double-blind, controlledclinical trials fail to demonstrate enhanced opioid analgesia orreduction in tolerance. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Combined opioid-NMDA antagonist therapies.What advantages do they offer for the control of pain syndromes? Drugs. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Improved opioid analgesic effect following opioid dose reduction. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Significant pain reduction in chronic pain patients after detoxification from high-dose opioids. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Different profiles of buprenorphine-induced analgesia and antihyperalgesia in a human pain model. Pain. 2005;118:15-22.
25. Pan ZZ. Mu-opposing acties van de kappa-opioid receptor. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Opioid therapy for chronic pain. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid pharmacotherapy for chronic non-cancer pain in the United States: a research guidelinefor developing an evidence-base. J Pain. 2010;11:807-829.