Inleiding
Immunofluorescentie (IF) maakt gebruik van antilichamen en fluorescerende detectie om de lokalisatie, relatieve expressie en activeringstoestand van doeleiwitten in gefixeerde cellen of weefsels te bestuderen. IF wordt veel gebruikt in verschillende studiegebieden.
IF kan gebruikt worden om vragen te beantwoorden zoals:
- Welke cellen of weefsels brengen mijn doeleiwit(en) tot expressie?
- Hoe verandert de expressie en/of activatie van mijn doeleiwit in reactie op experimentele verstoringen?
- Waar in de cel/het weefsel is het doeleiwit gelokaliseerd?
- Wat is de ruimtelijke relatie tussen verschillende doeleiwitten in de context van de cellulaire of weefselarchitectuur?
Immunofluorescentie omvat een aantal verwante technieken die zich in de loop der tijd hebben ontwikkeld. Al deze technieken maken gebruik van de specifieke herkenning van biologische targets door antilichamen en detectie van fluorescerende reporters in cytometrische analyse. Ervoor zorgen dat het biologische monster goed bewaard blijft terwijl doelantigenen toegankelijk zijn voor antilichamen is belangrijk, maar kan uitdagingen opleveren die variëren afhankelijk van het monster, het doelwit en het antilichaam.
Op deze pagina hebben we middelen samengesteld om u te helpen door protocollen te navigeren, veelgestelde vragen te beantwoorden en u te helpen succesvolle IF-experimenten te ontwerpen.
De juiste IF-techniek en het juiste protocol kiezen
De optimale IF-techniek/-protocol wordt beïnvloed door het type biologisch materiaal, de verwerkingsstappen van het monster, de eigenschappen van het doelantigeen en het specifieke antilichaam dat wordt gebruikt.
Considerations include:
- Inputmateriaal kan zijn gekweekte cellijnen, bevroren weefsel, of formaline-vast, paraffine-embedded (FFPE) weefsel.
- Voor gekweekte cellijnen en primaire cellen, kijk voor antilichamen gevalideerd voor immunofluorescentie-immunocytochemie (IF-IC).
- In veel laboratoria wordt “immunohistochemie/IHC” gebruikt als een containerbegrip voor weefsel dat ofwel in paraffine is ingebed ofwel is ingevroren, en kan het zowel chromogene als fluorescerende detectie omvatten. Op cellsignal.com wordt bij de toepassingen onderscheid gemaakt tussen ingevroren (IF-F) en in paraffine ingebedde weefselpreparaten.
- Voor FFPE-weefselmonsters kunnen antilichamen die zijn gevalideerd voor immunohistochemie (IHC-P) ook worden gebruikt met fluorescentiedetectie zonder versterking als het doelantigeen overvloedig aanwezig is, of in multiplexed IHC (mIHC) met signaalversterking.
- Een antilichaam kan zijn gevalideerd voor een of meer van de hierboven genoemde toepassingen. Aanbevelingen voor protocollen zijn het resultaat van tests door wetenschappers tijdens het validatieproces.
- Productspecifieke protocollen zijn te vinden op elke product webpagina. Voor IF-gevalideerde antilichamen selecteert u “IF” op de productpagina om IF-validatiegegevens en het protocol te bekijken. Basisinformatie (verdunningen/werkconcentratie, gevalideerde toepassingen, soortreactiviteit, gastheersoort) voor elk antilichaam is opgenomen in het productgegevensblad.
- De meest gebruikte IF-protocollen zijn ook te vinden op de protocolpagina.
- Heeft of wilt u geen fluorescentiedetectie gebruiken voor uw weefselmonsters? Een alternatieve benadering is chromogene detectie, behandeld op de IHC pagina.
Het kiezen van antilichamen voor IF: het belang van antilichaam validatie
De beste antilichamen leveren een sterk, specifiek signaal met minimale achtergrond. Het is belangrijk om antilichamen te kiezen die gevalideerd zijn in de toepassing die u gaat gebruiken. Antilichaam validatie in IF kan positieve en negatieve expressie experimenten (met behulp van knock-out cellijnen, genetische modellen, CRISPR of RNAi), experimentele manipulatie van doeleiwit lokalisatie of post-translationele modificaties, en protocol optimalisatie.
De prestaties van een antilichaam varieert per toepassing. Een antilichaam dat bijvoorbeeld goed presteert in een western blot experiment, kan al dan niet goed presteren in IF. Tijdens het testen van nieuwe antilichamen zullen sommige een geringe off-target binding vertonen; deze worden nooit aanbevolen voor IF of andere niet-WB toepassingen. Bovendien kan een antilichaam goed werken op bevroren weefsel, maar niet op FFPE-weefsel, of vice versa. Gevoeligheid en prestaties van antilichamen kunnen veranderen afhankelijk van hoe het monster is gefixeerd en verwerkt en van de werkomstandigheden van de antilichamen.
Als u eenmaal hebt besloten welk type biologische monsters u in uw experiment wilt gebruiken en hoe ze zullen worden geprepareerd, is de eenvoudigste manier om antilichamen op cellsignal.com te doorzoeken, eerst de juiste toepassing te selecteren. Vervolgens kunt u zoektermen invoeren of andere attributen selecteren (zoals gastheersoort, onderzoeksgebied en meer) om uw zoekopdracht verder te verfijnen en een antilichaam te selecteren dat is gevalideerd in de toepassing die u nodig hebt.
Ontwerpen van controle-experimenten voor IF
Om vertrouwen te hebben in uw experimentele ontwerp en resultaten, en dat uw antilichaam getrouw zijn doel rapporteert, kunnen positieve en negatieve controle-experimenten informatief zijn. Bijvoorbeeld:
- Secundaire-only controles kunnen u vertellen of er sprake is van niet-specifieke binding van secundaire antilichaam.
- Bevestig de specificiteit van een primair antilichaam door het ontwerpen van Knockout / SiRNA experimenten of door het vergelijken van bekende expressie en nonexpressing cell lines.
- Single target experimenten worden gebruikt bij het opzetten van spectrale unmixing beeldvorming. Dit type experiment kan helpen om te bepalen of een gebrek aan kleuring is te wijten aan sterische hinder die optreedt wanneer 2 antigenen in de nabijheid van elkaar.
- Behandel monsters met fosfatase om te bevestigen fosfospecifieke antilichamen herkennen alleen de gefosforyleerde doelwit in IF.
- Als u problemen vermoedt met fixatie of permeabilisatie, kan controle met een antilichaam dat in het verleden voor uw lab heeft gewerkt, nuttig zijn bij het oplossen van problemen.
Cell Signaling Technology (CST) wetenschappers voeren routinematig dit soort controles uit als onderdeel van ons validatieproces (zie een voorbeeld). Het kan de moeite waard zijn om soortgelijke controles in uw experimentele modelsysteem op te zetten, vooral als u moeite hebt om de gewenste resultaten te krijgen.
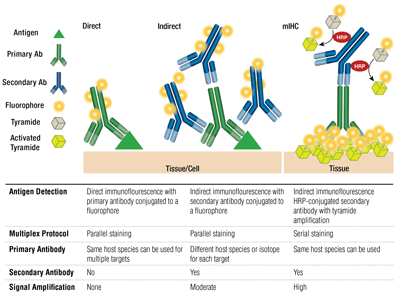
Primaire versus secundaire antilichamen en directe versus indirecte kleuring
Primaire antilichamen zorgen voor specifieke herkenning van het doelantigeen. Secundaire antilichamen binden zich aan primaire antilichamen op basis van de soort waarin ze zijn opgegroeid. Primaire antilichamen die zijn opgewekt in konijn of muis kunnen worden gedetecteerd met respectievelijk anti-rabbit of anti-muis secundaire antilichamen.
Het koppelen van een primair antilichaam en secundair antilichaam (specifiek voor de gastheersoort van het primaire antilichaam) dat is geconjugeerd met een fluorofoor staat bekend als indirecte kleuring. Het gebruik van primaire antilichamen die aan fluoroforen zijn geconjugeerd, zonder secundaire antilichamen, staat bekend als directe kleuring. Directe kleuring bespaart tijd en maakt multiplexing mogelijk met gebruikmaking van antilichamen die in dezelfde gastheersoort zijn geproduceerd. Indirecte kleuring biedt traditioneel een hogere gevoeligheid dankzij signaalversterking die optreedt wanneer meerdere secundaire antilichamen binden aan één enkel primair antilichaam.
Er zijn andere variaties op deze technieken beschikbaar, zoals het gebruik van gebiotinyleerde primaire antilichamen met avidine/streptavidine-geconjugeerd fluorochroom. Fluorofoor-geconjugeerde F(ab’)2 secundaire antilichaamfragmenten (zonder het Fc-domein) kunnen de achtergrond helpen verminderen. Bij mIHC worden mierikswortelperoxidase (HRP)-geconjugeerde secundaire antilichamen gebruikt om de depositie van tyramide-fluorofoorconjugaten te katalyseren.
Selecting Antibodies Fluorophores
Selecting Antibodies Fluorophores
Hoeveel doelwitten/antilichamen kunnen worden gemultiplexed?
Multiplexing maakt gebruik van de detectie van meer dan 1 doelwit tegelijk door middel van meerdere antilichamen en detectie van verschillende golflengtes (kleuren) voor elk doelwit. Voor indirecte kleuring berust de capaciteit voor multiplexing op het koppelen van fluorofoorgeconjugeerde, soortspecifieke secundaire antilichamen aan elk primair antilichaam. Muisantilichamen van verschillende isotypen kunnen ook worden gemultiplexed met behulp van isotype-specifieke secundaire antilichamen, waardoor detectie van maximaal 5 muisantilichamen tegelijk mogelijk wordt. Voor directe kleuring moet elk primair antilichaam aan een andere fluorofoor worden gekoppeld. Hierdoor kunnen meerdere antilichamen van dezelfde soort/isotype worden gecombineerd en kan ook “muis-op-muis” kleuring, aangezien niet-specifieke binding van anti-muis secundaire aan muis weefsel is geen zorg.
Bij het ontwerpen van multiplex IF experimenten, moet rekening worden gehouden met de spectrale kenmerken van de fluorescentiemicroscoop, met inbegrip van beschikbare excitatie bronnen en filtering sets, om spectrale bleed-through te voorkomen. Moderne epifluorescentie en confocale fluorescentiemicroscopen hebben meestal de mogelijkheid om 3 of meer kanalen onderscheiden.
Combinatie antilichaam kleuring met kleurstoffen of tags
Cellulaire kleurstoffen die worden toegepast post-fixatie of fixeerbare live-cell labels kunnen worden opgenomen in een IF workflow. Organel labeling wordt vaak gebruikt om subcellulaire lokalisatie van een doel te verifiëren. Uitgedrukte tags, zoals GFP, worden vaak gebruikt om getransfecteerde cellen of in mozaïek-experimenten te volgen; als het GFP-fluorescentiesignaal laag is, kan een anti-GFP-antilichaam in IF worden gebruikt. Met behulp van kleurstoffen of fluorescerende eiwitten zal bezetten fluorescentie kanalen, waardoor er minder beschikbaar voor antilichamen.
Choosing fluoroforen voor uw experiment
Dit zal afhangen van de spectrale kenmerken van de excitatiebron en excitatie / emissie filtering voor u beschikbaar. Evalueer het excitatie- en emissieprofiel van de fluorofoor voordat u uw experiment uitvoert om doorbloeding van fluorescentie te voorkomen. CST biedt een verscheidenheid van fluorofoor-geconjugeerde primaire en secundaire antilichamen, met inbegrip van kleurstoffen in de Alexa Fluor ® lijn.
Bemonstervoorbereiding
Weefsel
Weefsel secties kunnen worden bereid door ofwel snel invriezen in een optimale snij temperatuur (OCT) medium of door fixeren en insluiten in paraffine. Bevroren monsters kunnen met behulp van een cryostaat worden doorgesneden en op het objectglaasje 10 tot 15 minuten aan de lucht laten drogen alvorens te worden gefixeerd voor de volgende stap. Voor FFPE-weefselmonsters kunnen de vereisten voor het oogsten, fixeren en paraffine-embeddingstappen variëren per weefseltype.
Gevroren vs FFPE-weefsel
In het algemeen geeft FFPE-weefsel een betere morfologie dan OCT-embedded bevroren weefsel. Dit kan het gemakkelijker maken om positieve cellen te kwantificeren of grenzen tussen vlekken te identificeren. FFPE-weefsel is ook zeer stabiel; eenmaal ingebed kunnen blokken weefsel jarenlang worden bewaard. Dit type weefsel is ook gemakkelijker te verzenden tussen laboratoria, en het is de voorkeursmethode voor de verwerking van menselijke pathologiemonsters.
Anderzijds ondergaat FFPE-weefsel verschillende extra verwerkingsstappen die de totale hoeveelheid antigeen verminderen als gevolg van eiwitafbraak, die ontmaskeringsstappen vereisen om het resterende antigeen te detecteren, en die aldehyde-geïnduceerde autofluorescentie verergeren. Tenzij met een zeer overvloedig eiwit wordt gewerkt, kan het resterende antigeen moeilijk met indirecte IF te detecteren zijn en kan amplificatie nodig zijn om een geschikte kleuring te verkrijgen. Het is ook mogelijk dat antigeen retrieval antigenen ontmaskert die normaal niet gedetecteerd zouden worden en dat een antilichaam dat anders het verwachte kleuringpatroon geeft, een niet-specifieke kleuring geeft. Het is evenzeer mogelijk met een doelwit te werken waarvoor een specifieke methode van antigeen retrieval vereist is om het doel-epitoop te detecteren. Daarom is het belangrijk na te gaan hoe een antilichaam wordt gevalideerd en welke stappen nodig zijn om het te gebruiken.
In het geval van OCT-embedded bevroren weefsel, wordt vermindering van de verwerking prioriteit boven morfologie. Dit is de snelste methode om immunokleuringresultaten te verkrijgen, aangezien de objectglaasjes klaar zijn voor gebruik op het ogenblik dat het weefsel wordt gesneden en er minder verwerkingsstappen zijn vóór het inbedden. Er is minder degradatie van proteïnen en er is meer antigeen beschikbaar om antilichamen te binden zonder dat er extra, ruwe retrieval-stappen nodig zijn. Omdat deze methode geen amplificatie vereist, is ze gevoeliger voor de weefselkwaliteit. Het type fixatie (alcohol versus aldehyde), de duur (sommige targets zoals transcriptiefactoren vereisen een kortere fixatietijd) en de leeftijd van het weefsel (vooral na het snijden) zijn allemaal belangrijk en zullen per target verschillen. Tot slot, het werken met bevroren weefsel geeft meer flexibiliteit in de doelgroep selectie, zoals de verwerking kan plaatsvinden na het snijden waardoor meer maatwerk in assay design.
Gekweekte cellen
Cellen moeten worden gezaaid op een steun materiaal dat compatibel is met fluorescentiemicroscopie. Typische dragers zijn glasbodem celkweekschalen, glazen dekglaasjes (bewaard in plastic cultuur schalen) bereid met polylysine en / of extracellulaire matrix componenten aan adherente celkweek te ondersteunen, en in de handel verkrijgbare multiwell kamers gemonteerd op glazen dia’s die compatibel zijn met microscopes.
Merk op dat celkweekomstandigheden cel gezondheid, morfologie, en expressie / lokalisatie van uw doeleiwit kan beïnvloeden en uiteindelijk dicteren de kwaliteit van uw IF-gegevens. Zorg ervoor dat uw cellen gezond zijn door regelmatig controleren van de cultuur media voor pH-veranderingen en inspecteren op tekenen van cel stress (zoals multinucleated cellen) bij lage vergroting op een microscoop. Controleer ook of de confluentie van de cellen is geschikt voor het celtype en target.
Sample fixatie
Het ideale fixatief behoudt een “levensechte” momentopname terwijl het snel stoppen van de degradatieve proces van autolyse door crosslinking en het remmen van endogene enzymen, en het presenteert het antigeen voor herkenning door het antilichaam. Helaas bestaat er niet één fixatiemethode die voor elk monster en voor elk antigeen optimaal werkt. Zelfs verschillende antigenen op hetzelfde doeleiwit kunnen verschillen vertonen tussen de protocollen. Daarom kan het beste protocol niet alleen per monstertype, maar ook per epitoop (en antilichaam) variëren.
Weefsel
Voor vers ingevroren weefsel moeten secties die zijn bevroren en gecryostateerd, nu met fixatief worden behandeld. Als alternatief kunnen weefselmonsters worden geconserveerd door eerst fixatie met transcardiale perfusie of onderdompeling, post-fixatie en cryo-preservatiestappen, gevolgd door invriezen en coupes.
Bij FFPE-weefselverwerking wordt weefsel geconserveerd via onderdompelfixatie met formaline (of een ander fixatief op basis van aldehyde) of met perfusie zoals hierboven, gevolgd door paraffine-inbedding en coupes. Vóór incubatie met antilichaam moeten de coupes worden gedeparaffineerd, gerehydrateerd en antigeen opgehaald om antilichamen toegang te geven tot het monster en doelmoleculen te binden.
Cellen
Spoelen van de cellen met warme eiwitvrije media of PBS onmiddellijk vóór fixatie kan voorkomen dat neerslag van extracellulaire eiwit en puin. Snelle fixatie wordt bereikt door het snel verwisselen van media voor fixatiefoplossing.
Aldehyde fixatie vs alcohol fixatie
Fixatieven op basis van aldehyde, zoals formaldehyde, formaline (een mengsel van opgelost formaldehyde met een lager percentage methanol), en glutaaraldehyde worden het meest gebruikt wanneer het behoud van de structuur van het grootste belang is. Voor de meeste antilichamen beveelt CST fixatie met 4% formaldehyde (methanolvrij) aan. Aldehyden reageren met en crosslinken de primaire amines van cellulaire eiwitten en stabiliseren het monster. Bovendien worden cellulaire enzymen, waaronder fosfatasen en proteasen, gedeactiveerd door de crosslinking. Aldehyden passeren het plasmamembraan en fixeren oplosbare eiwitten beter dan alcoholen, maar sommige targets kunnen hun antigeniciteit verliezen met aldehyde crosslinking.
Dehydraterende/denaturerende alcohol fixatieven, zoals methanol, verdringen water rond cellulaire macromoleculen, wat resulteert in hun denaturatie en precipitatie in situ. Denaturatie van het doeleiwit kan begraven epitopen blootleggen, waardoor deze aanpak voordeliger is dan aldehydefixatie voor sommige antilichamen. Dehydrerende fixeermiddelen zijn echter minder geschikt voor oplosbare doelwitten en voor modificatietoestandspecifieke antilichamen zoals fosfo-antilichamen. Raadpleeg het productinformatieblad voor de optimale fixatiemethode.
Kiezen van een permeabiliserend middel
Als een crosslinking fixatief wordt gebruikt, zal het plasmamembraan nog intact zijn, waardoor intracellulaire doelen ontoegankelijk zijn voor antilichamen. Daarom moet permeabilisatie worden uitgevoerd na fixatie met crosslinking, tenzij uw antilichamen extracellulaire epitopen herkennen. De optimale permeabilisatiemethode varieert afhankelijk van het antilichaam; controleer altijd de productpagina voor het aanbevolen protocol.
Gebruik van Triton® X-100 permeabilisatie na fixatie is gebruikelijk. Triton en andere detergentia, zoals NP-40, TWEEN®, Saponine, Digitonine en DOTMAC, hebben een wisselwerking met celmembranen om variabele “poriegrootte” te creëren en antilichaamtoegang mogelijk te maken.
Als alternatief kan alcoholpermeabilisatie met ethanol of methanol na de fixatiestap worden uitgevoerd. Deze methode combineert de snelle fixatie van crosslinking fixatieven met tussentijdse eiwitdenaturatie en delipidatie van het membraan. Dit kan verbeteren signaal voor bepaalde doelen, met name die in verband met organellen of het cytoskelet.
Welke fix/perm voorwaarden gebruik ik bij multiplexing?
Als u multiplexing met antilichamen die vragen om verschillende CST-protocollen, moet u mogelijk prioriteit geven aan welk antilichaam te gebruiken op zijn optimale voorwaarden. Een voorbeeld van optimalisatie van de volgorde bij mIHC wordt in deze toepassingsnotitie (PDF) gegeven. Het uitvoeren van een kleinschalige testrun waarbij verschillende protocollen worden vergeleken, kan informatief zijn voordat u uw experimenten opschaalt.
Het kiezen van een blokkeringsreagens
De meest gebruikelijke aanbeveling is 5% normaal geitenserum (of serum van dezelfde soort als het secundaire antilichaam) in PBS + 0,3% Triton® X-100. Controleer het gegevensblad voor de aanbevolen blocking agent.
Als er Fc-receptoren in het monster aanwezig zijn, zal het antilichaamsignaal afkomstig zijn van een mix van specifieke doelherkenning (via de antigeenbindingsplaats/variabele regio van het antilichaam) en niet-specifieke absorptie van antilichaamzware ketenbinding aan Fc-receptoren. Het in dierlijk serum aanwezige totale IgG blokkeert de Fc-receptoren om binding van primaire en secundaire antilichamen te voorkomen en achtergrondruis te verminderen. Het kiezen van fluorofoor-geconjugeerde F(ab’)2 fragmenten zal ook Fc receptor binding voor het secundaire antilichaam (maar niet het primaire antilichaam) vermijden
In andere antilichaam-gebaseerde toepassingen, zoals western blotting, verminderen blokkerende stappen het achtergrondsignaal veroorzaakt door niet-specifieke, lagere-affiniteit binding van primaire en secundaire antilichamen aan andere plaatsen dan hun beoogde doel. Wij hebben echter geconstateerd dat recombinante monoklonale antilichamen van konijnen die streng in IF zijn getest, goed presteren op vele monsters met of zonder blokkering. Uiteindelijk, het kiezen van kwaliteit antilichamen gevalideerd in immunofluorescentie gaat een lange weg in het vermijden van achtergrondruis.
Antibody concentratie en signaal-ruisverhouding in IF
De signaal-ruisverhouding (S / N) is gerelateerd aan de specificiteit en gevoeligheid van een antilichaam in een bepaalde toepassing. De signaal/ruisverhouding kan worden berekend door het “signaal” van de fluorescentie-intensiteit in cellen die het doelwit tot expressie brengen, te vergelijken met de “achtergrondruis” van cellen die niet tot expressie komen. Als het antilichaam in een te lage concentratie wordt aangebracht, zal het fluorescentiesignaal te zwak zijn om van de achtergrondruis te kunnen worden onderscheiden. Anderzijds zal een te hoge concentratie bijdragen tot achtergrondkleuring, waardoor de signaal-ruisverhouding afneemt. Raadpleeg altijd het productgegevensblad voor de aanbevolen verdunning, die is gebaseerd op titraties die tijdens de validatie van het antilichaam zijn uitgevoerd.
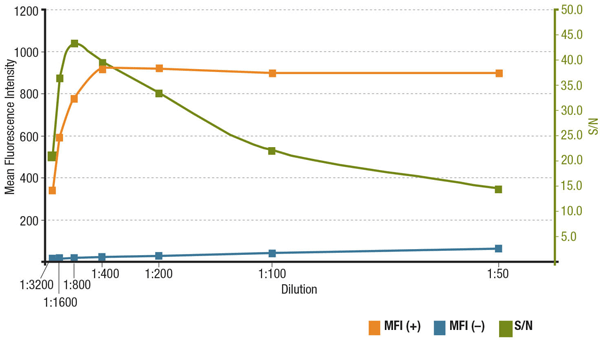
Analyse van S/N voor MUC1 (D9O8K) XP® Rabbit mAb #14161 verdunning. Kwantificering van de gemiddelde fluorescentie-intensiteit in expressieve (MFI(+), oranje) ZR-75-1-cellen en nietexpressieve (MFI(-), blauw) HCT 116-cellen, en berekende signaal-ruisverhouding (groen)
Analyse van de signaal-ruisverhouding voor MUC1 (D9O8K) XP® Rabbit mAb #14161-verdunning. Kwantificering van de gemiddelde fluorescentie-intensiteit in expressieve (MFI(+), oranje) ZR-75-1-cellen en nietexpressieve (MFI(-), blauw) HCT 116-cellen, en berekende S/N (groen).
Antibody-incubatietijd
In het algemeen resulteert een nachtelijke incubatie bij 4°C in een sterk signaal. Verandering van incubatietijd en temperatuur kan het signaal en de signaal-ruisverhouding veranderen. Verschillende antilichamen kunnen verschillend reageren op veranderde incubatieomstandigheden; voor meer, zie deze blog post.
Moet ik toegang hebben tot een confocale microscoop om IF uit te voeren?
IF kan worden uitgevoerd op elke fluorescentiemicroscoop met de juiste excitatiebron en filtering, met inbegrip van epifluorescerende, scannende, en draaiende schijf confocale microscopen. Immunofluorescentie is over het algemeen ook compatibel met gespecialiseerde fluorescentietechnieken, waaronder totale interne reflectiefluorescentie (TIRF), lichtbladmicroscopie en sommige superresolutietechnieken.
Compatibiliteit met geautomatiseerde high-throughput screening/hoge-inhoudsanalyse
Elk antilichaam dat is goedgekeurd voor IF-IC kan worden gebruikt voor high-throughput screening (HCS) en hoge-inhoudsanalyse (HCA). Deze experimenten zijn gebaseerd op standaard IF-technieken, waarin automatisering is geïntegreerd.
Loopt u tegen problemen aan met uw IF-experiment? Klik hier voor een gids voor het oplossen van problemen.
Cell Signaling Technology, CST, en XP zijn handelsmerken van Cell Signaling Technology, Inc. Alle andere handelsmerken zijn het eigendom van hun respectieve eigenaars.