Waterstofbrug Definitie
Waterstofbrug is een aantrekkingskracht tussen een gedeeltelijk positief geladen waterstof en een gedeeltelijk negatief geladen atoom (zuurstof en stikstof). Dit is een zeer zwakke binding en de sterkte van de waterstofbrug (5-10 Kcal per binding) is veel minder dan de sterkte van een covalente binding. Waterstofbruggen worden meestal weergegeven als stippellijnen tussen twee atomen. Een voorbeeld van een waterstofbrug tussen twee watermoleculen is hieronder te zien:
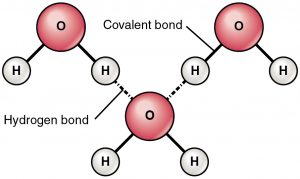
Reden van waterstofbruggen
Omdat er een zeer elektronegatief atoom zoals zuurstof of stikstof aanwezig is, wordt het gedeelde elektronenpaar tussen zuurstof en waterstof naar het meer elektronegatieve atoom getrokken. Deze ongelijke verdeling van elektronenparen leidt tot de vorming van twee partiële dipolen. De gedeeltelijk positief geladen waterstof wordt dan aangetrokken door de andere gedeeltelijk negatief geladen zuurstof of stikstof staat bekend als waterstofbinding.
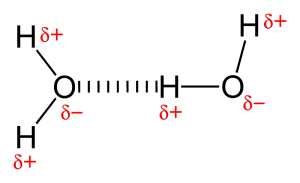
Typen waterstofbinding
Waterstofbinding kan optreden tussen twee atomen van hetzelfde molecuul of tussen twee atomen van verschillende molecuul. Afhankelijk daarvan zijn er twee soorten waterstofbruggen:
- Intermoleculaire waterstofbruggen
- Intramoleculaire waterstofbruggen
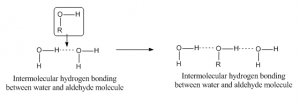
Intermoleculaire waterstofbruggen
Wanneer waterstofbruggen optreden tussen atomen van verschillende moleculen dan wordt dit intermoleculaire waterstofbruggen genoemd. Voor een dergelijke binding moet het ene molecuul een gedeeltelijk positief waterstofatoom als acceptoratoom hebben en een ander molecuul een gedeeltelijk negatief of donoratoom. Een voorbeeld van waterstofbruggen tussen aldehyde en watermolecuul is hieronder gegeven:
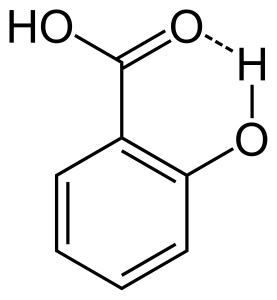
2. Intramoleculaire waterstofbrug
Wanneer waterstofbruggen optreden tussen twee gedeeltelijk geladen atomen van hetzelfde molecuul wordt dat intramoleculaire waterstofbruggen genoemd. Dit komt voor wanneer twee functionele groepen in zelfde molecule aanwezig zijn en zij op zodanige wijze zijn dat zij elkaar kunnen aantrekken om waterstofbrug te vormen. Bijvoorbeeld salicylzuur heeft twee functionele groepen alcohol en carboxylzuur. Hier treedt intramoleculaire waterstofbrug op tussen het waterstofatoom van de alcoholgroep en het zuurstofatoom van de carbonzuurgroep.
Effecten van waterstofbruggen
Op het kookpunt
Verwacht wordt dat het kookpunt van stoffen met hetzelfde of een vergelijkbaar molecuulgewicht hetzelfde of een vergelijkbaar kookpunt zou moeten hebben. Het kookpunt van ether en alkaan met een vergelijkbaar molecuulgewicht liggen niet ver uit elkaar. Maar het kookpunt van alcoholen ligt veel hoger dan dat van ether met een vergelijkbaar molecuulgewicht. Dit kan worden verklaard in termen van waterstofbruggen. Door de waterstofbruggen in alcohol stijgt het kookpunt. Er is extra energie nodig om de waterstofbrug te verbreken voordat het kookt. Omdat er geen waterstofbruggen zijn, hebben alkaan en ether een laag kookpunt.

Over oplosbaarheid
Alcoholen zijn oplosbaar in water, maar alkanen zijn dat niet. Dit komt omdat intermoleculair waterstofgebonden verbindingen kunnen oplossen in intermoleculair waterstofgebonden oplosmiddel. Een polaire molecule zoals alcohol kan twee watermoleculen binnendringen om een waterstofbrug te vormen, terwijl een niet-polaire stof zoals alkanen dat niet kan. Echter met de toename van de koolstofketen in alcoholen de oplosbaarheid afneemt als de lange keten krijgen in de weg om waterstofbrug te vormen.
Samenvatting
- Waterstofbrug is een aantrekkingskracht tussen een gedeeltelijk positief geladen waterstof en een gedeeltelijk negatief geladen atoom.
- Wanneer waterstofbruggen optreden tussen atomen van verschillende moleculen dan heet het intermoleculaire waterstofbruggen.
- Wanneer waterstofbinding optreedt tussen twee gedeeltelijk geladen atomen van hetzelfde molecuul dan wordt dat intramoleculaire waterstofbinding genoemd.
- Want door intermoleculaire waterstofbinding is het kookpunt van polaire verbindingen hoger dan van geen polaire verbindingen met dezelfde a.
- Want door waterstofbinding tussen organische verbinding en water is de oplosbaarheid tot op zekere hoogte mogelijk.