Gazy rzeczywiste i idealne
Gaz idealny to taki, który przestrzega praw gazowych w każdych warunkach temperatury i ciśnienia. Aby to zrobić, gaz musiałby całkowicie podporządkować się teorii kinetyczno-molekularnej. Cząsteczki gazu musiałyby zajmować zerową objętość i nie wykazywać żadnych sił przyciągających względem siebie. Ponieważ żaden z tych warunków nie może być prawdziwy, nie istnieje coś takiego jak gaz idealny. Prawdziwy gaz to gaz, który nie zachowuje się zgodnie z założeniami teorii kinetyczno-molekularnej. Na szczęście, w warunkach temperatury i ciśnienia, które są zwykle spotykane w laboratorium, prawdziwe gazy mają tendencję do zachowywania się bardzo podobnie do gazów idealnych.
W jakich warunkach zatem gazy zachowują się najmniej idealnie? Kiedy gaz jest poddany wysokiemu ciśnieniu, jego cząsteczki są zmuszone zbliżyć się do siebie, ponieważ pusta przestrzeń między cząsteczkami zmniejsza się. Zmniejszenie pustej przestrzeni oznacza, że założenie, iż objętość samych cząsteczek jest pomijalna, jest mniej ważne. Gdy gaz jest schładzany, spadek energii kinetycznej cząsteczek powoduje ich spowolnienie. Jeśli cząsteczki poruszają się z mniejszą prędkością, siły przyciągania między nimi są bardziej widoczne. Innym sposobem patrzenia na to jest to, że dalsze chłodzenie gazu w końcu zamieni go w ciecz, a ciecz z pewnością nie jest już gazem idealnym (patrz ciekły azot na rysunku poniżej). Podsumowując, gaz rzeczywisty najbardziej odbiega od gazu idealnego w niskich temperaturach i przy wysokich ciśnieniach. Gazy są najbardziej idealne w wysokiej temperaturze i pod niskim ciśnieniem.

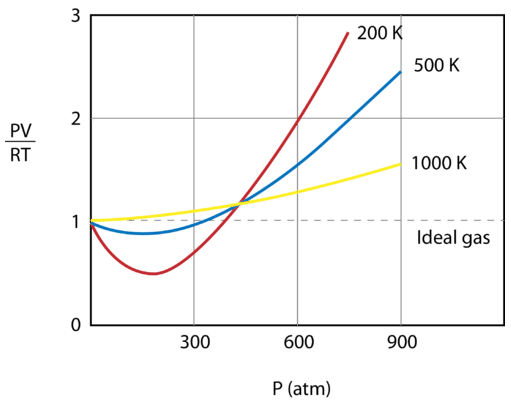
Idealność gazu zależy również od siły i rodzaju międzycząsteczkowych sił przyciągających, które istnieją pomiędzy cząsteczkami. Gazy, w których siły przyciągania są słabe, są bardziej idealne niż te o silnych siłach przyciągania. W tej samej temperaturze i pod tym samym ciśnieniem neon jest bardziej idealny niż para wodna, ponieważ atomy neonu przyciągają się tylko słabymi siłami rozpraszającymi, podczas gdy cząsteczki pary wodnej przyciągane są przez stosunkowo silniejsze wiązania wodorowe. Hel jest gazem bardziej idealnym niż neon, ponieważ jego mniejsza liczba elektronów oznacza, że siły rozproszenia helu są jeszcze słabsze niż siły rozproszenia neonu.