Wprowadzenie
Fizjologiczny kształt ściany klatki piersiowej ma fundamentalne znaczenie dla prawidłowej dynamiki oddychania i ochrony narządów znajdujących się w klatce piersiowej (1); dlatego też rekonstrukcja ściany klatki piersiowej ma ogromne znaczenie i może być trudną procedurą w dziedzinie torakochirurgii.
Choroby ściany klatki piersiowej mogą obejmować rozległy obszar wycięcia, a co za tym idzie, jej rekonstrukcja jest zróżnicowana. Martwica popromienna, miejscowa choroba infekcyjna lub nawracający rak piersi powodują znaczną destrukcję kości, mięśni, tkanek miękkich i skóry. Zapewnienie wszystkich tych elementów jest obowiązkowe dla uzyskania doskonałej rekonstrukcji (2).
Znaczne ubytki przednio-bocznej ściany klatki piersiowej i mostka uzasadniają modulowane podejście chirurgiczne mające na celu stabilną rekonstrukcję szkieletową. Głównym celem prawidłowego postępowania chirurgicznego jest zachowanie struktur leżących u podstawy, uniknięcie paradoksalnego oddychania i klatki piersiowej typu „flail chest” oraz, co nie mniej ważne, zapewnienie dobrych wyników funkcjonalnych i kosmetycznych (2). Stabilność szkieletową można uzyskać, chyba że przy użyciu tkanki autogennej lub materiału syntetycznego.
W pionierskiej erze chirurgii ściany klatki piersiowej, resekcja dotkniętego obszaru ściany klatki piersiowej była ograniczona dostępnością odpowiednich materiałów. Decyzja dotycząca sposobu rekonstrukcji ubytku była zagrożona przez zastosowanie protez, które nie gwarantowały trwałej i funkcjonalnej operacji.
Dzięki wprowadzeniu, w ciągu ostatnich dwóch dekad, różnych syntetyków lub materiałów biologicznych udoskonalono techniki chirurgiczne i umożliwiono szeroką resekcję i rekonstrukcję ściany klatki piersiowej z odpowiednią zachorowalnością i śmiertelnością (1).
Metody
Od stycznia 2017 r. do października 2019 r. czterech pacjentów z chorobami przedniej ściany klatki piersiowej poddano leczeniu chirurgicznemu:
- Dwóch młodych pacjentów, jeden z przemieszczonym urazowym złamaniem mostka, a drugi z pectus carinatum-excavatum, leczonych przez resekcję przedniej ściany klatki piersiowej i rekonstrukcję z zastosowaniem wchłanialnego sworznia i tytanowej aplikacji galwanicznej;
- Dwie dorosłe pacjentki z wcześniejszym rakiem piersi.
Przypadek 1
Gołe piersi są rzadkim typem anomalii przedniej ściany klatki piersiowej (3,4). Przedstawiamy przypadek ciężkiego gołębiego ubytku ściany klatki piersiowej, który został korzystnie skorygowany kilkoma chordotomiami, potrójną resekcyjną osteotomią mostka i ustabilizowany infibulacją kości gąbczastej przy użyciu wchłanialnego Grand-Fix i tytanowych prętów na korowej powierzchni mostka i żeber.
Dwudziestoletni mężczyzna zgłosił się z uporczywą gołębią piersią. Wykonano poprzeczne nacięcie mini-clamshell w 5. przestrzeni międzyżebrowej według linii Langera. Rozluźniając skórę i tkankę podskórną, obustronnie rozdzielono mięśnie piersiowe główne na ich przyczepach mostkowych i cofnięto je w celu uzyskania dobrego wyglądu deformacji ściany klatki piersiowej.
Mostek uwolniono na całej długości obustronnie przez resekcje podchrzęstne od drugiej do szóstej zdeformowanej chrząstki kostnej. Wykonano trzy osteotomie na powierzchni mostka:
- Klin przedni części korowo-gąbczastej zakrzywionego kąta zdeformowanego mostka;
- Nacięcie górnej części manubrium powyżej kąta Louisa;
- Nacięcie dolnej części trzonu mostka.
Drugie i trzecie osteotomie zostały następnie zbliżone i umocowane za pomocą dwóch A bioabsorbowalnych trzpieni z poli-laktydu (PLLA) (Grand-fix, Gunze Co, Ayabe, Japonia) (5).
Złagodzone chrząstki zostały ponownie zbliżone do mostka przez zszycie ich polidioksanonem N. 2 (Ethicon Inc, Johnson & Johnson International, Bruksela, Belgia, Europa). Na koniec rekonstrukcję górną umocowano za pomocą Synthes Titanium Sternal Fixation (DePuy Synthes® titanium system, Monument, CO, United States). Pręt łączący stabilizujący połączenie mostkowo-żebrowe został ręcznie uformowany do krzywizny powierzchni szkieletu klatki piersiowej i umieszczony pomiędzy drugą i trzecią osteotomią (Rycina 1). Płaty mięśni piersiowych zostały ponownie przyłączone do rekonstrukcji mostka.
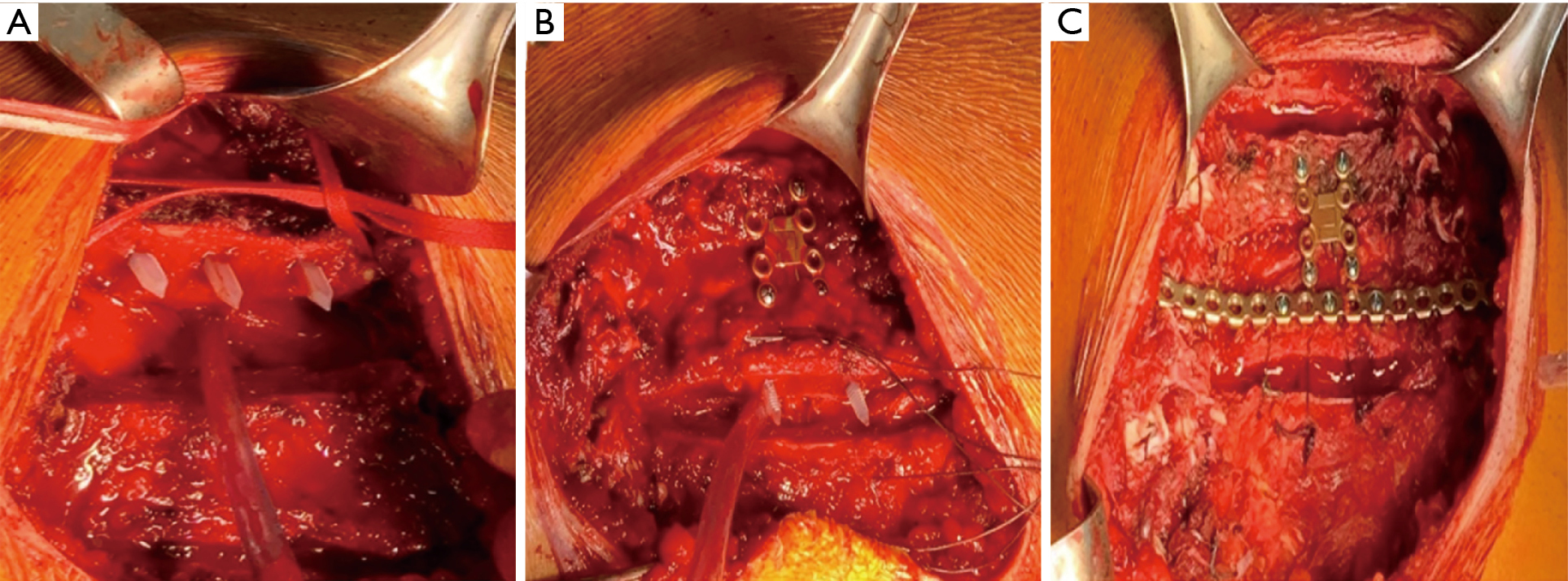
Pacjent został ekstubowany pod koniec zabiegu i został wypisany w 9. dobie pooperacyjnej z doustnym leczeniem przeciwbólowym. Kontrolna tomografia komputerowa po 4 miesiącach wykazała dobre wyniki (Rycina 2).

Przypadek 2
Większość złamań mostka (>95%) jest leczona zachowawczo. Jednak w przypadku złamań niestabilnych, niestabilności ściany klatki piersiowej, zniekształcenia mostka, niewydolności oddechowej, silnego bólu i złamań niezespolonych z powodu rozległego przemieszczenia kości z otaczającymi tkankami miękkimi, można wykonać zespolenie chirurgiczne. W literaturze opisano kilka metod unieruchomienia (6-8).
Prezentujemy przypadek 15-letniego mężczyzny z poprzecznym złamaniem manubrium po urazie sportowym. Pacjent zgłosił się do naszego oddziału z powodu utrzymujących się dolegliwości bólowych. Przed leczeniem operacyjnym wykonano trójwymiarową, zrekonstruowaną tomografię komputerową w celu uzyskania szczegółowych informacji na temat morfologii rozejścia się mostka (Rycina 3).

T-incision obtained access to the manubrium and the sternum, was obtained through a collar transverse skin incision coupled with a median cut from the jugular notch to the Louis angle. Brzegi manubrium i miejsce złamania zostały całkowicie odsłonięte. Wszelkie uwięzione tkanki miękkie zostały usunięte ze złamania, aby zapewnić anatomiczną redukcję. Wewnętrzną fiksację przeprowadzono za pomocą dwóch bioabsorbowalnych trzpieni z poli-L-laktydu (PLLA) (Grand-fix, Gunze Co., Ayabe, Japonia) (Ryc. 4). Następnie użyto dwóch podłużnych płytek tytanowych do unieruchomienia złamania poprzecznego. Zdecydowaliśmy się na użycie równoległych, podłużnie zorientowanych płytek do ewentualnej przyszłej sternotomii.
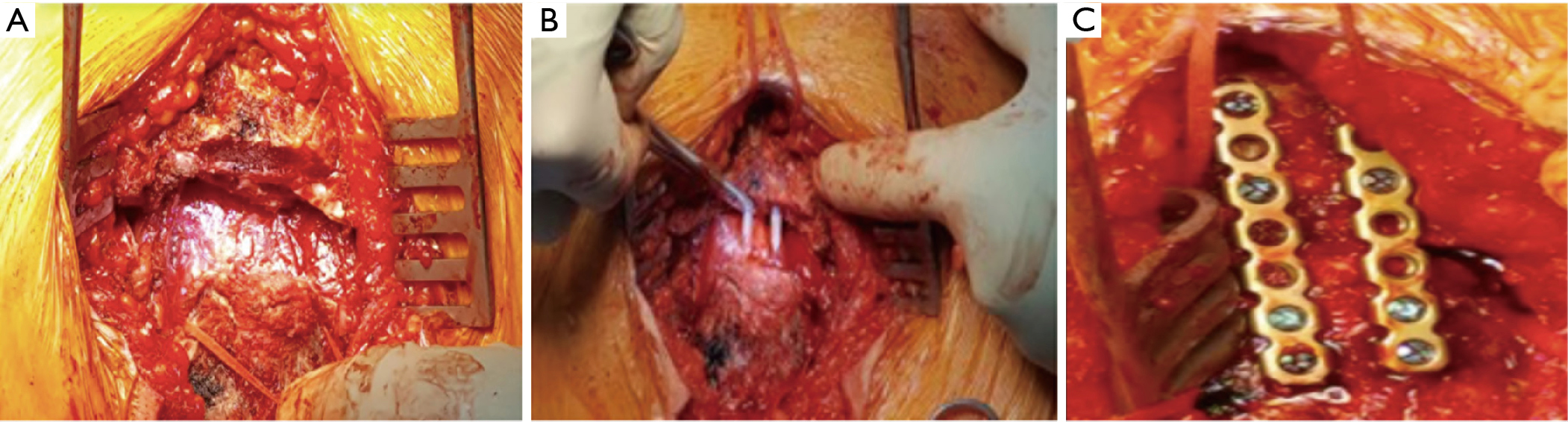
Przebieg pooperacyjny był bez powikłań, a pacjent został wypisany po 4 dniach (Rycina 5).

Przypadek 3
Mięsaki popromienne są nieczęstymi powikłaniami radioterapii (RT), które mogą wystąpić po wielu latach utajenia (9). Chociaż adiuwantowa RT po operacji piersi odgrywa kluczową rolę w leczeniu wczesnego stadium nowotworu złośliwego piersi (10), mięsaki tkanek miękkich/mięśniowych i kostnych klatki piersiowej zostały opisane jako ograniczone powikłanie RT z powodu nowotworu piersi (10,11).
Prezentujemy przypadek 50-letniej kobiety z wywiadem choroby inwazyjnego raka przewodowego (pT2N3M0, stadium IIIC, 8. system klasyfikacji AJCC), leczonej lewostronną mastektomią z usunięciem pachowych węzłów chłonnych i pooperacyjną adjuwantową chemio-/radioterapią. Po jedenastu latach od pierwotnego leczenia RT u chorej wystąpił ból w mostku, w związku z czym zaplanowano wykonanie badania TK. Badanie TK klatki piersiowej z jodowym wzmocnieniem kontrastowym uwidoczniło kostny guz (ryc. 6) manubrium i górnej części mostka, gdzie zwykle znajduje się kąt Ludwika. Nowotwór rozciąga się na połączenia 2-4 żebrowo-kostno-chrzęstne obustronnie z zajęciem śródpiersia i osierdzia. Zmiana była hipermetaboliczna w pozytonowej tomografii emisyjnej (PET).
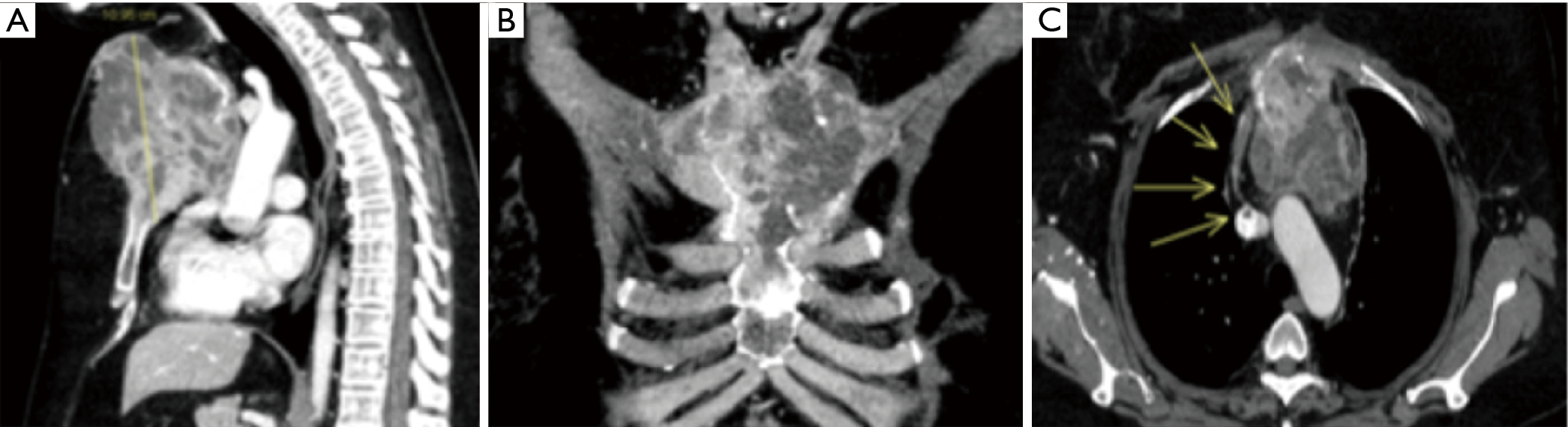
Zabieg polegał na częściowym usunięciu mostka (zachowano dolną część kości). Wykonano resekcję drogi kostno-chrzęstnej od drugiego do czwartego żebra obustronnie. Usunięto przyśrodkową część obu obojczyków oraz przednią część osierdzia. W ten sposób okołozabiegowe tkanki miękkie wycięto en bloc, a śródoperacyjne badanie mrożone potwierdziło ujemne marginesy.
Osierdzie zrekonstruowano łatą z politetrafluoroetylenu (PTFE, GORE-TEX®, Flagstaff, AZ, Stany Zjednoczone) o grubości 0,1 mm. Do odbudowy ściany klatki piersiowej wybrano połączenie wytrzymałej siatki (syntetycznej) i implantów tytanowych. Duży kawałek membrany Gore-tex, grubości 2 mm, został najpierw przymocowany obwodowo do brzegów kostnych za pomocą przerywanych szwów niewchłanialnych pod maksymalnym napięciem. Takie podejście umożliwia stworzenie elastycznej bariery, która gwarantuje rozsądny stopień ochrony obu płuc i śródpiersia przed tkankami powierzchownymi (Ryc. 7). Drugim krokiem było przywrócenie sztywności ściany klatki piersiowej za pomocą płyt tytanowych. Trzy wyprofilowane płytki rekonstrukcyjne (DePuy Synthes® titanium system, Monument, CO, Stany Zjednoczone) przymocowano do drugiego i czwartego żebra obustronnie (Rycina 7A) oraz do obojczyka za pomocą Sternal ZIPFIX® System (DePuy Synthes® titanium system, West Chester, PA, Stany Zjednoczone) (Rycina 7B). Aby pokryć ubytek przedniej części klatki piersiowej, użyto obustronnych płatów piersiowych.
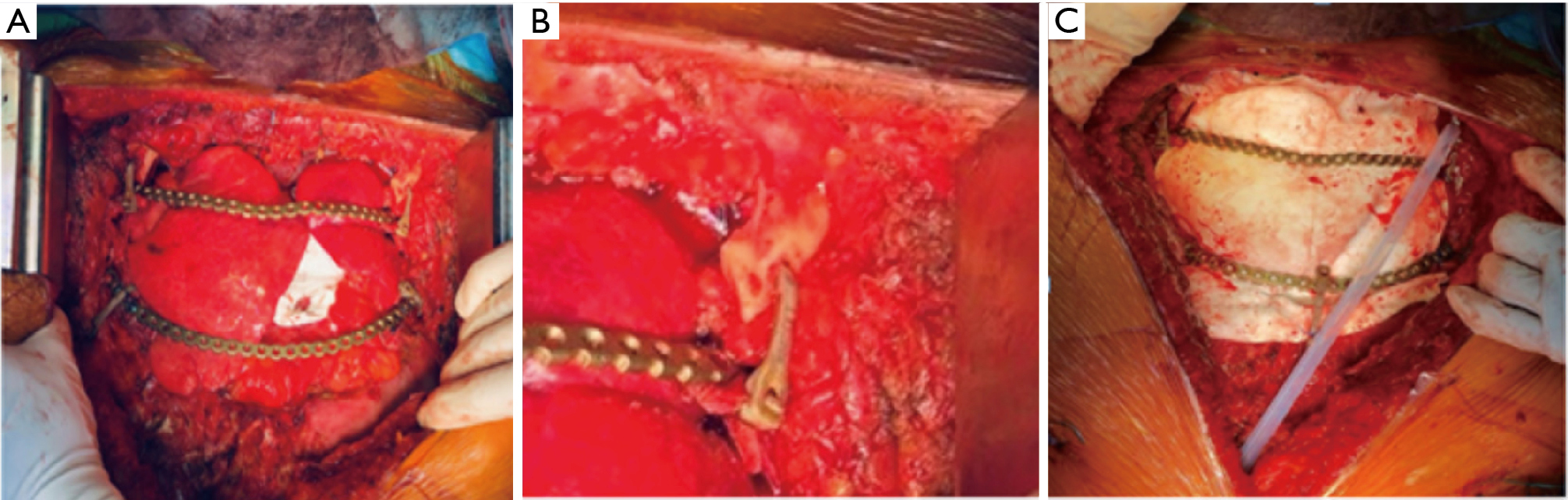
Post-operacja charakteryzowała się częściową martwicą skóry i infekcją, z następową prawostronną odmą opłucnową, która wymagała umieszczenia drenażu klatki piersiowej. Pacjent został poddany powtórnej operacji polegającej na usunięciu zmian i pierwotnym zamknięciu za pomocą mio-skórnego płata z latissimus dorsi. Ostateczna patologia potwierdziła radioindukcję osteosarcoma. Obserwacja po 2 latach wykazała doskonały efekt kosmetyczny i brak nawrotu choroby.
Przypadek 4
67-letnia kobieta, z infekcją przedniej ściany klatki piersiowej po stronie lewej, rozciągającą się od płaszczyzny skórnej aż do jamy opłucnej, z zapaleniem kości stercza, zgłosiła się do naszej Kliniki Chirurgicznej na konsultację. Pacjentka w wywiadzie miała wcześniej leczonego inwazyjnego raka piersi poprzez mastektomię z usunięciem węzłów chłonnych pachowych, a następnie adjuwantową chemio- i radioterapię.
Rok po operacji piersi pacjentka przeszła obustronną addytywną mastoplastykę, powikłaną infekcją. Po około tygodniu usunięto implant lewej piersi z powodu pojawienia się martwicy skóry podtrzymywanej przez Pseudomonas aeruginosa extensively drug-resistant (XDR). Następnie zastosowano kilka cykli chemioterapii bez powodzenia.
Przedyskutowaliśmy ten przypadek z chirurgami plastycznymi i kolegami zajmującymi się chorobami zakaźnymi, aby przewidzieć potencjalne powikłania śródoperacyjne i wspólnie opracowaliśmy odpowiedni plan. Wszyscy zdecydowaliśmy, że nie będziemy wszczepiać materiałów syntetycznych z powodu infekcji i zapalenia kości (12), dlatego jednogłośnie uznaliśmy autoprzeszczepy za najlepsze narzędzie do naprawy ciała w tym przypadku.
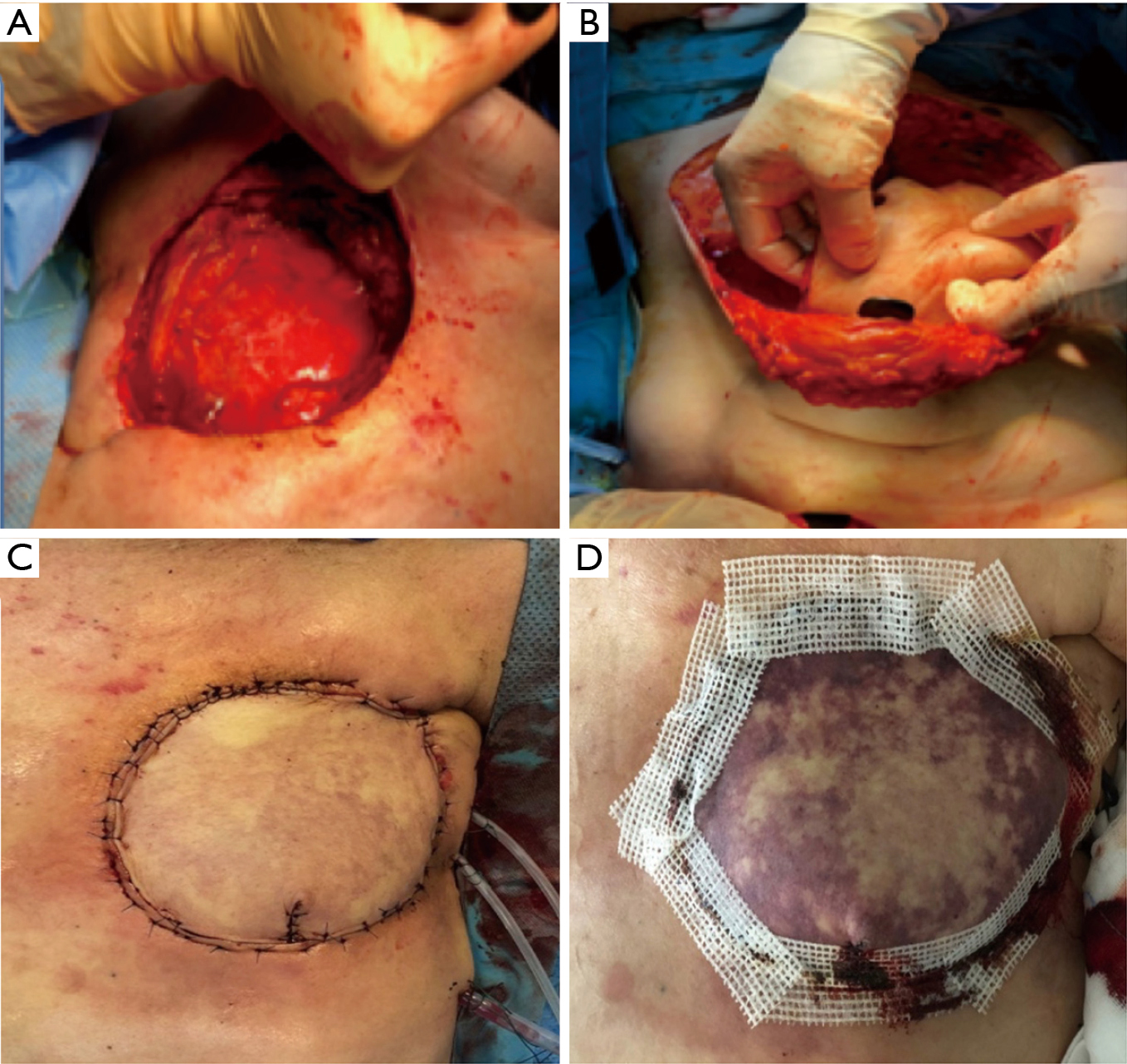
Próbki tkanki z owrzodzenia zostały pobrane śródoperacyjnie i wysłane na posiew bakteryjny i badanie wrażliwości na antybiotyki. Próbki te zostały wykorzystane do wykrycia najlepszego wyboru antybiotyków pooperacyjnych i zaprzestania lub uzupełnienia przedoperacyjnego leczenia empirycznego. Po resekcji przetoki ściany klatki piersiowej i otaczającej ją zbliznowaciałej skóry, wraz z tkankami martwiczymi ściany klatki piersiowej, resekowano przednie segmenty drugiego i trzeciego żebra wraz z górną częścią mostka. Przeprowadzono odsłonięcie zdrowych tkanek ściany klatki piersiowej i opłucnej trzewnej (ryc. 8A) wraz z oczyszczeniem opłucnej. Ostatecznie, pediklowany płat mięśnia poprzecznie prostego brzucha (TRAM) został pobrany i użyty do umocowania ubytku ściany klatki piersiowej (rysunek 8B,C). Dwa dni później wystąpiła martwica, wymagająca reoperacji w celu zmiany płata (Rycina 8D).
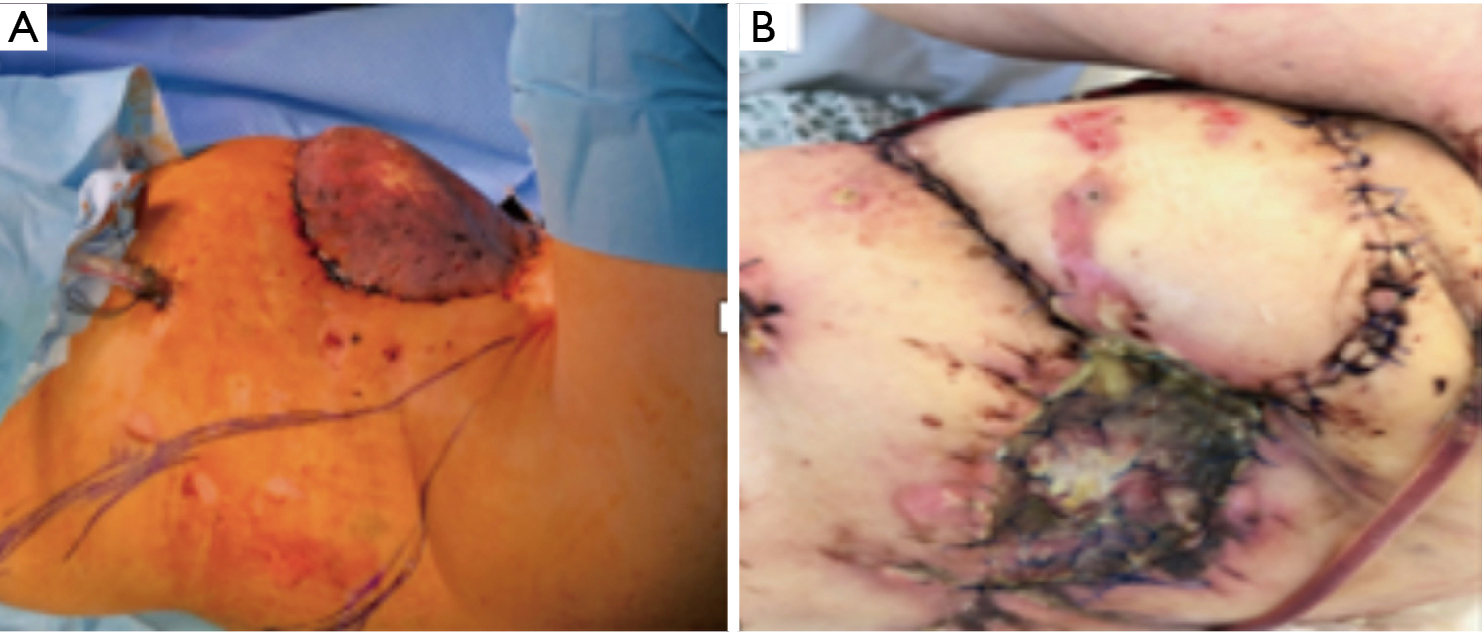
Alternatywnie, w celu pokrycia ubytku, użyto płata z mięśnia latissimus dorsi (Rycina 9A), ale po czterech dniach ponownie wystąpiła martwica (Rycina 9B).
Więzadło wielkie zostało zatem wyrwane przez tunel podskórny z jamy brzusznej do klatki piersiowej przy użyciu podejścia laparoskopowego. The diaphragm operculum was made to be roomy enough to maintain the blood supply of the great omentum once was transferred in the anterior chest wall defect. Szypułę jelita grubego pokryto przeszczepem skóry pobranym z prawego uda. Jednak z powodu nowej częściowej martwicy przywieźliśmy pacjenta po raz czwarty na salę operacyjną (Rycina 10).
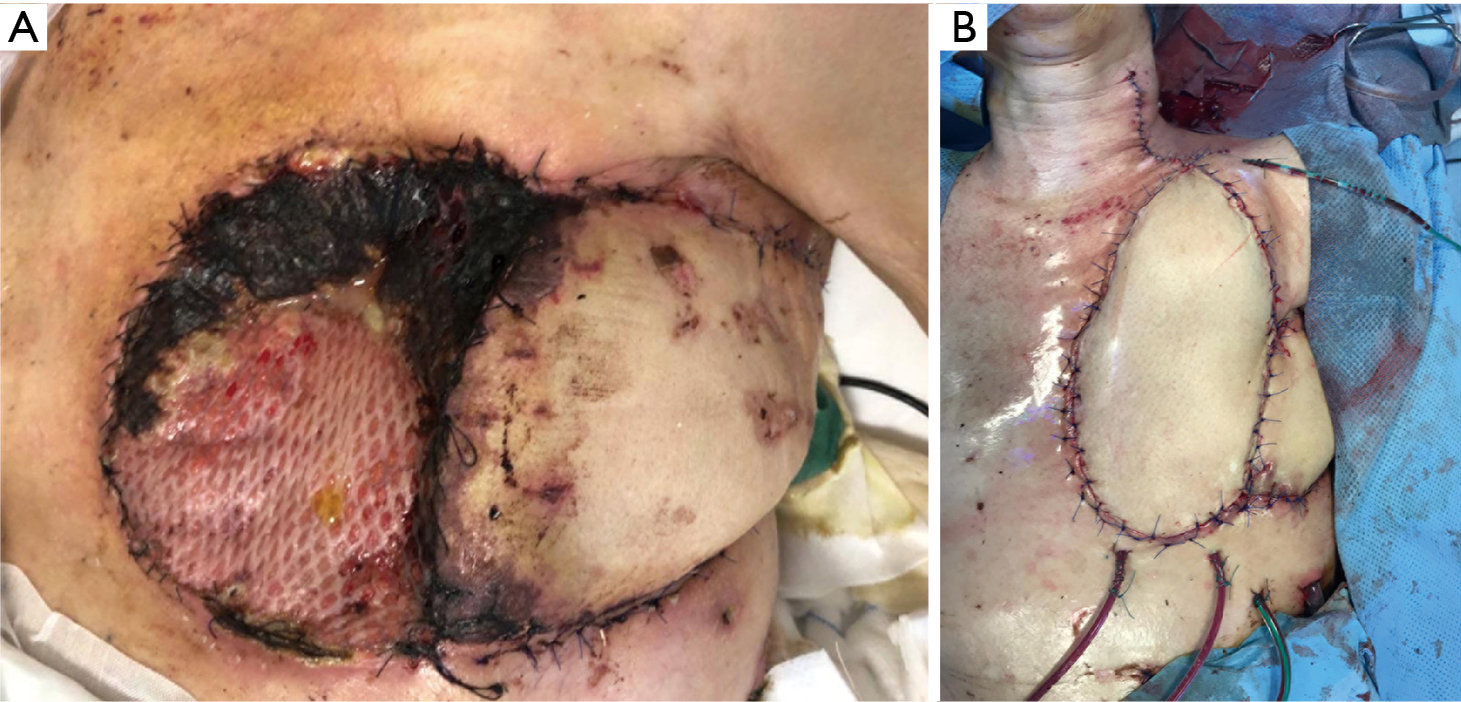
Pobrano wolny płat z uda lewego. Naczynia z przeszczepu zostały zespolone, w powiększeniu, koniec do końca z tętnicą tarczową dolną i żyłą szyjną wewnętrzną. Miejsce dawcze zostało następnie pierwotnie zamknięte.
Na koniec nie stwierdzono żadnych problemów pooperacyjnych związanych z unaczynieniem przeszczepu. Wreszcie, pacjent powoli i stabilnie wraca do zdrowia po zabiegach chirurgicznych.
Wyniki
Wśród tych czterech pacjentów z chorobami przedniej części klatki piersiowej, mieliśmy różne wyniki między dwiema grupami.
W obu dwóch młodych pacjentach, jednym z przemieszczonym urazowym złamaniem mostka i drugim z gołębią klatką piersiową, mieliśmy dobre wyniki korygując zniekształcenia, a następnie utrwalając je za pomocą kombinacji różnych materiałów. Jak już wykazano, kontrolna tomografia komputerowa potwierdza dobry wynik kosmetyczny, z zadowalającą rekonstrukcją i regularnym ruchem. Zarówno pacjenci, jak i rodzice opisują poprawę komfortu emocjonalnego i pewności siebie, jak również zwiększenie aktywności fizycznej i społecznej od okresu przed do pooperacyjnego.
Przebieg pooperacyjny był skomplikowany u dwóch najstarszych pacjentek, które przeszły wcześniej operację i radioterapię z powodu raka piersi. W obu przypadkach doszło do dehiscencji skóry i konieczna była dalsza rewizja chirurgiczna.
Wnioski
Deformacje przedniej ściany klatki piersiowej mogą być konsekwencją wad wrodzonych, urazów, nowotworów (takich jak guzy przerzutowe lub pierwotne), radioterapii i zakażeń.
Nie ma zgodności co do tego, które zmiany w ścianie klatki piersiowej powinny być naprawiane, ale powszechnie urazy mniejsze niż 5 cm w dowolnym miejscu i te do 10 cm w wymiarze tylnym nie wymagają naprawy ze względów funkcjonalnych (3).
Na przestrzeni lat opisano kilka procedur chirurgicznych, obejmujących różne materiały do naprawy lub stabilizacji ściany klatki piersiowej. Najważniejsze, szczególnie po rozległej resekcji ściany klatki piersiowej, jest: zapewnienie optymalnej stabilizacji i podparcia klatki piersiowej, uniknięcie niewydolności oddechowej, paradoksalnych ruchów oddechowych, przepukliny narządów klatki piersiowej, zapobieganie przewlekłemu bólowi pooperacyjnemu i uzyskanie akceptowalnego efektu kosmetycznego (1). Optymalne wyniki uzyskuje się stosując kombinację sztywnych i biologicznych materiałów protetycznych (13) lub tkanki autogennej.
Opisujemy tu małą serię przypadków 4 pacjentów leczonych z powodu czterech różnych chorób czterema różnymi technikami. Wybór rodzaju implantu został dokonany zgodnie z cechami idealnego materiału protetycznego podanymi przez Le Roux i Shama (2):
- Sztywność, aby znieść ruch paradoksalny;
- Obojętność, aby umożliwić wrastanie tkanki włóknistej i zmniejszyć prawdopodobieństwo zakażenia;
- Możliwość dopasowania do odpowiedniego kształtu w czasie operacji;
- Radioluzyjność, aby umożliwić radiograficzną kontrolę podstawowych problemów.
Mając na uwadze te zasady, stosowaliśmy różne rodzaje materiałów, zawsze w połączeniu, aby pokryć i chronić struktury leżące u podłoża oraz zapobiegać klatki piersiowej i paradoksalnemu oddychaniu.
Ponadto, chcielibyśmy podkreślić, jak te materiały, powszechnie stosowane w innych specjalnościach, mogą być doprowadzone do synergistycznego działania z łatami lub tytanowymi płytkami/siatkami w celu uzyskania optymalnego wyniku w scenariuszach rekonstrukcji/stabilizacji ściany klatki piersiowej w torakochirurgii.
Pomysł, stojący za wchłanialnym urządzeniem do mocowania kości wykonanym z PLLA (kwas poli-L-mlekowy), które zastosowaliśmy jako kostny infibulator śródszpikowy, polega na pomocy w znacznej stabilizacji pracy tytanowych prętów. System Zipfix został stworzony w celu umożliwienia szybkiego zamknięcia mostka. System ten składa się głównie z PEEK (polieteroeteroketon). Jest on łatwy w aplikacji, biokompatybilny i kompatybilny z rezonansem magnetycznym po usunięciu igły ze stali nierdzewnej. Użyliśmy tego materiału do umocowania stawu obojczykowego i płytek żebrowych.
Skanowanie 3D odegrało kluczową rolę w sukcesie naszej rekonstrukcyjnej operacji klatki piersiowej, pomagając nam skorygować podejście chirurgiczne w oparciu o przestrzenne rozmieszczenie chorego obszaru do skorygowania lub usunięcia.
Wreszcie, wielodyscyplinarne planowanie wraz z racjonalnym podejściem chirurgicznym prowadzi do dobrych wyników i znalezienia właściwego rozwiązania w przypadku powikłań, jak opisano w naszej małej serii przypadków.
Podziękowania
Chcielibyśmy podziękować Pani Simonetcie Padovani i Pani Nadii Lanni za ich wybitną pracę w zbieraniu danych klinicznych i zarządzanie z wielkim profesjonalizmem i empatią interakcjami z naszymi pacjentami i ich rodzinami.
Finansowanie: Brak
Footnote
Provenance and Peer Review: Ten artykuł został zamówiony przez redaktorów gościnnych (Francesco Zaraca, Reinhold Perkmann, Luca Bertolaccini i Roberto Crisci) do wydania Focused Issue „Thoracic Surgery Without Borders” opublikowanego w Current Challenges in Thoracic Surgery. Artykuł został wysłany do zewnętrznej recenzji zorganizowanej przez Guest Editors i redakcję.
Conflicts of Interest: Wszyscy autorzy wypełnili ujednolicony formularz ICMJE dotyczący ujawniania informacji (dostępny na stronie http://dx.doi.org/10.21037/ccts.2020.02.05). Wydanie Focused Issue „Thoracic Surgery Without Borders” zostało przygotowane na zlecenie redakcji bez żadnego finansowania ani sponsorowania. ND pełni funkcję nieopłacanego członka rady redakcyjnej Current Challenges in Thoracic Surgery od lutego 2020 do stycznia 2022 roku. Autorzy nie mają innych konfliktów interesów do zgłoszenia.
Oświadczenie etyczne: Autorzy są odpowiedzialni za wszystkie aspekty pracy w zapewnieniu, że pytania związane z dokładnością lub integralnością jakiejkolwiek części pracy są odpowiednio zbadane i rozwiązane. Ponieważ niniejsza praca jest badaniem retrospektywnym, nie była wymagana zgoda komisji etycznej ani świadoma zgoda pacjenta. Badanie przeprowadzono zgodnie z Deklaracją Helsińską (zrewidowaną w 2013 roku).
Oświadczenie o otwartym dostępie: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which allows the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). Zobacz: https://creativecommons.org/licenses/by-nc-nd/4.0/,
- Sanna S, Brandolini J, Pardolesi P, et al. Materials and techniques in chest wall reconstruction: a review. J Vis Surg 2017;3:95.
- Hameed A, Akhtar S, Naqvi A, et al. Reconstruction of complex chest wall defects by using polypropylene mesh and a pedicle latissimus dorsi flap: a 6-year experience. J Plast Reconstr Aesthet Surg 2008;61:628-35.
- Brichon PY, Wihlm JM. Correction of a Severe Pouter Pigeon Breast by Triple Sternal Osteotomy with a novel titanium rib cage fixation. Ann Thorac Surg 2010;90:e97-9.
- Lam CR, Taber RE. Surgical treatment of pectus carinatum. Arch Surg 1971;103:191-4.
- Saito T, Iguchi A, Sakurai M, et al. Biomechanical study of a Poly-L-L-Lactide (PLLA) sternal pin in sternal closure after cardiothoracic surgery. Ann Thorac Surg 2004;77:684-7.
- Athanassiadi K, Gerazounis M, Moustardas M, et al. Sternal fractures: retrospective analysis of 100 cases. World J Surg 2002;26:1243-6.
- Severson EP, Thompson CA, Resig SG, et al. Transverse sternal nonunion, repair and revision: a case report and review of the literature. J Trauma 2009;66:1485-8.
- Queitsch C, Kienast B, Voigt C, et al. Treatment of posttraumatic sternal non-union with a locked sternumosteosynthesis plate (TiFix). Injury 2011;42:44-6.
- Cahan WG, Woodard HQ, Higinbotham NL, et al. Sarcoma arising in irradiated bone: report of 11 cases. Cancer 1948;1:3-29.
- Veronesi U, Cascinelli N, Mariani L, et al. Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med 2002;347:1227-32.
- Yap J, Chuba PJ, Thomas R, et al. Sarcoma as a second malignancy after treatment for breast cancer. Int J Radiat Oncol Biol Phys 2002;52:1231-7.
- Zhou Y, Zhang Y. Single- versus 2-stage reconstruction for chronic post-radiation chest wall ulcer. A 10-year retrospective study of chronic radiation-induced ulcers. Medicine 2019;98:e14567.
- Tamburini N, Grossi W, Sanna S, et al. Chest wall reconstruction using a new titanium mesh: a multicenters experience. J Thorac Dis 2019;11:3459-66.
Cite this article as: Giunta D, Daddi N, Antonacci F, Pinto V, Solli P, Dolci G. Anterior chest wall reconstruction for oncologic and non-oncologic pathology: a case series. Curr Chall Thorac Surg 2020;2:24.
.