Editor-In-Chief: C. Michael Gibson, M.S., M.D. ; Associate Editor(s)-in-Chief: Aparna Vuppala, M.B.B.S.
Disclaimer
WikiDoc MAKES NO GUARANTEE OF VALIDITY. WikiDoc nie jest profesjonalnym dostawcą usług medycznych, ani nie jest odpowiednim zamiennikiem dla licencjonowanego dostawcy usług medycznych. WikiDoc ma być narzędziem edukacyjnym, a nie narzędziem służącym do świadczenia opieki zdrowotnej w jakiejkolwiek formie. Treści edukacyjne na stronach WikiDoc poświęconych lekom są oparte na ulotkach dołączonych do opakowań FDA, zawartości National Library of Medicine i wytycznych praktyki / oświadczeniach konsensusu. WikiDoc nie promuje podawania jakichkolwiek leków lub urządzeń, które nie są zgodne z ich etykietą. Proszę przeczytać nasze pełne zrzeczenie się odpowiedzialności tutaj.
Overview
Butalbital jest połączeniem, które jest zatwierdzone przez FDA do leczenia w celu złagodzenia zespołu objawów napięciowego (lub skurcz mięśni) bólu głowy. Częste działania niepożądane obejmują światłowstręt i zaburzenia żołądkowo-jelitowe, w tym nudności, wymioty i wzdęcia, toksyczną nekrolizę naskórka i rumień wielopostaciowy.
Wskazania i dawkowanie u dorosłych
Wskazania i dawkowanie według wskazań FDA-Labeled (dorośli)
Ból głowy
- Tabletki zawierające butalbital, aspirynę i kofeinę są wskazane do łagodzenia zespołu objawów napięciowego (lub kurczowego) bólu głowy.
- Dowody potwierdzające skuteczność i bezpieczeństwo stosowania butalbitalu, aspiryny i kofeiny w leczeniu wielokrotnych nawracających bólów głowy są niedostępne. Należy zachować ostrożność w tym zakresie, ponieważ butalbital tworzy nawyk i może być nadużywany.
Zastosowanie pozarejestracyjne i dawkowanie (dorośli)
Zastosowanie pozarejestracyjne
Istnieją ograniczone informacje dotyczące pozarejestracyjnego stosowania butalbitalu u dorosłych pacjentów.
Non-Guideline-Supported Use
Istnieją ograniczone informacje dotyczące stosowania produktu Butalbital poza wskazaniami rejestracyjnymi u dorosłych pacjentów.
Pediatric Indications and Dosage
FDA-Labeled Indications and Dosage (Pediatric)
Istnieją ograniczone informacje dotyczące stosowania produktu Butalbital zgodnie z zaleceniami FDA-Labeled u pacjentów pediatrycznych.
Off-Label Use and Dosage (Pediatric)
Guideline-Supported Use
Istnieją ograniczone informacje dotyczące stosowania produktu Butalbital poza wskazaniami klinicznymi u pacjentów pediatrycznych.
Non-Guideline-Supported Use
Istnieją ograniczone informacje dotyczące pozarejestracyjnego stosowania butalbitalu u pacjentów pediatrycznych.
Przeciwwskazania
- Nadwrażliwość na aspirynę, kofeinę lub barbiturany. Pacjenci z porfirią.
Ostrzeżenia
Uzależnienie od leków:
- Długotrwałe stosowanie barbituranów może powodować uzależnienie od leków, charakteryzujące się zależnością psychiczną, rzadziej zależnością fizyczną i tolerancją. Odpowiedzialność za nadużywanie butalbitalu, aspiryny i kofeiny jest podobna jak w przypadku innych połączeń leków zawierających barbiturany. Należy zachować ostrożność przepisując leki pacjentom o znanej skłonności do przyjmowania nadmiernych ilości leków, co nie jest rzadkie u pacjentów z przewlekłym napięciowym bólem głowy.
Stosowanie u pacjentów ambulatoryjnych:
- Butalbital, aspiryna i kofeina mogą upośledzać zdolności umysłowe i (lub) fizyczne wymagane do wykonywania potencjalnie niebezpiecznych zadań, takich jak prowadzenie samochodu lub obsługiwanie maszyn. Pacjent powinien zostać odpowiednio ostrzeżony. Działanie depresyjne na ośrodkowy układ nerwowy butalbitalu może być addytywne w stosunku do działania innych leków depresyjnych na ośrodkowy układ nerwowy. Należy unikać jednoczesnego stosowania z innymi lekami uspokajająco-hipnotycznymi lub alkoholem. Jeśli takie leczenie skojarzone jest konieczne, może być konieczne zmniejszenie dawki jednego lub więcej środków.
Środki ostrożności
- Salicylany powinny być stosowane ze szczególną ostrożnością w obecności choroby wrzodowej lub zaburzeń krzepnięcia.
Działania niepożądane
Doświadczenia z badań klinicznych
- Najczęstsze działania niepożądane to senność i zawroty głowy. Mniej częste działania niepożądane to światłowstręt i zaburzenia żołądkowo-jelitowe, w tym nudności, wymioty i wzdęcia. Zgłaszano pojedyncze przypadki supresji szpiku kostnego podczas stosowania butalbitalu, aspiryny i kofeiny. Zgłaszano kilka przypadków reakcji dermatologicznych, w tym toksycznej nekrolizy naskórka i rumienia wielopostaciowego.
Doświadczenia pozarynkowe
W etykiecie produktu leczniczego znajdują się ograniczone informacje dotyczące doświadczeń pozarynkowych związanych ze stosowaniem butalbitalu.
Drug Interactions
W etykiecie leku znajdują się ograniczone informacje dotyczące Butalbital Drug Interactions.
Use in Specific Populations
Pregnancy
Pregnancy Category (FDA): C
- Nie przeprowadzono odpowiednich badań na zwierzętach w celu określenia, czy lek ten wpływa na płodność u samców lub samic, ma potencjał teratogenny lub wywiera inne szkodliwe działanie na płód. Chociaż nie ma dobrze kontrolowanych badań u kobiet w ciąży, ponad dwadzieścia lat doświadczeń marketingowych i klinicznych nie zawiera żadnych pozytywnych dowodów na szkodliwe działanie na płód. Chociaż nie istnieje jasno określone ryzyko, doświadczenie to nie może wykluczyć możliwości rzadkiego lub subtelnego uszkodzenia płodu ludzkiego. Butalbital, aspiryna i kofeina powinny być stosowane u kobiet w ciąży tylko w przypadku zdecydowanej konieczności.
Kategoria ciążowa (AUS): Nie ma wytycznych Australian Drug Evaluation Committee (ADEC) dotyczących stosowania produktu Butalbital u kobiet w ciąży.
Praca i poród
Nie ma wytycznych FDA dotyczących stosowania produktu Butalbital podczas pracy i porodu.
Matki karmiące
- Nie jest znany wpływ butalbitalu, aspiryny i kofeiny na niemowlęta matek karmiących. Salicylany i barbiturany są wydzielane do mleka matek karmiących piersią. Uważa się, że stężenie w surowicy u niemowląt jest nieistotne w przypadku dawek terapeutycznych.
Stosowanie u dzieci
- Bezpieczeństwo i skuteczność u pacjentów pediatrycznych w wieku poniżej 12 lat nie zostały ustalone.
Stosowanie u osób w podeszłym wieku
Nie ma wytycznych FDA dotyczących stosowania produktu Butalbital w odniesieniu do pacjentów geriatrycznych.
Płeć
Nie ma wytycznych FDA dotyczących stosowania produktu Butalbital w odniesieniu do populacji określonej płci.
Rasa
Nie ma wytycznych FDA dotyczących stosowania produktu Butalbital w odniesieniu do określonych populacji rasowych.
Niewydolność nerek
Nie ma wytycznych FDA dotyczących stosowania produktu Butalbital u pacjentów z zaburzeniami czynności nerek.
Hepatic Impairment
Nie ma wytycznych FDA dotyczących stosowania produktu Butalbital u pacjentów z zaburzeniami czynności wątroby.
Kobiety o potencjale rozrodczym i mężczyźni
Nie ma wytycznych FDA dotyczących stosowania produktu Butalbital u kobiet o potencjale rozrodczym i mężczyzn.
Pacjenci z zaburzeniami odporności
Nie ma wytycznych FDA dotyczących stosowania produktu Butalbital u pacjentów z zaburzeniami odporności.
Administrowanie i monitorowanie
Administrowanie
- Oral
Monitorowanie
W etykiecie leku znajduje się ograniczona ilość informacji dotyczących monitorowania produktu Butalbital.
Zgodność IV
W etykiecie leku znajduje się ograniczona ilość informacji dotyczących zgodności IV butalbitalu.
Przedawkowanie
- Toksyczne działanie ostrego przedawkowania butalbitalu, aspiryny i kofeiny przypisuje się głównie jego składnikowi barbituranowemu oraz, w mniejszym stopniu, aspirynie. Ponieważ toksyczne działanie kofeiny występuje tylko w bardzo dużych dawkach, możliwość wystąpienia znacznej toksyczności kofeiny w wyniku przedawkowania butalitalu, aspiryny i kofeiny jest mało prawdopodobna. Objawy przypisywane ostremu zatruciu barbituranami obejmują senność, dezorientację i śpiączkę; depresję oddechową; niedociśnienie; wstrząs. Objawy przypisywane ostremu zatruciu aspiryną obejmują hiperpneę; zaburzenia równowagi kwasowo-zasadowej z rozwojem kwasicy metabolicznej; wymioty i ból brzucha; szum w uszach; hipertermię; hipoprotrombinemię; niepokój; delirium; drgawki. Ostre zatrucie kofeiną może powodować bezsenność, niepokój, drżenie i delirium; tachykardię i ekstrasystole. Leczenie polega przede wszystkim na opanowaniu zatrucia barbituranami i wyrównaniu zaburzeń równowagi kwasowo-zasadowej spowodowanych salicylanami. U przytomnych pacjentów wymioty powinny być wywołane mechanicznie lub za pomocą emetyków. Płukanie żołądka może być zastosowane, jeśli obecne są odruchy gardłowe i krtaniowe oraz jeśli od spożycia upłynęło mniej niż 4 godziny. Przed płukaniem żołądka u pacjenta nieprzytomnego i w razie potrzeby w celu zapewnienia oddychania wspomaganego należy założyć rurkę intubacyjną z mankietem. Diureza, alkalizacja moczu i korekta zaburzeń elektrolitowych powinny być osiągnięte poprzez podawanie płynów dożylnych, takich jak 1% wodorowęglan sodu w 5% roztworze wodnym dekstrozy. Należy zwracać szczególną uwagę na utrzymanie odpowiedniej wentylacji płuc. Korekta niedociśnienia tętniczego może wymagać podania bitartratu lewherenolu lub chlorowodorku fenylefryny w infuzji dożylnej. W ciężkich przypadkach zatrucia ratunkiem dla życia może być dializa otrzewnowa, hemodializa lub transfuzja wymienna. Hipoprotrombinemia powinna być leczona witaminą K, dożylnie.
W etykiecie leku znajduje się ograniczona ilość informacji dotyczących przewlekłego przedawkowania butalbitalu.
Farmakologia
W etykiecie leku znajduje się ograniczona ilość informacji dotyczących farmakologii butalbitalu.
Mechanizm działania
- Farmakologicznie, butalbital, aspiryna i kofeina łączą przeciwbólowe właściwości aspiryny z anksjolitycznymi i zwiotczającymi mięśnie właściwościami butalbitalu.
Kliniczna skuteczność butalbitalu, aspiryny i kofeiny w napięciowym bólu głowy została ustalona w podwójnie ślepych, kontrolowanych placebo, wieloklinicznych badaniach. W badaniu o konstrukcji czynnikowej porównywano butalbital, aspirynę i kofeinę z każdym z ich głównych składników. Badanie to wykazało, że każdy składnik przyczynia się do skuteczności butalbitalu, aspiryny i kofeiny w leczeniu docelowych objawów napięciowego bólu głowy (ból głowy, napięcie psychiczne i skurcz mięśni w okolicy głowy, szyi i ramion). Dla każdego objawu i zespołu objawów jako całości wykazano, że butalbital, aspiryna i kofeina mają znacząco lepsze efekty kliniczne niż którykolwiek z tych składników osobno.
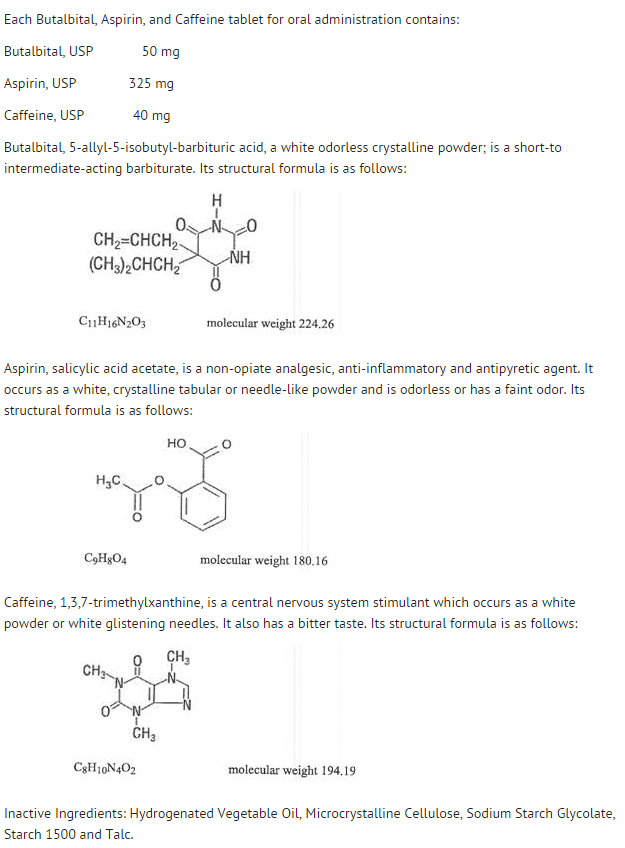
Struktura
- Zachowanie poszczególnych składników opisano poniżej.
- Dostępność ogólnoustrojowa aspiryny po podaniu doustnym w dużym stopniu zależy od postaci dawki, obecności pokarmu, czasu opróżniania żołądka, pH żołądka, środków zobojętniających, środków buforujących i wielkości cząstek. Czynniki te wpływają niekoniecznie na stopień wchłaniania całkowitego salicylanów, ale bardziej na stabilność aspiryny przed wchłonięciem.
- Podczas procesu wchłaniania i po wchłonięciu aspiryna ulega głównie hydrolizie do kwasu salicylowego i ulega dystrybucji do wszystkich tkanek i płynów ustrojowych, w tym tkanek płodu, mleka matki i ośrodkowego układu nerwowego (OUN). Najwyższe stężenia występują w osoczu, wątrobie, korze nerek, sercu i płucach. W osoczu około 50%-80% kwasu salicylowego i jego metabolitów jest luźno związanych z białkami osocza.
- Klirens całkowitych salicylanów podlega kinetyce nasycenia; jednak kinetyka eliminacji pierwszego rzędu jest nadal dobrym przybliżeniem dla dawek do 650 mg. Okres półtrwania w osoczu dla aspiryny wynosi około 12 minut, a dla kwasu salicylowego i/lub całkowitych salicylanów wynosi około 3,0 godzin.
- Eliminacja dawek terapeutycznych odbywa się przez nerki w postaci kwasu salicylowego lub innych produktów biotransformacji. Klirens nerkowy jest znacznie zwiększony przez zasadowy odczyn moczu, który jest wytwarzany przez jednoczesne podawanie wodorowęglanu sodu lub cytrynianu potasu.
- Biotransformacja aspiryny zachodzi głównie w hepatocytach. Głównymi metabolitami są kwas salicylurowy (75%), fenolowe i acylowe glukuronidy salicylanu (15%) oraz kwas gentyzynowy i gentyzylowy (1%). Biodostępność składnika aspiryny, butalbitalu, aspiryny i kofeiny jest równoważna dostępności roztworu, z wyjątkiem wolniejszego tempa wchłaniania. Szczytowe stężenie 8,80 mcg/mL uzyskano po 40 minutach od podania dawki 650 mg.
- Butalbital jest dobrze wchłaniany z przewodu pokarmowego i oczekuje się, że rozprowadzi się do większości tkanek w organizmie. Barbiturany, ogólnie rzecz biorąc, mogą pojawić się w mleku matki i łatwo przekraczają barierę łożyskową. Są one w różnym stopniu związane z białkami osocza i tkanek, a wiązanie zwiększa się bezpośrednio w funkcji rozpuszczalności lipidów.
- Eliminacja butalbitalu odbywa się głównie przez nerki (59%-88% dawki) w postaci niezmienionego leku lub metabolitów. Okres półtrwania w osoczu wynosi około 35 godzin. Produkty wydalania z moczem obejmowały lek macierzysty (około 3,6% dawki), kwas 5-izobutylo-5-(2,3-dihydroksypropylo) barbiturowy (około 24% dawki), kwas 5-allilo-5(3-hydroksy-2-metylo-1-propylo) barbiturowy (około 4,8% dawki), produkty z pierścieniem kwasu barbiturowego hydrolizowane z wydalaniem mocznika (około 14% dawki), a także materiały niezidentyfikowane. Spośród materiałów wydalanych z moczem, 32% było sprzężonych.
- Dostępność biologiczna składnika butalbitalu, aspiryny i kofeiny jest równoważna dostępności roztworu, z wyjątkiem zmniejszenia szybkości wchłaniania. Szczytowe stężenie wynoszące 2020 ng/mL uzyskuje się po około 1,5 godziny po podaniu dawki 100 mg.
- Wiązanie butalitalu z białkami osocza in vitro wynosi 45% w zakresie stężeń od 0,5 do 20 mcg/mL. Mieści się to w zakresie wiązania z białkami osocza (20% do 45%) zgłaszanym w przypadku innych barbituranów, takich jak fenobarbital, pentobarbital i sól sodowa secobarbitalu. Stosunek stężenia w osoczu do stężenia we krwi był prawie równy jedności, co wskazuje na brak preferencyjnej dystrybucji butalbitalu do osocza lub komórek krwi. (patrz OVERDOSAGE w celu uzyskania informacji dotyczących toksyczności).
- Jak większość ksantyn, kofeina jest szybko wchłaniana i dystrybuowana we wszystkich tkankach i płynach ustrojowych, w tym w OUN, tkankach płodu i mleku matki.
- Kofeina jest szybko usuwana poprzez metabolizm i wydalanie z moczem. Okres półtrwania w osoczu wynosi około 3,0 godzin. W wyniku biotransformacji w wątrobie przed wydaleniem powstają mniej więcej równe ilości 1-metyloksantyny i kwasu 1-metylurowego. Z 70% dawki, która została odzyskana w moczu, tylko 3% stanowiło niezmieniony lek.
- Dostępność biologiczna składnika kofeiny dla butalbitalu, aspiryny i kofeiny jest równoważna dostępności roztworu, z wyjątkiem nieco dłuższego czasu do osiągnięcia szczytu. Stężenie szczytowe 1660 ng/mL uzyskano w czasie krótszym niż godzina dla dawki 80 mg
- Butalbital, Aspirin, and Caffeine Tablets, USP 50 mg/325 mg/40 mg to białe, okrągłe, niegumowane tabletki prasowane z nadrukiem „West-ward 785”.
- Przechowywać w temperaturze 20-25oC (68-77oF). Chronić przed światłem i wilgocią.
- Podawać w szczelnym, odpornym na światło pojemniku określonym w USP z zamknięciem zabezpieczającym przed dostępem dzieci.
- Nie ustalono interakcji między alkoholem a Butalbitalem. Należy porozmawiać z lekarzem o skutkach przyjmowania alkoholu z tym lekiem.
Farmakodynamika
W etykiecie leku znajduje się ograniczona ilość informacji dotyczących farmakodynamiki produktu Butalbital.
Farmakokinetyka
Aspiryna:
Butalbital:
Kofeina:
Toksykologia niekliniczna
Na etykiecie leku znajduje się ograniczona ilość informacji dotyczących nieklinicznej toksykologii butalbitalu.
Badania kliniczne
Na etykiecie leku znajduje się ograniczona ilość informacji dotyczących badań klinicznych butalbitalu.
Jak dostarczać
Butelki po 30 tabletekButelki po 50 tabletekButelki po 100 tabletekButelki po 500 tabletekButelki po 1000 tabletekPudełka po 100 tabletek
Przechowywanie
W etykiecie leku znajduje się ograniczona ilość informacji dotyczących przechowywania butalbitalu.
Obrazy
Obrazy leku
Nazwa leku: Butalbital, Acetaminophen and Caffeine
Ingredient(s): BUTALBITAL, ACETAMINOPHEN, CAFFEINE
Imprint: West;ward;787
Dawkowanie: 50 mg
Kolor(y): Blue
Kształt: Round
Size (mm): 11
Score: 1
NDC:01431787
Drug Label Author: West-Ward Pharmaceutical Corp
Ten obraz pigułki został dostarczony przez National Library of Medicine’s PillBox.

Nazwa leku: Butalbital, Aspirin and Caffeine
Ingredient(s): BUTALBITAL, ASPIRYNA, KOFEINA
Imprint: Westward;785
Dawkowanie: 50 mg
Kolor(y): White
Shape: Round
Size (mm): 11
Score: 1
NDC:01431785
Drug Label Author: West-ward Pharmaceutical Corp
Ten obraz pigułki został dostarczony przez National Library of Medicine’s PillBox.

Nazwa leku: Butalbital, Aspirin, and Caffeine
Ingredient(s): BUTALBITAL, ASPIRYNA, KOFEINA
Imprint: WATSON;3219
Dosage: 50 mg
Kolor(y): Zielony, Żółty
Kształt: Kapsułka
Wymiary (mm): 22
Punktacja: 1
NDC:05913219
Autor etykiety leku: Watson Laboratories, Inc.
Ten obraz pigułki został dostarczony przez National Library of Medicine’s PillBox.
Nazwa leku: Butalbital, Aspiryna i Kofeina Tabletki
Składnik(i): ASPIRYNA, BUTALBITAL, KOFEINA
Imprint: West;ward;785
Dawkowanie: 50 mg
Kolor(y): White
Shape: Round
Size (mm): 7
Score: 1
NDC:06032548
Drug Label Author: Qualitest
Ten obraz pigułki jest dostarczany przez National Library of Medicine’s PillBox.
Package and Label Display Panel
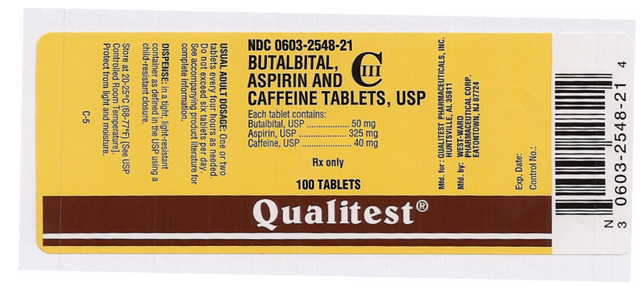
Ten obraz etykiety FDA jest dostarczany przez National Library of Medicine.

Ten obraz etykiety FDA jest dostarczany przez National Library of Medicine.
Informacje dla pacjenta
W etykiecie leku znajduje się ograniczona ilość informacji dotyczących informacji dla pacjenta dotyczących leku Butalbital.
Środki ostrożności związane z alkoholem
Nazwy handlowe
Na etykiecie leku znajduje się ograniczona ilość informacji dotyczących Butalbitalu.
Nazwy podobne do leku
Na etykiecie leku znajduje się ograniczona ilość informacji dotyczących Butalbitalu.
Stan niedoboru leku
.