Co to jest kobalt
Kobalt (wymowa: KO-bolt) jest twardym, lśniącym srebrzysto-niebieskim pierwiastkiem należącym do grupy metali przejściowych i jest reprezentowany przez symbol chemiczny Co . Jest chemicznie aktywny i może tworzyć wiele związków . Jest to metal ferromagnetyczny, który może być namagnesowany i jest stopiony z niklem i aluminium do produkcji silnych magnesów .

Kobalt Symbol
Izotopy
Ma jeden stabilny, naturalnie występujący izotop, 59Co i 28 radioizotopów, z których najbardziej stabilne są 60Co, 57Co, 56Co i 58Co z okresami połowicznego zaniku wynoszącymi odpowiednio 5,2714 lat, 271,8 dni, 77,27 dni i 70,86 dni . Okresy półtrwania jego innych radioizotopów są krótsze niż 18 godzin.
Gdzie znajduje się kobalt
Kobalt występuje naturalnie w połączeniu z innymi pierwiastkami w rudach mineralnych, takich jak kobaltyt (siarczek zawierający kobalt, arsen, żelazo i nikiel), erytryt (uwodniony arsenian kobaltu) i skutterudyt (arsenian kobaltu). Jest on zazwyczaj uzyskiwany jako produkt uboczny górnictwa miedzi i niklu .
Guzki manganowe znalezione na dnach oceanów są ogromne rezerwy metali przejściowych, zawierające tony kobaltu . Top 3 kobalt rezerwy kraje posiadające są Demokratyczna Republika Konga (DRK), Australia, i Kuba, podczas gdy top 3 producentów obejmują DRK, Chiny i Zambia .

Kobalt
Historia
Origin of its Name: Nazwa pochodzi od „kobald”, niemieckiego oznaczającego „goblina” oraz od „cobalos”, greckiego słowa oznaczającego „kopalnię” .
Kto go odkrył: Pierwiastek został znaleziony przez szwedzkiego chemika i mineraloga Georga Brandta .
Kiedy i jak został odkryty
Grobowiec Tutanchamona, starożytnego egipskiego faraona, który rządził w latach 1361-1352 p.n.e., miał głęboko niebieski szklany obiekt, który był wykonany z kobaltu . W Chinach, niebieski kobalt był używany do produkcji glazury ceramiki .
Oprócz starożytnego pochodzenia, jego odkrycie w ostatnich czasach sięga 1730 roku, kiedy Georg Brandt był zainteresowany w niebieskiej rudy z niektórych lokalnych kopalń . W końcu udało mu się udowodnić, że niebieska ruda zawiera nowy metal. Opisał jego właściwości i opublikował wyniki w 1739 roku .
Jego odkrycie było kontrowersyjne, jak inni chemicy kwestionowali jego ustalenia przez wiele lat . Jednak jego kolega szwedzki chemik Torbern Bergman przeprowadził dalsze badania i potwierdził odkrycie Georga Brandta w 1780 roku.
Identyfikacja kobaltu |
|||
| Liczba atomowa | 27 | ||
| Liczba CAS | 7440-48-.4 | ||
| Pozycja w układzie okresowym | Grupa | Okres | Blok |
| 9 | 4 | d | |
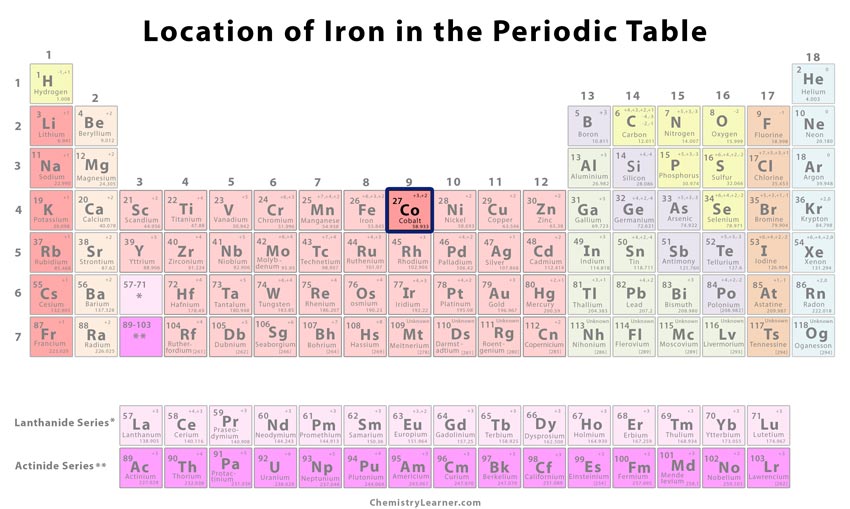
Gdzie is Cobalt Located on the Periodic Table
Properties and Characteristics of Cobalt
General Properties |
||||||||||||||||
| Relative atomic mass | 58.933 | |||||||||||||||
| Masa atomowa | 58.933 amu | |||||||||||||||
| Masa molowa | 58.9331950 ± 0.0000050 g/mol | |||||||||||||||
| Masa cząsteczkowa | 58.933 g/mol | |||||||||||||||
Właściwości fizyczne |
||||||||||||||||
| Kolor | Srebrzysto-niebieski, niebieskawo-biały | |||||||||||||||
| Punkt topnienia/krzepnięcia | 1495 °C, 2723 °F | |||||||||||||||
| Temperatura wrzenia | 2927 °C, 5301 °F | |||||||||||||||
| Gęstość | 8.86 g cm-3 | |||||||||||||||
| Stan skupienia materii w temperaturze pokojowej (ciało stałe/ciecz/gaz) | Ciało stałe | |||||||||||||||
| Twardość | ||||||||||||||||
| – Brinella | 700 MPa | |||||||||||||||
| – Mohsa | 5 | |||||||||||||||
| – Vickersa | 1043 MPa | |||||||||||||||
| Przewodność elektryczna | 1.7 X 107 S/m | |||||||||||||||
| Ładunek jonowy | 3+ | |||||||||||||||
| Przewodnictwo cieplne (ciepła) | 100 W/(m K) | |||||||||||||||
| Ciepło właściwe | 421 J kg-1 K-.1 | |||||||||||||||
| Moduł sprężystości | Nieznany | |||||||||||||||
| Moduł ścinania | Nieznany | |||||||||||||||
| Moduł Younga | Nieznany | |||||||||||||||
| Ciśnienie pary | ||||||||||||||||
| – Temperatura (K) | 400 | 600 | 800 | 1000 | 1200 | 1400 | 1600 | 1800 | 2000 | 2200 | 2400 | |||||
| – Ciśnienie (Pa) | – | – | – | 2.09 X 10-10 | 1.00 X 10-6 | 4.19 X 10-4 | 0.0379 | 1.15 | 16 | – | – | |||||
Właściwości chemiczne |
||||||||||||||||
| Stany utlenienia | 3, 2, 0, -1 | |||||||||||||||
| Izotopy | Izotop | Masa | Abundance (%) | Półokres życia | Tryb rozpadu | |||||||||||
| 59Co | 58.933 | 100 | – | – | ||||||||||||
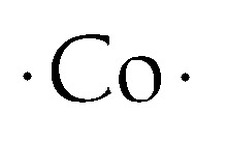
Struktura kobaltu Lewis Dot
Dane atomowe kobaltu (pierwiastek 27)
| Elektrony walencyjne | 9 | |||||||
| Liczby kwantowe | ||||||||
| – n | 3 | |||||||
| – ℓ | 2 | |||||||
| – mℓ | -.1 | |||||||
| – ms | -.1/2 | |||||||
| Konfiguracja elektronowa (konfiguracja gazu szlachetnego) | 3d74s2 | |||||||
| Struktura atomu | ||||||||
| – Liczba elektronów | 27 | |||||||
| – Liczba neutronów | 32 | |||||||
| – Liczba protonów | 27 | |||||||
| Radius of Atom | ||||||||
| – Atomic radius | 2.00 Å | |||||||
| – Promień kowalencyjny | 1.18 Å | |||||||
| Elektronegatywność (skala Paulinga) | 1.88 | |||||||
| Przyporządkowanie elektronów | 63.873 kJ mol-1 | |||||||
| Energia jonizacji (kJ mol-.1) | 1st | 2nd | 3rd | 4th | 5th | 6th | 7th | 8th |
| 760.402 | 1648.356 | 3232.3 | 4949.7 | 7670.6 | 9842 | 12437 | 15225.4 | |
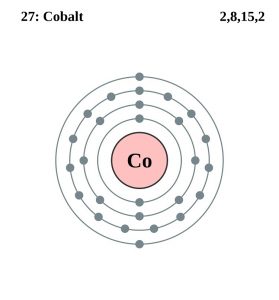
Konfiguracja elektronowa kobaltu (model Bohra)
Do czego wykorzystywany jest kobalt
- Kobalt jest stopem wykorzystywanym w turbogeneratorach gazowych i turbinach odrzutowych ze względu na jego wytrzymałość w wysokich temperaturach i odporność na korozję.
- Kobalt jest okazjonalnie stosowany w galwanizacji ze względu na jego twardość i atrakcyjny wygląd.
- Jest powszechnie stosowany jako materiał katodowy w bateriach litowo-jonowych.
- Sole kobaltu są używane do nadawania intensywnych niebieskich kolorów w szkle, porcelanie, ceramice, emaliach i farbach.
- Radioaktywny 60Co jest stosowany w leczeniu raka oraz w napromieniowywaniu żywności w celu zwalczania patogenów i przedłużania trwałości.
- Stellite superstopy, składające się z chromu, kobaltu i wolframu, są wykorzystywane do tworzenia wysokiej temperatury i wysokiej odporności na zużycie narzędzi skrawających.
Toksyczność kobaltu i skutki zdrowotne
Zatrucie kobaltem może nastąpić, gdy przypadkowo połknąć, oddychać lub mieć go w kontakcie ze skórą w dużych ilościach. W dużych ilościach, kobalt może być rakotwórcze u ludzi i niektórych zwierząt .
Znajduje się w ilościach śladowych u ludzi i jest niezbędnym składnikiem witaminy B12 . Małe dawki kobaltu są również podawane niektórym zwierzętom w celu zapobiegania niedoborom minerałów w nich .

Minerał kobaltu (kobaltyt)
Interesting Facts
- Kobalt jest graficznie reprezentowany przez „kobolda” lub goblina (uważanego za kłopotliwego przez średniowiecznych niemieckich górników) z chińską porcelaną w tle, odnosząc się do jego zastosowania jako glazury w starożytnych Chinach.
- Kobalt może zachować swoje właściwości magnetyczne do temperatury (punkt Curie) 1,121 ° C (2049.8 °F), najwyższa ze wszystkich pierwiastków ferromagnetycznych .
- W 2010 roku, niemieccy naukowcy używali atomu kobaltu do uchwycenia pierwszych zdjęć zmiany spinu .
Cena kobaltu
Koszt czystego kobaltu wynosi około $0,21 za gram, a luzem, to kosztuje około $0.044 za gram .
- http://www.rsc.org/periodic-table/element/27/cobalt
- https://education.jlab.org/itselemental/ele027.html
- https://www.livescience.com/29275-cobalt.html
- https://www.chemicool.com/elements/cobalt.html
- https://education.jlab.org/itselemental/iso027.html
- https://www.webqc.org/molecular-weight-of-Co%28cobalt%29.html
- https://pubchem.ncbi.nlm.nih.gov/compound/cobalt#section=Top
- http://periodictable.com/Elements/027/data.html
- http://www.gpb.org/files/pdfs/gpbclassroom/chemistry/ionicChargesChart.pdf
- http://dwb4.unl.edu/Chem/CHEM869B/CHEM869BLinks/learn.chem.vt.edu/tutorials/bonding/valence.html
- http://chemistry-reference.com/q_elements.asp?Symbol=Co&language=en
- https://medlineplus.gov/ency/article/002495.htm