W przestrzeni międzypalcowej spojówki często pojawiają się nieregularne zmiany tkankowe, które w większości przypadków są minimalnie patologiczne lub nie są patologiczne w ogóle. Miejsce to jest narażone na działanie promieniowania ultrafioletowego (UV) i czynników drażniących z atmosfery oraz jest podatne na wysuszenie; dlatego zmiany takie jak pingueculae i pterygia są powszechnie spotykanymi nieprawidłowościami powierzchni oka i na ogół nie zwracają uwagi podczas badania.
Płytkowa choroba nowotworowa, jednakże, jest spotykana sporadycznie. Inwazyjny rak płaskonabłonkowy spojówki jest często histologicznie poprzedzony śródnabłonkowym nowotworem spojówki (conjunctival intraepithelial neoplasm, CIN), który stanowi najczęściej spotykany rozrost nowotworowy spojówki. Zmiany te – często błędnie diagnozowane jako bardziej typowe rozrosty powierzchni oka – są wolno postępujące, miejscowo inwazyjne i nie mają potencjału przerzutowego. Jednakże, mogą one sporadycznie powodować znaczne miejscowe uszkodzenia powierzchni oka i mogą ulec progresji do bardziej inwazyjnego raka kolczystokomórkowego. Zarówno diagnostyka, jak i leczenie CIN może stanowić wyzwanie. Niniejszy artykuł oferuje spostrzeżenia dla lekarzy POZ, którzy mogą nie spotykać się zbyt często z CIN, a chcieliby uzyskać przegląd kliniczny.
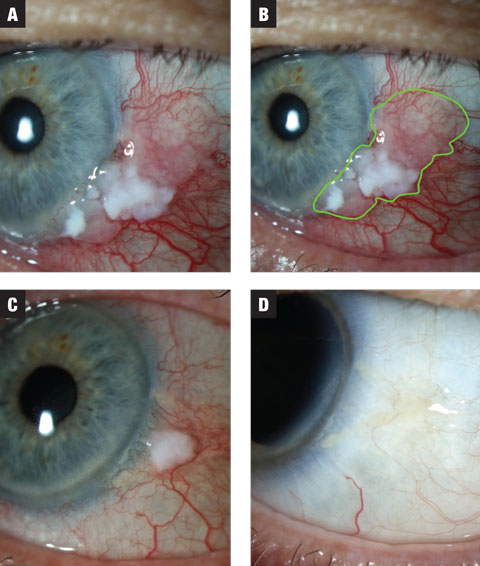
Ryc. 1a. W przypadku 1 zmiana ma zarówno strefę leukoplakii, jak i żelatyny. Leczenie rozpoczęto od MMC 0,02% QID. Ryc. 1b. Podkreślony szacunkowy zasięg zmiany. Ryc. 1c. Po pierwszym trzytygodniowym kursie, zmiana wykazuje radykalne zmniejszenie rozmiaru. Pacjentkę poddano dwutygodniowemu okresowi wypłukiwania i poinstruowano, że powinna spodziewać się drugiego kursu MMC. Ryc. 1d. Zmiana wykazała całkowite ustąpienie po wypłukaniu. Kliknij obraz, aby powiększyć.
Rozwój CIN
Geneza populacji nabłonkowych komórek nowotworowych, czyli raka, wymaga serii zmian w zachowaniu komórek. Komórki, które wykazują tę dysplazję pokazują zdezorganizowany wzrost i dojrzewanie, co skutkuje nadmiarem niedojrzałych komórek, który jest kontrastowany przez równoczesny względny niedobór dojrzałych komórek tej linii. Podczas gdy dysplazja jest procesem odwracalnym, komórki dysplastyczne mogą następnie ulegać dalszym mutacjom, skutkującym transformacją nowotworową, w wyniku której komórki stają się niewrażliwe na inhibitory wzrostu oraz stają się inwazyjne.
Raki nowotworowe mogą być lokalnie ograniczone przez błonę podstawną – określane jako carcinoma in situ – lub mogą być inwazyjne, charakteryzujące się tym, że zmiana przebija się przez odpowiednią błonę podstawną i rozprzestrzenia się lokalnie. Ten sposób oceny nie odnosi się jednak do dwóch odrębnych jednostek; carcinoma in situ stanowi raczej wstępny etap na tym samym kontinuum nowotworzenia. Jeśli zostanie pozostawiony sam sobie, rak in situ może ostatecznie stać się inwazyjny.
Choć możliwe jest, aby rak płaskonabłonkowy pominął etap CIN, jest on często punktem środkowym w etiologii choroby. CIN jest nieprawidłową linią komórek nabłonka spojówki (i ewentualnie rogówki) i reprezentuje albo prostą dysplazję (częściowa grubość tkanki nabłonkowej) albo raka in situ, gdy zmiana jest pełnej grubości.1-4 CIN jest częścią spektrum zaburzeń nowotworowych spojówki i rogówki, znanych wspólnie jako oczna neoplazja płaskonabłonkowa powierzchni oka (OSSN). Jeśli CIN staje się inwazyjny poprzez przebicie błony podstawnej, jest klasyfikowany jako inwazyjny rak płaskonabłonkowy (squamous cell carcinoma, SCC).
CIN, choć rzadki, jest najczęściej spotykanym nowotworem spojówki w Stanach Zjednoczonych.4 Czynnikami ryzyka rozwoju CIN i wszystkich form OSSN są: ekspozycja na promieniowanie UV (zwłaszcza UV-B), płeć męska, ekspozycja na produkty naftowe, intensywne palenie tytoniu, ludzki wirus niedoboru odporności (HIV) i wirus brodawczaka ludzkiego (HPV) typu 16, choć to ostatnie ryzyko pozostaje kontrowersyjne.1,3-5 Rokowanie w przypadku CIN jest zwykle dobre, z wyjątkiem przypadków, gdy rozrost jest wyjątkowo duży. Gdy zmiana przełamie błonę podstawną i stanie się inwazyjna, rokowanie jest gorsze i często wymaga agresywnego leczenia, takiego jak enukleacja lub eksteneracja. Nawet w tych przypadkach ryzyko wystąpienia przerzutów odległych jest niskie.
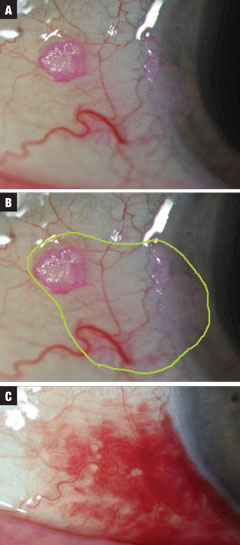
Ryc. 2a-c (od góry do dołu). Przypadek 2 dotyczył małej podejrzanej zmiany CIN wykrytej przypadkowo podczas badania. Leczenie rozpoczęto od podawania INF-a2b QID do czasu opróżnienia butelki 10 ml. Szacowany całkowity zakres marginesów nowotworowych jest zaznaczony na zielono. W końcu zaobserwowano rozwiązanie, z jednoczesnym SCH związanym z valsalvą (nie wywołanym lekami). Leczenie wymagało jednego miesiąca przy jednym milionie IU QID, a następnie 10 dni QID przy trzech milionach IU INF-a2b. Kliknij obraz, aby powiększyć.
Prezentacja kliniczna
Wygląd kliniczny CIN to nieprawidłowa, lekko uniesiona, mięsista masa, typowo zlokalizowana w strefie międzypalcowej limbal (95% wszystkich zmian).6 Predylekcja do tego obszaru jest prawdopodobnie spowodowana jego cechami. Ekspozycja na promieniowanie UV-B jest największa w strefie międzypalcowej, a strefa komórek macierzystych limbki jest przestrzenią przejściową pomiędzy nabłonkiem rogówki i spojówki. Ta strefa przejściowa prawdopodobnie wiąże się ze szczególnym ryzykiem dla tkanki w zakresie dysplazji.
Zmiany spojówkowe mogą być galaretowate, brodawkowate lub, rzadziej, leukoplakiczne, które powstają w wyniku hiperkeratozy. Zmiany te są zwykle dobrze odgraniczone i wykazują pewien stopień unaczynienia.3,7,8 Dziewięćdziesiąt pięć procent przypadków obejmuje limbus.6 Manifestacje rogówkowe wykazują podobne wybielenie i mogą wykazywać szare, fimbriowane (tj. przypominające palce) projekcje nabłonkowe z limbusu. Klasycznie, zmiany wykazują dodatnie zabarwienie lub prążkowanie różem bengalskim, co może być przydatne w klinicznym różnicowaniu CIN od innych zmian spojówki.8,9
Pomimo stosunkowo wyraźnych wyników na papierze, zmiany CIN i SCC mogą być trudne do odróżnienia od bardziej normalnych rozrostów spojówki, takich jak pingueculae, pterygia i znamiona. Może to prowadzić do błędnej diagnozy nawet w 60% przypadków, nawet w przypadku oceny przez doświadczonych klinicystów, co czyni biopsję z oceną histologiczną potencjalnie wartościową.3
Badania diagnostyczne
Historycznie, badania obejmowały biopsję wycięcia wykonywaną w czasie usuwania chirurgicznego. Jednak obecnie lekarze stosują chemioterapię jako podstawową metodę leczenia, co może ograniczać dostęp do biopsji.
Najnowszym narzędziem diagnostycznym jest cytologia wyciskowa, którą wykonuje się przez nałożenie bibuły filtracyjnej na zmianę, usunięcie powierzchownego nabłonka i umożliwienie minimalnie inwazyjnych badań histologicznych. Czułość tej metody wynosi około 80%, choć jej słabą stroną pozostają fałszywe ujemne wyniki, ponieważ bibuła zbierająca może zostać zablokowana przez nadmierne rogowacenie zmiany; ponowne próby są na ogół bardziej skuteczne.8 W jednym z badań wykazano, że OCT o ultrawysokiej rozdzielczości, choć obecnie niedostępne, jest bardzo czułe w różnicowaniu OSSN i pterygium na podstawie grubości nabłonka zmiany.10
Leczenie
Tradycyjne leczenie CIN polega na wycięciu z marginesem 1 mm do 5 mm, w zależności od rozległości i historii zmian pierwotnych i nawrotowych. Zajęta rogówka jest oczyszczana za pomocą ostrza chirurgicznego, a podłoże i brzegi spojówki poddawane są krioterapii. Twardówka pozostaje odsłonięta. Takie postępowanie jest zwykle skuteczne, ale nawroty są zgłaszane w zakresie od 10% do 52%, w zależności od odsetka czystych marginesów chirurgicznych określonych w pooperacyjnym badaniu histologicznym.6-11 Odsetek ten spada do 5%, jeśli uzyskuje się czyste marginesy; niestety, badania wykazują, że trudno jest zagwarantować czyste marginesy.8,9 Liczby te zdają się przemawiać za stosowaniem jak najszerszych marginesów, jednak istnieją konsekwencje rozległego wycięcia spojówki: zmiany bliznowate, niedobór komórek macierzystych limb, topnienie twardówki, znaczne zaburzenia filmu łzowego i nieregularne zmiany astygmatyzmu rogówki.
Opcje leczenia miejscowego
Ostatnio w leczeniu CIN popularne stały się chemioterapeutyki stosowane miejscowo, ponieważ mają one tę zaletę, że leczą całą powierzchnię oka, a przy rozsądnym stosowaniu wydają się być dobrze tolerowane.
Mitomycyna. Odkryte w latach 50-tych XX wieku mitomycyny są produktami ubocznymi fermentacji Streptomyces caespitosus. Mitomycyna-C (MMC), ostatnia z tych odkrytych cząsteczek, jest antymetabolitem stosowanym poza okulistyką jako środek do chemioterapii przeciwnowotworowej.12,13 MMC działa jako środek alkilujący, który zapobiega rozszczepianiu DNA podczas mitozy komórkowej, co jest zmianą niezwykle toksyczną.1 Nawet jedno z tych wiązań krzyżowych może być śmiertelne dla komórki.13 Ponadto MMC może generować reaktywne formy tlenu i zwiększać syntezę czynnika martwicy nowotworów (TNF).
Ponieważ MMC jest szczególnie silnym, potencjalnie niebezpiecznym lekiem, jego działania niepożądane – na przykład niedobór komórek macierzystych rogówki i stopienie twardówki – mogą być poważne. Częściej spotykane działania niepożądane, takie jak epitelopatia rogówki i spojówki oraz iniekcja spojówki, są przemijające.4,14 Podczas stosowania MMC wymagana jest staranna obserwacja i zaprzestanie podawania leku w przypadku podejrzenia jakiegokolwiek istotnego działania niepożądanego.
5-Fluorouracil (5-FU). Jest to kolejny antymetabolit stosowany w leczeniu nowotworów dermatologicznych, a także przez chirurgów zajmujących się jaskrą. Jego mechanizm działania polega na blokowaniu syntezy DNA poprzez ingerencję w enzym syntazę tymidylanową. W leczeniu OSSN 5-FU jest zwykle podawany w stężeniu 1% QID jeden miesiąc na dobę, jeden miesiąc na dobę, aż do ustąpienia objawów. Większość przypadków ustępuje po jednym lub dwóch cyklach, choć niektóre trwają nawet pięć. Toksyczność nabłonka, powodująca erozję lub złuszczanie, jest powszechna. W jednym z badań czas trwania leczenia ustalono jako czas do wystąpienia złuszczania, a czas wolny od leczenia trwał do momentu ponownej epitelializacji. Pomimo tego bolesnego powikłania, działania niepożądane 5-FU nie wydają się być tak poważne jak MMC, a wskaźniki nawrotów są na ogół podawane jako równoważne.4,14
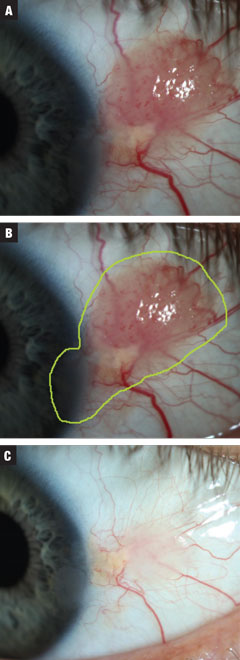
Ryc. 3a. Przypadek 3 obejmował umiarkowanej wielkości przypuszczalny CIN brodawczakowaty. U chorego rozpoczęto leczenie INF-a2b w dawce 3 mln j.m. przez 10 dni. Ryc. 3b. Szacunkowa całkowita wielkość zmiany. Ryc. 3c. Po leczeniu. Prawie całkowite ustąpienie wzrostu z utrzymującym się nieregularnym nabłonkiem rogówki. Wbrew zaleceniom pacjentka zdecydowała się na obserwację w tym czasie. Kliknij obraz aby powiększyć.
Interferon alfa 2b (INF-a2b). Interferony należą do podgrupy naturalnie występujących białek zapalnych zwanych cytokinami. Są one produkowane przez aktywowane komórki odpornościowe i mają zmienne działanie przeciwnowotworowe, przeciwwirusowe i przeciwbakteryjne. Pierwsze doniesienie o zastosowaniu INF-a2b w 1994 r. dotyczyło skutecznego usunięcia zmiany CIN przy zastosowaniu miejscowym.5 Od tego czasu INF-a2b jest stosowany zarówno miejscowo, jak i podspojówkowo, z dobrym skutkiem, w leczeniu OSSN.
Dawkowanie miejscowe charakteryzuje się największą skutecznością, z 87% do 100% ustąpieniem objawów w ciągu pięciu tygodni (przy wstrzyknięciach podawanych do trzech razy w tygodniu).4,14,15 Do uzyskania takiego poziomu skuteczności konieczne są wielokrotne wstrzyknięcia, co powoduje, że nawet u 100% pacjentów występują ogólnoustrojowe mialgie i gorączka.5,14 Dawkowanie miejscowe jest w przybliżeniu równoważne MMC pod względem skuteczności.14,15 Podaje się go w stężeniu miliona jednostek międzynarodowych (j.m.) na milimetr i dawkuje QID przez jeden miesiąc, aż do ustąpienia objawów klinicznych. W przypadku braku ustąpienia objawów klinicznych stężenie można zwiększyć do 3 mln j.m., również QID. Na ogół, niezależnie od stężenia leczniczego, apteki wytwarzające preparaty złożone przygotują butelkę z pojedynczego preparatu o stężeniu jednego miliona j.m. Ten preparat o stężeniu miliona j.m. może być jeszcze bardziej skoncentrowany przez zmniejszenie ilości nośnika w butelce. Efekty uboczne miejscowego INF-a2b są łagodne, z często zgłaszanym przekrwieniem i pęcherzykowym zapaleniem spojówek; zapalenie rogówki zgłaszane jest rzadziej.4
Miejscowe vs. chirurgia
Chociaż biopsja i chirurgiczne wycięcie były historycznym leczeniem z wyboru, miejscowe chemioterapeutyki, które mają pewne teoretyczne korzyści w porównaniu z chirurgią, zyskały pewną akceptację jako terapia pierwszej linii. W przypadku chirurgii niemożliwe jest zagwarantowanie wyraźnych marginesów – cechy wymaganej dla uzyskania najlepszego rokowania. Im większa ilość tkanki jest usuwana w celu zapewnienia wyraźnych marginesów, tym większe jest prawdopodobieństwo długotrwałego uszkodzenia powierzchni oka. Środki miejscowe leczą całą powierzchnię oka, eliminując potrzebę określania marginesów i umożliwiając skuteczne leczenie populacji komórek nowotworowych, które nie mogłyby być wyraźnie zidentyfikowane w analizie mikroskopowej – korzyść, która może prowadzić do połączenia środków miejscowych z chirurgicznym wycięciem jako protokołu leczenia całkowitego w przypadku dużych zmian. Wadą terapii miejscowej jest oczywiście to, że ponieważ cała powierzchnia oka jest narażona na działanie leku – technicznie rzecz biorąc jest to nadmierne leczenie – może dojść do powikłań, a w przypadku MMC w szczególności, powikłania te, choć rzadkie, mogą być poważne.
Jeśli chodzi o skuteczność, wszystkie środki do miejscowej chemioterapii stosowane w leczeniu OSSN mają dość dobre wyniki. INF-a2b przeszedł badania skuteczności w porównaniu z resekcją chirurgiczną i wykazano, że eliminuje zmianę z porównywalną częstością, a częstość nawrotów może być nawet niższa w przypadku INF-a2b w porównaniu z resekcją.4 Badania kontrolne wykazują, że jego stosowanie jest bardziej wskazane w przypadku prostych lub małych zmian, natomiast chirurgia jest preferowana w przypadku bardziej zaawansowanych zmian, chociaż terapia miejscowa może być lepsza w przypadku zmian nawracających.4,15
MMC ma ogólnie najkrótszy przebieg leczenia, ale jest najbardziej toksyczny i niesie ze sobą największe ryzyko powikłań. 5-FU charakteryzuje się średnim profilem działań niepożądanych i czasem trwania leczenia; jest również najmniej kosztowna z tej grupy. INF-a2b charakteryzuje się lepszą tolerancją, ale często wiąże się z dłuższym leczeniem i większymi kosztami.4,13-16
Koszty z pewnością mogą być brane pod uwagę przy podejmowaniu decyzji o zastosowaniu miejscowych chemioterapeutyków. Firmy ubezpieczeniowe czasami odmawiają pokrycia kosztów tych leków, zgłaszając ich stosowanie jako eksperymentalne. W krótkich kursach leczenia i porównując tylko całkowite wydatki na opiekę zdrowotną, miejscowe chemioterapeutyki są mniej kosztowne niż chirurgia; mogą jednak przewyższać wydatki na chirurgię po kilku kursach.
Pomijając tę ewentualną przeszkodę, biorąc pod uwagę skuteczność, możliwość uniknięcia zabiegu chirurgicznego i ogólną tolerancję, przy monitorowanym stosowaniu miejscowe chemioterapeutyki wydają się być dobrą opcją w leczeniu zmian nowotworowych wewnątrznabłonka spojówki.
Dr Bronner jest optometrystą z Pacific Cataract and Laser Institute w Kennewick, Wash.
1. Kiire CA, Dhillon B. The etiology and associations of conjunctival intraepithelial neoplasia. Br J Ophthalmol. 2006:90(1);109-13.
2. Birkholz ES et al. Treatment of ocular surface squamous cell intraepithelial neoplasia with and without mitomycin C. Cornea. 2011;30:37-41.
3. Lee GA, Hirst LW. Ocular surface squamous neoplasia. Survey of Ophthalmology. 1995; 39:429-50.
4. Nelson KD, McSoley JJ. Clinical findings and management of conjunctival intraepithelial neoplasia. Optometry. 2011; 82:15-21.
5. Nanji AA, Sayyad FE, Karp CL. Topical chemotherapy for ocular surface squamous neoplasia. Current Opinion in Ophthalmology. 2013; 24:336-42.
6. Warner M, Jakobiec F. Squamous Neoplasms of the Conjunctiva. In: Krachmer JH, Mannis MJ, Holland EJ eds. Cornea. 2nd ed. St Louis: Mosby; 2004:557-70.
7. Rapuono CJ, Luchs JI, Kim T. Conjunctival and External Disease. Anterior Segment: the requisites. Ed. Krachmer, JH. Mosby. 2000;33-6.
8. Huerva V and Ascaso FJ. Conjunctival Intraepithelial Neoplasia – Clinical Presentation, Diagnosis and Treatment Possibilities. Srivstava S (Ed.) ISBN: 978-953-307-987-5, InTech.
9. Nelson KD, McSoley JJ. Clinical findings and management of conjunctival intraepithelial Neoplasia. Optometry. 2011;82:15-21.
10. Kieval JZ1, Karp CL, Abou Shousha M, et al. Ultra-high resolution optical coherence tomography for differentiation of ocular surface squamous neoplasia and pterigia. Invest Ophthalmol and Vis Sci. 2011; 52:1741.
11. Peksayar G, Soyturk MK, Demiryont M: Longterm results of cryotherapy on malignant epithelial tumors of the conjunctiva. Amer J of Ophthalmol. 1989;107: 337.
12. Santhiago MR, Netto MV, Wilson SE. Mitomycin C: Efekty biologiczne i zastosowanie w chirurgii refrakcyjnej. Cornea. 2012; 31:311-21.
13. Tomaz M. Mitomycyna C: mała, szybka i zabójcza (ale bardzo selektywna). Chem and Biol. 1995; 2:575-9.
14. Majmudar PA, Epstein RJ. Antimetabolites in ocular surface neoplasia. Curr Opin in Ophthalmol. 1998; 9:35-9.
15. Besley J, Pappalardo J, Lee GA. Risk factors of ocular surface squamous neoplasia recurrence after treatment with topical mitomycin C and interferon alpha 2b. Amer J of Ophthalmol 2014; 157:287-93.
16. Boehm M i Huang AJW. Treatment of recurrent corneal and conjunctival intraepithelial neoplasia with topical interferon alpha-2b. Ophthalmol. 2004; 111:1755-61.