Introduction
Meningiomas are the most common primary central nervous system (CNS) neoplasm and account for over 37% of all primary brain tumors (1). Opcje leczenia oponiaków obejmują obserwację, operację i radioterapię (2, 3). Podczas gdy mniejszość oponiaków jest agresywna, w tym w stopniu II i III według Światowej Organizacji Zdrowia (WHO), ponad 80% to oponiaki w stopniu I według WHO, często określane jako „łagodne” (4). Jednak nawet oponiaki w stopniu I wg WHO mogą nawracać, a dotychczasowe badania wskazują na odsetek nawrotów sięgający 47% w obserwacji długoterminowej (4, 5). Nawrót oponiaka często wymaga leczenia dodatkową operacją lub radioterapią, co wiąże się z potencjalną chorobowością (6, 7). W związku z tym zdolność przewidywania nawrotu jest kluczowym elementem postępowania w oponiaku w stopniu I wg WHO, pozwalającym na sformułowanie zaleceń dotyczących częstości wykonywania kontrolnych badań obrazowych lub zastosowania radioterapii adiuwantowej.
Poza stopniem Simpsona uzyskanym podczas resekcji oceniano szereg cech guza jako możliwe predyktory nawrotu, ze szczególnym uwzględnieniem wyników badań histopatologicznych (8). Obejmują one indeks MIB-1 (marker proliferacji komórek), inwazję mózgu i obecność nietypowych cech histologicznych, w tym zwiększoną komórkowość, blaszkowatość, ogniska spontanicznej martwicy i atypię jądrową (9-13). W klasyfikacji WHO z 2016 roku do określenia stopnia zaawansowania nowotworu wykorzystuje się wyłącznie wyniki badań patologicznych, przy czym stopień II definiuje się na podstawie inwazji na mózg i zwiększonej liczby mitoz powyżej 4/10 w polu wysokiej mocy (HPF) (4). Ponadto, trzy cechy atypowe razem powodują zwiększenie stopnia zaawansowania guza (4). Patrząc w przyszłość, cechy molekularne oponiaka zostały ostatnio powiązane z ryzykiem nawrotu i prawdopodobnie będą wykorzystywane w klasyfikacji oponiaków w przyszłości (14-16).
Podczas gdy klasyfikacje WHO syntetyzują dostępną literaturę w celu stworzenia wyraźnych rozgraniczników pomiędzy stopniami zaawansowania nowotworu, literatura dotycząca nawrotu oponiaka w stopniu I wg WHO pozostaje niejednoznaczna. Na przykład, podczas gdy sama inwazja na mózg może spowodować zwiększenie stopnia zaawansowania guza z I-II stopnia WHO, w wielu kolejnych badaniach nie stwierdzono związku między inwazją na mózg a nawrotem, co podkreśla potrzebę dodatkowych badań nad predyktorami nawrotu (10, 17, 18). Przydatność wskaźnika MIB-1 w przewidywaniu nawrotu oponiaka jest również kontrowersyjna; w badaniu dotyczącym oponiaków WHO stopnia I sugerowano większe ryzyko nawrotu tylko przy wskaźniku MIB-1 >3%, ale w innym piśmiennictwie, obejmującym wszystkie stopnie WHO, wykazano większą częstość nawrotów przy >5% lub >10% (9-11). W poprzednich badaniach zaproponowano również wartość graniczną MIB-1 >3% tylko u pacjentów z resekcją w stopniu Simpsona II lub III, co dodatkowo dowodzi różnorodności wartości granicznych MIB-1 i ich zastosowania (13). Dla porównania, ograniczona liczba badań dotyczyła wpływu cech atypowych na nawrót oponiaka w stopniu I WHO; chociaż sugerowały one wyższe ryzyko nawrotu w guzach w stopniu I WHO wykazujących cechy atypowe w analizie patologicznej (9).
Celem niniejszej pracy było zatem zbadanie klinicznych, radiograficznych i patologicznych predyktorów nawrotu w oponiakach w stopniu I WHO. Biorąc pod uwagę brak konsensusu co do stosowania wskaźnika MIB-1 w oponiakach WHO stopnia I, zastosowaliśmy również analizę podziału rekursywnego w celu zidentyfikowania klinicznie istotnego punktu odcięcia dla wskaźnika MIB-1. Następnie identyfikujemy predyktory wczesnego i po-średniego nawrotu w guzach WHO stopnia I.
Metody
Populacja pacjentów
Pacjenci, którzy przeszli leczenie z powodu oponiaka WHO stopnia I od 2007 do 2017 roku, zostali retrospektywnie zidentyfikowani przy użyciu instytucjonalnej bazy danych. Badanie to zostało formalnie zatwierdzone przez University of California, San Francisco Institutional Review Board (IRB#13-12587). Pacjenci bez wartości indeksu MIB-1 dostępnych w elektronicznym rekordzie medycznym zostali wykluczeni. We wczesnym okresie badania MIB-1 był uzyskiwany według uznania neuropatologa prowadzącego, ale w miarę upływu czasu MIB-1 był uzyskiwany u wszystkich pacjentów z oponiakiem w stopniu I wg WHO.
Dane kliniczne
Dane demograficzne, kliniczne, charakterystyka leczenia, dane histopatologiczne i wyniki kliniczne pacjentów były retrospektywnie przeglądane i zbierane. Zebrane dane kliniczne obejmowały wiek pacjenta, płeć, stan sprawności Karnofsky’ego (KPS) podczas leczenia, prezentację kliniczną i wcześniejszą historię leczenia oponiaka. Dane histopatologiczne obejmowały indeks MIB-1, poszycie/utratę architektury, zwiększoną komórkowość, martwicę, atypię jądrową i obecność inwazji kości. Wyniki barwienia receptora progesteronowego (PR), antygenu błony nabłonkowej (EMA), CD34, S100, glejowego białka fibrylarnego i kwasowego (GFAP) były zbierane, jeśli były dostępne. Dane patologiczne zostały pobrane z raportu patologicznego wygenerowanego w czasie interwencji chirurgicznej. Lokalizacja guza, jego wielkość i obecność przedoperacyjnego obrzęku okołotumoralnego zostały określone za pomocą przedoperacyjnego obrazowania MRI. Zbierano średnice przednio-tylne (AP), górno-dolne (SI) i poprzeczne (TV). Przedoperacyjna objętość guza została obliczona przy użyciu równania dla objętości guza niesferycznego. Typ leczenia był podobnie zbierany. Stopień Simpsona został określony na podstawie raportu operacyjnego. Całkowita brutto (GTR) i subtotalna resekcja (STR) zostały określone przy użyciu pooperacyjnych skanów rezonansu magnetycznego (MRI).
Pierwotnymi wynikami zainteresowania były nawrót nowotworu i czas do nawrotu. Nawrót określano na podstawie radiografii pooperacyjnej jako wznowę miejscową lub progresję guza resztkowego. Czas do nawrotu określano od daty rozpoczęcia leczenia przez pacjenta. Długość obserwacji była liczona od daty leczenia do ostatniej wizyty w klinice neurochirurgii. Wtórne wyniki obejmowały wczesny i post-medianowy nawrót. Wczesny nawrót został zdefiniowany jako występujący w ciągu 2 lat od pierwszego leczenia (19). Wczesny nawrót został zdefiniowany jako występujący >2 lata po początkowym leczeniu.
Analiza statystyczna
Chi-kwadrat i test t-Studenta zostały wykorzystane do porównania zmiennych kategorycznych i ciągłych, odpowiednio. Wielowariantowy model regresji Coxa z prawdopodobieństwem wstecznym dla nawrotu choroby skonstruowano z wykorzystaniem zmiennych o p < 0,200 w analizie jednoczynnikowej. Podobnie, wieloczynnikowe binarne modele logistyczne z prawdopodobieństwem wstecznym zostały skonstruowane w celu przewidywania wczesnego i pośrodkowego nawrotu przy użyciu zmiennych z p < 0,200 w analizie jednoczynnikowej. Do dalszej identyfikacji kluczowych czynników ryzyka całkowitego, wczesnego i po-średniego nawrotu oponiaka zastosowano analizę rekursywnego podziału (RPA). Jako próg istotności statystycznej przyjęto p < 0,050. All statistical analysis was performed with SPSS 26.
Results
Overall Patient Demographics and Clinical Outcomes
Overall patient demographics, histopathological features, and clinical outcomes can be seen in Table 1. Łącznie do badania włączono 239 chorych z oponiakami w stopniu I wg WHO. Średnia wieku wynosiła 60,0 lat, a 69,5% pacjentów stanowiły kobiety. Najczęstszym objawem był ból głowy (30,5%), a następnie ogniskowy deficyt neurologiczny (27,6%). Większość pacjentów poddano wyłącznie operacji (98,3%), po 2 pacjentów otrzymało adjuwantową radioterapię (0,8%) lub zabiegi z użyciem noża gamma (0,8%). Obrzęk okołooperacyjny był obecny w przedoperacyjnych badaniach MRI u 38,1% pacjentów. Średnia obliczona objętość guza wynosiła 30,6 cm3 (zakres = 0,23-215,73 cm3), a średni największy wymiar guza wynosił 3,8 cm (zakres = 0,6-11,3 cm). Ogółem 91 (38,1%) guzów było zlokalizowanych na podstawie czaszki, 57 (23,8%) było guzami wypukłymi, 43 (18,0%) miało lokalizację falx/parasagittal, a 55 (23,0%) miało inną lokalizację. U większości chorych wykonano całkowitą resekcję (63,6%). Częstość występowania resekcji typu Simpson I, II, III i IV wynosiła odpowiednio 31,4, 29,7, 2,5 i 35,6%. U wielu pacjentów występowały cechy atypowe; najczęstszymi cechami atypowymi były: inwazja na kości (18,0%) oraz poszycie/utrata architektury (8,4%). Średni czas obserwacji wynosił 41,1 miesiąca (zakres: 0-147 miesięcy).
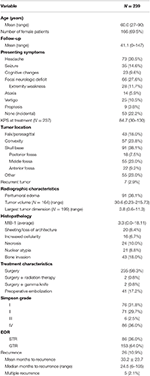
Tabela 1. Charakterystyka pacjentów, cechy histopatologiczne, radiografia i wyniki leczenia.
Predictors of WHO Grade I Meningioma Recurrence
W sumie u 26 pacjentów doszło do nawrotu choroby z medianą czasu do nawrotu wynoszącą 24,5 miesiąca (Tabela 1). Porównanie chorych z nawrotem i bez nawrotu znajduje się w tabeli 2. Nie było różnicy w wieku (60,2 vs. 58,8, p = 0,582) lub płci żeńskiej (61,5 vs. 70,4%, p = 0,353) między pacjentami z guzami, które nawróciły i pacjentami bez nawrotu. Charakterystyka leczenia była podobna między grupami, przy czym większość pacjentów w każdej grupie otrzymywała tylko operację (100,0 vs. 98,1%, p = 1,000). Jednak pacjenci z nawrotami mieli większą częstość STR (61,5 vs. 32,7%, p = 0,004) i mniejszą częstość resekcji w stopniu I wg Simpsona (11,5 vs. 34,1%, p = 0,019). Częstość występowania obrzęku okołoaortalnego, wielkość guza i objętość guza były podobne w obu grupach. Analiza histopatologiczna wykazała u pacjentów z nawrotem tendencję do zwiększonej atypii jądrowej (19,2 vs. 7,5%, p = 0,061). Pacjenci z nawrotem mieli również większą średnią długość obserwacji (68,9 vs. 37,7 miesięcy, p = 0,001).
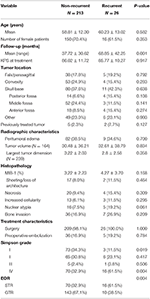
Tabela 2. Comparison of patients with recurrent meningiomas vs. non-recurrent meningiomas.
A subsequent backward likelihood cox-regression analysis highlighted an independent relationship between recurrence and posterior fossa tumor location (HR = 5.25, CI 1,71-16,17, p = 0,004), indeksem MIB-1 (HR = 1,18, CI 1,05-1,34, p = 0,008), atypią jądrową (HR = 5,24, CI 1,73-15,92, p = 0,003) i STR (HR = 5,66, CI 1,30-13,92, p < 0,001; tab. 3). Krzywe Kaplana-Meiera podkreślające przeżycie wolne od nawrotu dla lokalizacji w tylnym dole czaszki (p = 0,007), atypii jądrowej (p = 0,137), zakresu resekcji (p = 0,001) i MIB-1 >4,5% (p = 0,001) przedstawiono na rycinach 1A-D.
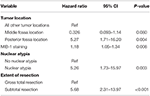
Tabela 3. Analiza regresji Coxa dla nawrotów.

Rysunek 1. Krzywe Kaplana Meiera czynników ryzyka nawrotu oponiaka w stopniu I wg WHO. (A) Atypia jądrowa (linia niebieska) vs. brak atypii jądrowej (linia czerwona) (X2 = 2,21, p = 0,137). (B) Lokalizacja guza w tylnym dole czaszki (linia niebieska) vs. inne lokalizacje (linia czerwona) (X2 = 10,36, p = 0,001). (C) Indeks MIB-1 >4,5% (linia niebieska) vs. ≤4,5% (linia czerwona) (X2 = 6,17, p = 0,013). (D) STR (linia niebieska) vs. GTR (linia czerwona) (X2 = 10,46, p = 0,001).
Predictors of Early vs. Post-median WHO Grade I Meningioma Recurrence
Porównanie pacjentów bez nawrotu i pacjentów z guzami, które nawróciły wcześnie lub post-median przedstawiono w tabeli 4. U pacjentów z wczesnym nawrotem częściej wykonywano resekcję subtotalną (76,9 vs. 32,7%, p = 0,001). Obserwowano u nich również tendencję do częstszego występowania atypii jądrowej (23,1 vs. 7,5%, p = 0,084) w badaniu histopatologicznym (tab. 4). U pacjentów z nawrotem po średnim okresie obserwowano tendencję do częstszego występowania lokalizacji guza w tylnym dole czaszki (23,1 vs. 6,6%, p = 0,063) oraz częstszego występowania inwazji kości (38,5 vs. 16,9%, p = 0,064), a także wyższego wskaźnika MIB-1 (5,55 vs. 3,22%, p = 0,098). Nie stwierdzono istotnej różnicy pomiędzy oceną Simpsona lub wskaźnikami GTR u pacjentów z nawrotem po medianie vs. u pacjentów bez nawrotu (Tabela 4).
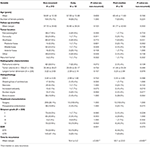
Tabela 4. Early vs. post-median recurrence.
Dwa wieloczynnikowe binarne modele logistyczne z prawdopodobieństwem wstecznym zostały użyte do identyfikacji predyktorów wczesnego vs. post-median recurrence (Tabela 5). Niezależnymi czynnikami predykcyjnymi wczesnego nawrotu nowotworu były atypia jądrowa w badaniu histopatologicznym (OR = 6,45, CI 1,34-31,07, p = 0,020) i STR (OR = 8,92, CI 2,18-36,46, p = 0,002). Jedynym niezależnym czynnikiem predykcyjnym nawrotu po średnim okresie był indeks MIB-1 (OR = 1,24, CI 1,05-1,45, p = 0,010), chociaż lokalizacja w tylnym dole czaszki zbliżała się do istotności (OR = 4,42, CI 0,954-20,49, p = 0,058; Tabela 5).

Tabela 5. Binary logistic model for post-median and early tumor recurrence.
Recursive Partitioning Analysis of Recurrence
RPA wykonano w celu identyfikacji kluczowych czynników ryzyka nawrotu oponiaka (Figura 2). Zgodnie z analizą cox-regression, STR był pierwszą partycją w przewidywaniu całkowitego nawrotu: 18,6% pacjentów z resekcją STR nawróciło w porównaniu z 6,5% z GTR. Kolejny węzeł decyzyjny w obrębie tylko chorych z GTR obejmował wartość odcięcia MIB-1 wynoszącą 4,5%, ponieważ 18,8% chorych z MIB-1 >4,5% uległo nawrotowi w porównaniu z 3,3% chorych z MIB-1 ≤4,5% (ryc. 2A). W odniesieniu do nawrotu po średnim okresie, RPA zidentyfikował pierwszy węzeł decyzyjny jako wartość odcięcia MIB-1 na poziomie 5,83%: 22,2% pacjentów z MIB-1 >5,83% miało nawrót w porównaniu z 3,3% pacjentów z MIB-1 ≤5,83%. W kolejnym węźle decyzyjnym wykorzystano lokalizację guza w tylnym dole czaszki: 13,3% pacjentów z guzem tylnego dołu czaszki nawróciło w porównaniu z 2,5% pacjentów z innymi lokalizacjami guza (Figura 2B). RPA dla wczesnych nawrotów zidentyfikował zakres resekcji jako główny węzeł decyzyjny: 11,6% pacjentów z STR nawróciło w porównaniu z 2,0% pacjentów z GTR. Kolejnym węzłem decyzyjnym była lokalizacja falx lub parasagittal: 36,4% guzów falx lub parasagittal nawróciło vs. 8,1% innych lokalizacji guza (Figura 2C).
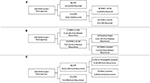
Figura 2. Recursive partitioning analysis highlighting key risk factors for (A) overall recurrence, (B) post-median recurrence, and (C) early recurrence.
Discussion
Key Results
WHO grade I meningioma recurrence is independently associated with MIB-1 index, posterior fossa tumor location, the presence of nuclear atypia, and STR. Dokładniej, indeks MIB-1 wynoszący 4,5% został określony jako klinicznie istotny punkt odcięcia w stratyfikacji ryzyka pacjentów z oponiakiem w stopniu I wg WHO po GTR. Pacjenci z indeksem MIB-1 >4,5% i GTR oponiaka w stopniu I WHO mieli podobne ryzyko nawrotu jak pacjenci z STR. W dalszej analizie podkreślono, że MIB-1 jest krytycznym czynnikiem związanym z nawrotem po średniej, podczas gdy zakres resekcji był głównym czynnikiem wczesnego nawrotu.
Predictors of WHO Grade I Meningioma Recurrence
Wcześniejsze badania w podobny sposób oceniały związek między cechami histopatologicznymi, charakterystyką kliniczną i nawrotem we wszystkich stopniach WHO oponiaka. W badaniu obejmującym 901 pacjentów (716 w stopniu I WHO, 174 w stopniu II i 11 w stopniu III) Gousias i wsp. wykazują większe ryzyko nawrotu w oponiakach z indeksem MIB-1 >10%, wyższym stopniem WHO, wielkością guza >6 cm, lokalizacją w petroclivalu lub zatoce jamistej oraz mnogością (11). Gousias i wsp. nie oceniali jednak zależności między obecnością atypowych cech w badaniu histologicznym a nawrotem nowotworu. Marciscano i wsp. wykorzystali kohortę 148 chorych na oponiaki w stopniu I wg WHO z pełną analizą patologiczną do identyfikacji zmiennych związanych z nawrotem, ze szczególnym uwzględnieniem wpływu atypowych cech patologicznych na ryzyko nawrotu (9). Interesujące jest, że autorzy ci identyfikują obecność cech atypowych jako niezależny czynnik ryzyka obok wskaźnika MIB-1 >3% i resekcji metodą Simpsona. Nasze badanie podobnie podkreśla chirurgiczną GTR i atypię jądrową, cechę atypową, jako niezależne predyktory nawrotu (Tabela 3), chociaż ocenialiśmy każdą cechę atypową niezależnie. W naszym modelu ko-regresji uwzględniliśmy również lokalizację guza, dodatkowo identyfikując lokalizację guza w tylnym dole czaszki jako niezależny czynnik ryzyka nawrotu. Podczas gdy Marciscano i wsp. nie uwzględnili lokalizacji guza w swojej analizie predyktorów progresji, Gousias i wsp. podobnie wykazali petroclivalną lokalizację guza jako czynnik ryzyka nawrotu, aczkolwiek biorąc pod uwagę wszystkie stopnie WHO meningioma (9, 11). Wyższe ryzyko nawrotu związane z lokalizacją w tylnym dole czaszki może wynikać z częstszego występowania mutacji NF2 w tylnym dole czaszki (14, 15, 20), choć nie jesteśmy w stanie tego w pełni zbadać, ponieważ w naszym ośrodku nie wykonujemy rutynowo badań genetycznych oponiaków. Niezależnie od tego potrzebne są dodatkowe badania z większymi kohortami pacjentów z oponiakami w stopniu I WHO, aby zbadać tę zależność.
MIB-1 Index and WHO Grade I Meningioma Recurrence
Podobnie do poprzednich badań (9, 11, 13, 21) oceniliśmy również zależność między indeksem MIB-1 guza a ryzykiem jego nawrotu. W pierwszej kolejności ocenialiśmy indeks MIB-1 w modelu ko-regresji dla całkowitej nawrotowości, jak wcześniej omówiono. Zgodnie z wcześniejszymi badaniami, stwierdziliśmy, że wyższy indeks MIB-1 był niezależnie związany z ogólnym zwiększonym ryzykiem nawrotu. Biorąc pod uwagę rozbieżności w wartościach odcięcia dla MIB-1 w literaturze i zmienność międzylaboratoryjną, początkowo ocenialiśmy MIB-1 jako zmienną ciągłą. Następnie staraliśmy się określić wartość odcięcia dla wskaźnika MIB-1 w naszej populacji pacjentów, wykorzystując RPA do modelowania całkowitego nawrotu choroby, co pozwoliło zidentyfikować wartość odcięcia dla MIB-1 wynoszącą 4,5% u pacjentów z GTR (ryc. 2A). Co ciekawe, pacjenci ci mieli podobne ryzyko nawrotu jak pacjenci z STR, co wskazuje na użyteczność MIB-1 u pacjentów po GTR. Perry i wsp. podobnie identyfikują wskaźnik MIB-1 wynoszący 4,2% jako związany z nawrotem po GTR w analizie jednoczynnikowej, aczkolwiek biorąc pod uwagę wszystkie stopnie zaawansowania oponiaka (22).
Odsetek nawrotów wynoszący 18,8% u pacjentów z GTR i MIB-1 >4,5% podkreśla potrzebę ścisłej obserwacji tych pacjentów, a nawet rozważenia radioterapii adiuwantowej, w zależności od preferencji pacjenta. Wykazano, że radioterapia adiuwantowa po resekcji oponiaka w stopniu I WHO zmniejsza liczbę nawrotów, zwłaszcza po STR (23-25), chociaż obserwacja po STR pozostaje standardem postępowania (8). W badaniu obejmującym 92 oponiaki w stopniu I WHO Soyuer i wsp. wykazali 91% przeżycie wolne od progresji choroby (progression-free survival, PFS) u chorych, którzy otrzymali radioterapię adiuwantową po STR, co było znacząco wyższe niż 38% PFS u chorych, którzy nie otrzymali radioterapii adiuwantowej (24). Ponieważ w naszym badaniu chorzy z STR mieli podobne ryzyko nawrotu jak chorzy z GTR i MIB-1 >4,5%, radioterapia adiuwantowa dla obu grup może być uzasadniona. Konieczne są jednak większe badania w celu dalszej walidacji przyjętej przez nas wartości granicznej MIB-1 i związanych z nią implikacji klinicznych. Potrzebne są również badania prospektywne badające zastosowanie radioterapii adiuwantowej w oponiakach WHO stopnia I.
Predictors of Early and Post-median WHO Grade I Meningioma Recurrence
Given the trend towards a later recurrence in patients with an elevated MIB >4.5% (Figura 1C), staraliśmy się następnie zbadać różnice w predyktorach między pacjentami, u których nawrót nastąpił wcześnie (zdefiniowany jako w ciągu 2 lat od leczenia) lub po medianie (ci, którzy nawrócili >2 lata po leczeniu). Niewiele badań w piśmiennictwie dotyczyło predyktorów wczesnych nawrotów w oponiakach. W pracy Budohoski i wsp. określili lokalizację parafalcynową, STR i obrzęk okołobrodawkowy w obrazie radiologicznym jako predyktory wczesnego nawrotu w kohorcie 220 atypowych oponiaków (26). W podobnym badaniu Maillo i wsp., dotyczącym oponiaków WHO stopnia I, wykorzystano fluorescencyjną hybrydyzację in situ (interphase fluorescence in situ hybridization – FISH) i cechy patologiczne do identyfikacji czynników ryzyka wczesnego nawrotu (definiowanego jako 2,5 roku po leczeniu) i stwierdzono, że większy rozmiar guza, nieprawidłowości kariotypu, wiek pacjenta i nieprawidłowości chromosomu 10 wiążą się ze zwiększonym ryzykiem nawrotu (19). Autorzy nie brali jednak pod uwagę obecności atypii w badaniu patologicznym ani wskaźnika MIB-1. Wykorzystując kohortę pacjentów z oponiakiem w stopniu I wg WHO z bardziej ziarnistymi danymi patologicznymi i klinicznymi, zidentyfikowaliśmy zakres resekcji i atypię jądrową w badaniu patologicznym jako niezależne predyktory wczesnego nawrotu w modelowaniu binarnej regresji logistycznej (Tabela 5). RPA podobnie ujawniła znaczenie zakresu resekcji w stratyfikacji pacjentów pod względem ryzyka wczesnego nawrotu (Figura 2C). Co ciekawe, podkreślono również zwiększone ryzyko związane z falx/parasagittal tumor location, co odpowiada wynikom Budohoski i wsp. Jedynym istotnym czynnikiem predykcyjnym nawrotu guza po śródpiersiu w binarnym modelowaniu regresji logistycznej był indeks MIB-1, chociaż lokalizacja guza w tylnym dole czaszki zbliżała się do istotności. Zostało to dodatkowo wykazane w badaniu RPA (Rycina 2B). Zaskakująco, zakres resekcji nie był niezależnym czynnikiem predykcyjnym nawrotu pośrodkowego, ponieważ większość nawrotów pośrodkowych była poddana GTR. Wznowy pośrodkowe mogą wskazywać na kategorię oponiaków WHO stopnia I, które są bardziej agresywne molekularnie i nawracają pomimo GTR, biorąc pod uwagę ich podwyższony indeks MIB-1 i lokalizację w tylnym dole czaszki. Wczesne nawroty są znacznie bardziej zależne od zakresu resekcji i w rezultacie prawdopodobnie reprezentują stały wzrost guza rezydualnego, w przeciwieństwie do nawrotu wcześniejszego, całkowicie usuniętego guza, co można zaobserwować w nawrotach po medianie. Tak więc, nasze wyniki potencjalnie reprezentują dwa różne molekularne podtypy oponiaka WHO stopnia I. Jednak przyszłe badania z większą kohortą pacjentów i danymi molekularnymi guza są potrzebne do dalszego zbadania leżących u podstaw różnic w zmianach molekularnych między wczesnymi i post-medianowymi nawrotami.
Ograniczenia
Ograniczenia naszego badania obejmują jego retrospektywny charakter i niską częstość występowania nawrotów. Nasze badanie obejmuje również pacjentów rozpoczynających się w 2007 roku, a w rezultacie obejmuje zarówno schematy klasyfikacji WHO CNS z 2007 i 2016 roku. Jednak jedyną istotną zmianą pomiędzy tymi dwoma klasyfikacjami było dodanie inwazji mózgu jako samotnego kryterium dla II stopnia WHO. Tylko u dwóch pacjentów włączonych do naszej kohorty stwierdzono w analizie patologicznej inwazję na mózg, a u żadnego z nich nie doszło do nawrotu choroby. W związku z tym nie sądzimy, aby włączenie pacjentów ocenionych według schematu klasyfikacji z 2007 roku miało znaczący wpływ na nasze wyniki. Ponadto, nasze badanie opiera się na raportach patologicznych po wstępnej resekcji, bez centralnego ponownego przeglądu slajdów patologicznych. Może to prowadzić do zwiększonej zmienności w zmiennych patologicznych, takich jak atypia jądrowa i inne podobne wyniki patologiczne, które mogą wykazywać zmienność międzyobserwacyjną (27, 28). Jednakże MIB-1 jest stosunkowo obiektywną miarą o niższej zmienności międzyobserwacyjnej pomiędzy patologami stosującymi tę samą metodę w laboratorium patologicznym (29). Wzorce praktyki dotyczące badania MIB-1 również zmieniły się w okresie objętym badaniem, od indywidualnych preferencji patologów, które różniły się w zależności od patologa, do badania u wszystkich pacjentów. Czynniki brane pod uwagę przez patologów przy podejmowaniu decyzji o badaniu MIB-1 obejmowały cechy atypowe uwzględnione w naszym badaniu, minimalizując w ten sposób ich potencjalny wpływ na nasze wyniki. Ponadto wszystkie oponiaki włączone do naszego badania mają stopień I według WHO. W rezultacie uważamy, że jakakolwiek stronniczość wprowadzona do badania na podstawie tych zmian w schematach praktyki jest minimalna. Wreszcie, chociaż uwzględniliśmy szczegółową charakterystykę kliniczną i patologiczną, w naszej kohorcie pacjentów brakuje informacji dotyczących zmian genetycznych i molekularnych guza, które, jak wykazano, mają znaczący wpływ na wyniki leczenia nowotworów (15, 30-32). W związku z tym istnieje potrzeba przeprowadzenia dodatkowych dużych, wieloośrodkowych badań z danymi molekularnymi/genetycznymi w uzupełnieniu do tradycyjnych zmiennych patologicznych i klinicznych przy przewidywaniu ogólnego nawrotu oponiaków w stopniu I wg WHO. Obejmuje to rozważenie molekularnych/genetycznych czynników prognostycznych, takich jak wzory metylacji w całym genomie (33, 34), mutacje promotora TERT (35) i dodatkowe dane molekularne guza. Biorąc pod uwagę nasze ustalenia, przyszłe badania nad unikalnymi genetycznymi/molekularnymi, klinicznymi i patologicznymi czynnikami prognostycznymi wczesnych i późniejszych nawrotów są również uzasadnione, biorąc pod uwagę potencjalny wpływ na podejmowanie decyzji terapeutycznych przez lekarzy.
Niemniej jednak, nasze badanie dostarcza szczegółowego wglądu w kliniczne i histopatologiczne predyktory nawrotu, szczególnie w oponiakach stopnia I wg WHO. Ponadto identyfikujemy pacjentów z MIB-1 >4,5% jako obarczonych wysokim ryzykiem nawrotu po GTR. Wykorzystujemy również nasze dane, aby zapewnić wgląd w różnice między wczesnymi i postmedianowymi nawrotami oponiaków w stopniu I WHO, potencjalnie identyfikując różne podgrupy molekularne oponiaków w stopniu I WHO. Nasze wyniki sugerują, że pacjenci z podwyższonym indeksem MIB-1 i atypią jądrową w analizie patologicznej, lokalizacją guza w tylnym dole czaszki i STR są w grupie podwyższonego ryzyka nawrotu i powinni być brani pod uwagę przy bliższej obserwacji, a nawet radioterapii adjuwantowej. Ponadto pacjenci z MIB-1 powyżej 4,5% mają podobne ryzyko nawrotu jak ci, którzy przeszli STR swoich guzów i również powinni być potencjalnie brani pod uwagę przy radioterapii adiuwantowej.
Wnioski
Pozostaje niedostateczna ilość literatury na temat specyficznych predyktorów nawrotu w oponiakach stopnia I wg WHO. Wyniki tego badania wskazują na lokalizację guza w tylnym dole czaszki, indeks MIB-1, atypię jądrową i zakres resekcji jako czynniki niezależnie związane z nawrotem oponiaków w stopniu I. Wykazano również, że pacjenci z MIB-1 >4,5% i GTR mają podobne ryzyko nawrotu jak pacjenci z STR. Wreszcie, analiza różnicowa wczesnych i pośrodkowych nawrotów wykazała związek wskaźnika MIB-1 i lokalizacji w tylnym dole czaszki z nawrotami pośrodkowymi, podczas gdy na wczesne nawroty bardziej istotny wpływ miał zakres resekcji. Konieczne są dodatkowe badania walidujące nasze wyniki i uwzględniające dane molekularne/genetyczne w celu zidentyfikowania dodatkowych predyktorów nawrotów w oponiakach w stopniu I wg WHO. Takie badania mogłyby zapewnić dokładniejsze ramy do stratyfikacji ryzyka pacjentów i pomóc w podejmowaniu decyzji terapeutycznych, w tym potencjału radioterapii adjuwantowej.
Oświadczenie o dostępności danych
Surowe dane potwierdzające wnioski tego artykułu zostaną udostępnione przez autorów, bez zbędnych zastrzeżeń.
Oświadczenie o etyce
Badania z udziałem ludzi zostały przejrzane i zatwierdzone przez UCSF Institutional Review Board. Pisemna świadoma zgoda na udział nie była wymagana w tym badaniu zgodnie z ustawodawstwem krajowym i wymaganiami instytucjonalnymi.
Wkład autorów
AH: konceptualizacja, metodologia, analiza formalna, dochodzenie, pisanie-oryginalny projekt, pisanie-przegląd i edycja oraz wizualizacja. JY: konceptualizacja, metodologia, recenzja i redakcja tekstu. IK i SS: badanie. J-SC: wizualizacja i analiza formalna. DR i MM: pisanie, recenzja i redakcja. SM: pisanie-rewizja i redakcja, konceptualizacja i metodologia. MA: pisanie, recenzja i redakcja oraz nadzór. All authors contributed to the article and approved the submitted version.
Conflict of Interest
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Recenzent BB zadeklarował współautorstwo w przeszłości z autorami DR, MM i SM do redaktora prowadzącego.
1. Ostrom QT, Cioffi G, Gittleman H, Patil N, Waite K, Kruchko C, et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2012-2016. Neuro Oncol. (2019) 21:v1-100. doi: 10.1093/neuonc/noz150
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Karsy M, Guan J, Cohen A, Colman H, Jensen RL. Medical management of meningiomas. Current status, failed treatments, and promising horizons. Neurosurg Clin N Am. (2016) 27:249-60. doi: 10.1016/j.nec.2015.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Brastianos PK, Galanis E, Butowski N, Chan JW, Dunn IF, Goldbrunner R, et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol. (2019) 21:I18-31. doi: 10.1093/neuonc/noy136
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Pettersson-Segerlind J, Orrego A, Lönn S, Mathiesen T. Long-term 25-year follow-up of surgically treated parasagittal meningiomas. World Neurosurg. (2011) 76:564-71. doi: 10.1016/j.wneu.2011.05.015
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Van Alkemade H, De Leau M, Dieleman EMT, Kardaun JWPF, Van Os R, Vandertop WP, et al. Impaired survival and long-term neurological problems in benign meningioma. Neuro Oncol. (2012) 14:658-66. doi: 10.1093/neuonc/nos013
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Buerki RA, Horbinski CM, Kruser T, Horowitz PM, James CD, Lukas RV. An overview of meningiomas. Futur Oncol. (2018) 14:2161-77. doi: 10.2217/fon-2018-0006
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Rogers L, Barani I, Chamberlain M, Kaley TJ, McDermott M, Raizer J, et al. Meningiomas: knowledge base, treatment outcomes, and uncertainties. A RANO review. J Neurosurg. (2015) 122:4-23. doi: 10.3171/2014.7.JNS131644
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Marciscano AE, Stemmer-Rachamimov AO, Niemierko A, Larvie M, Curry WT, Barker FG, et al. Benign meningiomas (WHO Grade I) with atypical histological features: correlation of histopathological features with clinical outcomes. J Neurosurg. (2016) 124:106-14. doi: 10.3171/2015.1.JNS142228
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Baumgarten P, Gessler F, Schittenhelm J, Skardelly M, Tews DS, Senft C, et al. Brain invasion in otherwise benign meningiomas does not predict tumor recurrence. Acta Neuropathol. (2016) 132:479-81. doi: 10.1007/s00401-016-1598-1
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Gousias K, Schramm J, Simon M. The simpson grading revisited: aggressive surgery and its place in modern meningioma management. J Neurosurg. (2016) 125:551-60. doi: 10.3171/2015.9.JNS15754
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Matsuno A, Fujimaki T, Sasaki T, Nagashima T, Ide T, Asai A, et al. Clinical and histopathological analysis of proliferative potentials of recurrent and non-recurrent meningiomas. Acta Neuropathol. (1996) 91:504-10. doi: 10.1007/s004010050458
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Oya S, Kawai K, Nakatomi H, Saito N. Significance of Simpson grading system in modern meningioma surgery: integration of the grade with MIB-1 labeling index as a key to predict the recurrence of WHO Grade I meningiomas – clinical article. J Neurosurg. (2012) 117:121-8. doi: 10.3171/2012.3.JNS111945
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Yuzawa S, Nishihara H, Tanaka S. Genetic landscape of meningioma. Brain Tumor Pathol. (2016) 33:237-47. doi: 10.1007/s10014-016-0271-7
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Karsy M, Azab MA, Abou-Al-Shaar H, Guan J, Eli I, Jensen RL, et al. Clinical potential of meningioma genomic insights: a practical review for neurosurgeons. Neurosurg Focus. (2018) 44:E10. doi: 10.3171/2018.2.FOCUS1849
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Patel AJ, Wan YW, Al-Ouran R, Revelli JP, Cardenas MF, Oneissi M, et al. Molecular profiling predicts meningioma recurrence and reveals loss of DREAM complex repression in aggressive tumors. Proc Natl Acad Sci USA. (2019) 116:21715-26. doi: 10.1073/pnas.1912858116
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Spille DC, Heß K, Sauerland C, Sanai N, Stummer W, Paulus W, et al. Brain invasion in meningiomas: incidence and correlations with clinical variables and prognosis. World Neurosurg. (2016) 93:346-54. doi: 10.1016/j.wneu.2016.06.055
PubMed Abstract | CrossRef Full Text | Google Scholar
18. PiŽem J, Velnar T, Prestor B, Mlakar J, Popović M. Brain invasion assessability in meningiomas is related to meningioma size and grade, and can be improved by extensive sampling of the surgically removed meningioma specimen. Clin Neuropathol. (2014) 33:354-63. doi: 10.5414/NP300750
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Maillo A, Orfao A, Espinosa AB, Sayagués JM, Merino M, Sousa P, et al. Wczesne nawroty w histologicznie łagodnych / w stopniu I oponiakach są związane z dużymi guzami i współistnieniem monosomii 14 i del(1p36) w klonie komórek przodka guza. Neuro Oncol. (2007) 9:438-46. doi: 10.1215/15228517-2007-026
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Youngblood MW, Duran D, Montejo JD, Li C, Omay SB, Özduman K, Sheth AH, et al. Correlations between genomic subgroup and clinical features in a cohort of more than 3000 meningiomas. J Neurosurg. (2019). doi: 10.3171/2019.8.jns191266. .
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Chen WC, Magill ST, Wu A, Vasudevan HN, Morin O, Aghi MK, et al. Histopatologiczne cechy predykcyjne kontroli miejscowej atypowego oponiaka po operacji i radioterapii adjuwantowej. J Neurosurg. (2019) 130:443-50. doi: 10.3171/2017.9.JNS171609
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Perry A, Stafford SL, Scheithauer BW, Suman VJ, Lohse CM. The prognostic significance of MIB-1, p53, and DNA flow cytometry in completely resected primary meningiomas. Cancer. (1998) 82:2262-9. doi: 10.1002/(SICI)1097-0142(19980601)82:11<2262::AID-CNCR23>3.0.CO;2-R
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Ohba S, Kobayashi M, Horiguchi T, Onozuka S, Yoshida K, Ohira T, et al. Long-term surgical outcome and biological prognostic factors in patients with skull base meningiomas: clinical article. J Neurosurg. (2011) 114:1278-87. doi: 10.3171/2010.11.JNS10701
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Soyuer S, Chang EL, Selek U, Shi W, Maor MH, DeMonte F. Radiotherapy after surgery for benign cerebral meningioma. Radiother Oncol. (2004) 71:85-90. doi: 10.1016/j.radonc.2004.01.006
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Park S, Cha YJ, Suh SH, Lee IJ, Lee KS, Hong CK, et al. Risk group-adapted adjuvant radiotherapy for WHO grade I and II skull base meningioma. J Cancer Res Clin Oncol. (2019) 145:1351-60. doi: 10.1007/s00432-019-02891-6
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Budohoski KP, Clerkin J, Millward CP, O’Halloran PJ, Waqar M, Looby S, et al. Predictors of early progression of surgically treated atypical meningiomas. Acta Neurochir. (2018) 160:1813-22. doi: 10.1007/s00701-018-3593-x
PubMed Abstract | CrossRef Full Text | Google Scholar
27. De La Monte SM, Flickinger J, Linggood RM. Histopatologiczne cechy przewidujące nawrót oponiaków po resekcji subtotalnej. Am J Surg Pathol. (1986) 10:836-43. doi: 10.1097/00000478-198612000-00002
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Backer-Grøndahl T, Moen BH, Torp SH. The histopathological spectrum of human meningiomas. Int J Clin Exp Pathol. (2012) 5:231-42.
PubMed Abstract | Google Scholar
29. Rezanko T, Akkalp AK, Tunakan M, Sari AA. MIB-1 counting methods in meningiomas and agreement among pathologists. Anal Quant Cytol Histol. (2008) 30:47-52.
PubMed Abstract | Google Scholar
30. Pérez-Magán E, Campos-Martín Y, Mur P, Fiaño C, Ribalta T, García JF, et al. Genetic alterations associated with progression and recurrence in meningiomas. J Neuropathol Exp Neurol. (2012) 71:882-93. doi: 10.1097/NEN.0b013e31826bf704
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Linsler S, Kraemer D, Driess C, Oertel J, Kammers K, Rahnenführer J, et al. Molecular biological determinations of meningioma progression and recurrence. PLoS ONE. (2014) 9:e94987. doi: 10.1371/journal.pone.0094987
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Barbera S, Miguel TS, Gil-Benso R, Muñoz-Hidalgo L, Roldan P, Gonzalez-Darder J, et al. Genetic changes with prognostic value in histologically benign meningiomas. Clin Neuropathol. (2013) 32:311-7. doi: 10.5414/NP300580
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Gao F, Shi L, Russin J, Zeng L, Chang X, He S, et al. Metylacja DNA w złośliwej transformacji oponiaków. PLoS ONE. (2013) 8:e54114. doi: 10.1371/journal.pone.0054114
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Vengoechea J, Sloan AE, Chen Y, Guan X, Ostrom QT, Kerstetter A, et al. Methylation markers of malignant potential in meningiomas. J Neurosurg. (2013) 119:899-906. doi: 10.3171/2013.7.JNS13311
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Lu VM, Goyal A, Lee A, Jentoft M, Quinones-Hinojosa A, Chaichana KL. The prognostic significance of TERT promoter mutations in meningioma: a systematic review and meta-analysis. J Neurooncol. (2019) 142:1-10. doi: 10.1007/s11060-018-03067-x
PubMed Abstract | CrossRef Full Text | Google Scholar
.