Introduction
Ryż ma złożoną architekturę korzeniową z mieszanką korzeni embrionalnych i postembrionalnych. Podczas kiełkowania najpierw pojawia się korzeń promienisty, a wkrótce potem zarodkowe korzenie wieńcowe (Rebouillat i in., 2009; Coudert i in., 2010). Pierwsze postembrionalne korzenie przybyszowe powstające w wyniku aktywności merystemu wierzchołkowego pędu pojawiają się kilka dni po wykiełkowaniu siewki. Korzenie przybyszowe nazywane są również korzeniami wieńcowymi lub koronowymi i są produkowane przez całe życie rośliny.
Wewnętrzna anatomia korzeni ryżu jest dobrze opisana, szczególnie w stadium siewki (Rebouillat i in., 2009). Kilka koncentrycznych tkanek (od peryferii do steli) znajduje się pomiędzy epidermą a tkankami naczyniowymi (Rysunek 1). Tkanki te, określane zbiorczo jako „tkanka podstawowa”, są czasem określane także jako „kora” (Lux i in., 2004). W tym miejscu zachowujemy ogólny termin, tj. tkanka podstawowa, dla opisania tkanek egzodermalnych, sklerenchymalnych, korowych i endodermalnych. Odnosimy się do „kory” jako tkanki znajdującej się pomiędzy endodermą a sklerenchymą.
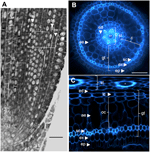
Rysunek 1. Anatomia 6-dniowej radicle Nipponbare. (A) Przekrój podłużny wiechy utrwalonej i zatopionej w paraplaście. Pasek = 100 μm. (B) Przekrój poprzeczny świeżej cząstki obserwowanej w świetle UV. Bar = 50 μm. (C) Polar transformed view of B. Warstwy tkanek są oznaczone następująco: stela (st), tkanka podstawna (gt) składająca się z kilku warstw komórek: jedna warstwa endodermy (ed), kilka warstw kory (c), jedna warstwa sklerenchymy (sc) i jedna warstwa egzodermy (ex). Warstwy endodermy (ed) i egzodermy (ex) są łatwo rozpoznawalne dzięki brakowi/redukcji fluorescencji w centrach ścian komórkowych tych komórek. Promienistość jest chroniona przez jedną warstwę epidermy (ep). Można wyróżnić dwa rodzaje warstw korowych: korę wewnętrzną (ic), która znajduje się obok endodermy (ed), oraz korę zewnętrzną (oc), która ostatecznie utworzy aerenchymę (ae). W steli należy zwrócić uwagę na obecność dużego centralnego metaxylemu (cx) otoczonego przez 6 naczyń metaxylemu (x).
Tkanka podścieliska składa się z kilku warstw tkanek, które mają to samo pochodzenie miąższowe, ale różne specyficzne cechy, które odgrywają różne i ważne role strukturalne i funkcjonalne w korzeniach. Na przykład egzoderma i endoderma stanowią bariery apoplastyczne, które kontrolują promienisty transport wody i składników odżywczych z gleby do organów fotosyntetycznych, co jest zapewnione głównie przez odkładanie blaszek suberynowych i wtórne różnicowanie ściany komórkowej (Gregory, 2006). Sclerenchyma to zdrewniałe komórki, które stanowią krytyczną barierę dla niektórych metali i prawdopodobnie odgrywają rolę mechanicznego wsparcia (Huang i in., 2012). W odróżnieniu od tych trzech jednowarstwowych tkanek, tkanka korowa w radiksie ryżu składa się z czterech lub pięciu warstw. Tkanka ta, zwana również śródkorą lub mezodermą, charakteryzuje się schizogenicznym tworzeniem przestrzeni, co prowadzi do powstawania aerenchymy u ryżu (Justin i Armstrong, 1991; Kawai i in., 1998). Aerenchyma odgrywa istotną rolę w tolerancji na warunki zalewowe i zapewnia stały przepływ tlenu z pędu do korzenia, umożliwiając wzrost korzeni w warunkach anoksycznych. Kora pełni ważną, ale zmienną funkcję w fizjologii korzeni u wielu gatunków i jest zaangażowana w magazynowanie, tolerancję na zalanie lub interakcje symbiotyczne (Lux i in., 2004).
Z korzeni promienistych i koronowych powstają trzy rodzaje korzeni bocznych: małe korzenie boczne (SLR) i dwa rodzaje dużych korzeni bocznych (Kawata i Shibayama, 1965; Kono i in., 1972; Rebouillat i in., 2009). Podział ten oparty jest na (i) średnicy korzeni: SLRs są najmniejsze (50-60 μm), a L-LLRs największe (120-150 μm), (ii) rozgałęzienia, które obserwuje się tylko na LLRs, (iii) obecność centralnego naczynia metaksymalnego tylko w LLRs oraz (iv) obecność warstwy sklerenchymy tylko w L-LLRs (Kono i in., 1972; Kawata i in., 1977; Rebouillat i in., 2009). Pomimo tej klasyfikacji, tożsamość wewnętrznych tkanek korzeni w korzeniach bocznych, szczególnie SLR, pozostaje niepewna. Rebouillat et al. (2009) oraz Kawata et al. (1977) stwierdzili, że tkanka podstawowa SLR składa się z endodermy, sklerenchymy i egzodermy (od wewnątrz w kierunku na zewnątrz), podczas gdy Kono et al. (1972), wewnętrzna warstwa komórek sklerenchymatycznych kory została opisana jako nieobecna w SLR i T-LLR.
Aby rozwiązać ten dylemat, a także ogólnie zbadać rozwój i funkcję poszczególnych tkanek, konieczne jest zastosowanie markerów tożsamości. Większość markerów tkankowych stosowanych do tej pory to markery morfologiczne lub plamy histochemiczne, które zapewniły użyteczny sposób charakteryzowania tożsamości komórek. Berberyna ujawnia obecność suberyny w ścianach komórkowych, która znajduje się prawie wyłącznie w paskach Caspariana, otaczających każdą pojedynczą komórkę endodermy i jest tym samym dobrym pośrednim markerem tożsamości endodermy (Brundett i in., 1988). W A. thaliana, specyficzne tkankowo markery zostały również opracowane przy użyciu tkankowo specyficznych promotorów sprzężonych z genami reporterowymi (GUS i/lub GFP) w genetycznie modyfikowanych roślinach. Na przykład, promotor SCARECROW jest wykorzystywany jako marker tożsamości endodermalnej (Sugimoto i in., 2010). Linie QC25 i QC46 enhancer trap GUS (Sabatini i in., 2003) oraz QHB w ryżu (Kamiya i in., 2003) zostały również zidentyfikowane jako markery centrum wzrostu (QC) na podstawie ich ekspresji specyficznej dla QC. Pomimo zainteresowania tymi markerami, dostępnych jest tylko kilka z nich i to prawie wyłącznie u A. thaliana. Mają one również wady. Na przykład, przydatność promotora SCARECROW (SCR) jako markera „endodermy” jest dyskusyjna, gdy rozważane są specyficzne pytania dotyczące roli SCR i SHORT ROOT (SHR) w różnicowaniu tkanki podścieliska. Rzeczywiście, geny SCR i SHR są zaangażowane per se w tworzenie endodermy/kory (Wu i Gallagher, 2014). U A. thaliana jedynymi dostępnymi markerami kory korzeniowej są promotory Co2 i Co3 (Heidstra i in., 2004; Ten Hove i in., 2010). U ryżu te markery kory nie są jeszcze stosowane, ponieważ nie ma wyraźnych ortologów dla genów Co2 i Co3. Do tej pory u ryżu stosowano jedynie pośrednie markery morfologiczne, takie jak tworzenie aerenchymy dla identyfikacji korowej (Rebouillat i in., 2009).
Inną klasą markerów są komercyjnie dostępne przeciwciała skierowane przeciwko roślinnym ścianom komórkowym (http://www.plantprobes.net/index.php). Markery te były w przeszłości wykorzystywane w niewielkim stopniu, ale wykazano ich skuteczność. Na przykład, przeciwciała CCRC-M2 i JIM13 skierowane przeciwko ścianom komórkowym zostały użyte u A. thaliana do wykazania, że pojedyncza warstwa tkanki wewnętrznej występująca u mutanta shr miała tożsamość korową, podczas gdy warstwa tkanki podstawowej mutanta scr wykazywała wiele tożsamości (Di Laurenzio i in., 1996; Helariutta i in., 2000). Markery te mają wiele zalet: ich prostota i możliwość łączenia przeciwciał drugorzędowych sprzężonych z różnymi fluorochromami w celu ograniczenia nakładania się z autofluorescencją, nie wymagają transformacji genetycznej i mogą być stosowane jako uzupełnienie innych klas markerów.
W niniejszej pracy po raz pierwszy opisujemy prosty, średnio wydajny protokół immunolabellingu świeżych wycinków tkanek wibratomowych. Używając tego protokołu, zbadaliśmy sekcje promieniowe słojów ryżu z dużą biblioteką 174 przeciwciał ściany komórkowej. Spośród nich zidentyfikowaliśmy osiem markerów specyficznych dla kory i wykazaliśmy, że ryż posiada dwa rodzaje tkanek korowych o odrębnej tożsamości. Warstwy te nazwaliśmy wewnętrzną i zewnętrzną korą w oparciu o ich anatomiczną pozycję w przekroju korzenia. Aby zademonstrować przydatność tych specyficznych dla kory markerów, wyjaśniliśmy tożsamość tkanek podłoża w korzeniach bocznych, używając trzech z tych przeciwciał. W szczególności w SLR pokazaliśmy, że wewnętrzna warstwa tkanki ma zewnętrzną tożsamość korową. Nasz protokół jest na tyle ogólny, że może być stosowany do rozwoju markerów tkankowych u dowolnego gatunku bez potrzeby generowania roślin transgenicznych. Protokół ten może być łatwo zaadaptowany do świeżych pędów, liści, korzeni lub dowolnych tkanek innych roślin i stanowi prosty i łatwy sposób identyfikacji specyficznych tkankowo markerów. Co więcej, markery te mogą być używane w połączeniu z innymi markerami molekularnymi.
Wyniki
Immunoprofiling of Cell Wall Antibodies in Rice Root Radial Sections Reveals Specific Antibodies for Cortex Layers
W celu zidentyfikowania markerów opartych na przeciwciałach dla komórek korowych, najpierw stworzyliśmy protokół do średnio wydajnego immunolabellingu promienistych przekrojów świeżych korzeni ryżu (patrz Materiały i Metody oraz Uzupełniająca Figura 1 dla szczegółów). Następnie przeprowadziliśmy screening z przeciwciałami monoklonalnymi wyhodowanymi przeciwko składnikom ściany komórkowej (z Complex Carbohydrate Research Center (CarboSource Services, Athens Georgia, USA) i Paul Knox Cell Wall Lab (University of Leeds, UK), szczegóły w Materiałach i Metodach)) w celu zidentyfikowania markerów kory. Spośród 174 przetestowanych przeciwciał, tylko 12 zostało zachowanych jako przypuszczalnie specyficzne dla kory. Przetestowaliśmy ich powtarzalność wykonując dwa dodatkowe eksperymenty i stwierdziliśmy, że osiem przeciwciał wykazywało podobne i solidne profile wśród trzech powtórzeń (Rysunek 2). Pięć przeciwciał (JIM7, M14, M38, M130 i M131) zapewniało ten sam wzór immunolabellingu w korze. Znakowane były tylko nie przylegające ściany komórkowe, co skutkowało pojedynczym znakowaniem wszystkich komórek kory w kształcie „diamentu”. W przypadku trzech pozostałych przeciwciał (LM5, M133 i M107), znakowanie było wykrywane w korze i czasami w komórkach sklerenchymy, szczególnie w przypadku przeciwciał LM5 i M107. Sygnał był homogenny na ścianie komórkowej kory, ale był znacznie słabszy w wewnętrznych warstwach kory (warstwa kory przylegająca do warstwy endodermalnej) niż w zewnętrznych warstwach kory. Tak więc, wszystkie te przeciwciała o profilach komplementarnych do tkanek korowych są specyficznymi markerami, które mogą być używane do analizy tożsamości komórek korowych. Ponadto, dwie różne etykiety korowe, definiujące dwa obszary podkorowe, sugerują, że warstwy zewnętrzne i wewnętrzne mają odrębną tożsamość molekularną, która została ujawniona przez te przeciwciała.
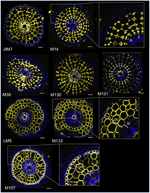
Rysunek 2. Identyfikacja ośmiu specyficznych przeciwciał kory (JIM7, M14, M38, M130, M131, LM5, M133 i M107) wśród 174 przeciwciał przesiewowych z biblioteki przeciwciał monoklonalnych ściany komórkowej. Dla każdego przeciwciała uzyskano połączone obrazy przekrojów poprzecznych pod mikroskopem konfokalnym po znakowaniu immunohistologicznym: na żółto – wzór przeciwciała przy 561 nm, a na niebiesko – autofluorescencja ściany komórkowej w świetle UV. Pięć przeciwciał (JIM7, M14, M38, M130 i M131) wykazuje podobny profil w obrębie wszystkich wybarwionych warstw komórek korowych (kształty rombów). Trzy przeciwciała (LM5, M133 i M107) homogenicznie znakowały ściany komórek korowych. Należy zauważyć, że w przypadku tych przeciwciał, wewnętrzne warstwy korowe (ic) nie są wybarwione w porównaniu z zewnętrznymi warstwami korowymi (oc). Wstawki są zbliżeniami odpowiednich obrazów. Bars = 20 μm.
Niektóre specyficzne cechy tych dwóch warstw podkorowych zostały uwydatnione, gdy plugin „polar transformer” oprogramowania ImageJ (http://imagej.nih.gov/ij/) został użyty do przeglądania obrazów przekrojów korzeni (Ryc. 1B,C; Schneider i in., 2012; Lartaud i in., 2014). Komórki wewnętrzne charakteryzowały się grubą ścianą komórkową w porównaniu z komórkami zewnętrznymi, które wykazywały różne puste przestrzenie zawierające powietrze, powstałe w wyniku fuzji ścian komórkowych. Wewnętrzne komórki korowe wykazywały również spłaszczony kształt przypominający komórki endodermalne, w przeciwieństwie do komórek zewnętrznych, które były bardziej okrągłe. W tym przekształconym obrazie, radialnej ściany komórkowej, która jest ścianą biegnącą od wewnętrznej strony komórki do zewnętrznej, autofluorescencja komórek endodermalnych i egzodermalnych nie jest widoczna, przypuszczalnie ze względu na obecność pasków Caspariana. Podobnie, ale w mniejszym stopniu, małe otwory zwolnione z autofluorescencji były również widoczne na radialnych ścianach komórkowych wewnętrznych komórek korowych.
Wszystkie typy korzeni bocznych posiadają tylko zewnętrzną tkankę korową
Aby zademonstrować przydatność markerów kory i scharakteryzować tożsamość komórek, oznaczyliśmy trzy typy ryżowych korzeni bocznych (L-LLR, T-LLR i SLR) trzema z tych przeciwciał (M107, M133 i M14). Do tego eksperymentu, ponieważ L-LLR nie często rozwijają się na płytkach Petriego, korzenie boczne zostały zebrane z siewek ryżu uprawianych w warunkach hydroponicznych przez 2 tygodnie. Najpierw przeanalizowaliśmy organizację tkanki podstawowej każdego typu korzenia bocznego, obserwując autofluorescencję ścian komórkowych w poprzecznym i biegunowym widoku sekcji korzenia (Rysunek 3). Ta pierwsza analiza ujawniła nieco odmienną wewnętrzną anatomię promieniową dla trzech typów korzeni bocznych. Podobnie jak w przypadku przekrojów promienistych oglądanych w świetle UV, tkanki endodermalne i egzodermalne można zidentyfikować po wygaszeniu fluorescencji w centrum promienistych ścian komórkowych. Te dwie tkanki były obecne we wszystkich korzeniach bocznych. Pomiędzy endodermą a egzodermą, w L-LLRs i T-LLRs obecnych było kilka warstw tkanek, podczas gdy SLRs posiadały tylko jedną (niezidentyfikowaną) warstwę komórek. Anatomia L-LLRs wyglądała jak korzenie nasienne, a na zewnątrz endodermy łatwo można było zidentyfikować kilka warstw tkanki korowej, gdy tworzyła się tkanka aerenchyma. Ponadto zaobserwowano warstwę sklerenchymy zbudowaną z gęsto upakowanych komórek o szerokich ścianach komórkowych. W zależności od eksperymentu, ta warstwa komórek nie zawsze była całkowicie rozwinięta. W przekrojach T-LLR warstwa zewnętrzna przypominała tkankę korową, a warstwa wewnętrzna przypominała pojedynczą (niezidentyfikowaną) warstwę SLR.
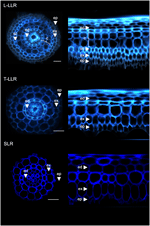
Rysunek 3. Skład tkankowy typów Large Lateral Root (Large-LLR i Thin-LLR) oraz Small Lateral Root (SLR). Sadzonki były uprawiane w warunkach hydroponicznych przez 2 tygodnie. Autofluorescencja ściany komórkowej na przekrojach poprzecznych oraz widok przekształconych biegunów w świetle UV. Tkanki są oznaczone następująco: epiderma (ep), egzoderma (ex), kora (c), endoderma (ed). Należy zauważyć, że epiderma (ep) była często fragmentowana w trakcie eksperymentu. Bars = 20 μm.
Aby zidentyfikować warstwy komórkowe obecne w tkankach podłoża SLR i T-LLR oraz potwierdzić tożsamość korową w L-LLR, immunolaborowaliśmy sekcje korzenia bocznego trzema przeciwciałami specyficznymi dla kory (M107, M133 i M14; Rysunek 4). Przeciwciała M107 i M133 znakowały wszystkie warstwy komórkowe znajdujące się pomiędzy endodermą i egzodermą we wszystkich korzeniach bocznych. W oparciu o barwienie radikul dla tych przeciwciał, obserwacja ta wskazała, że te warstwy komórkowe mogą mieć tożsamość sklerenchymy lub kory. Jednakże fakt, że M14 również immunolabilizował te warstwy, szczególnie w sekcjach SLR, wyraźnie pokazuje, że te warstwy miały zewnętrzną tożsamość korową.

Rysunek 4. Połączone obrazy sekcji dużych korzeni bocznych (Large-LLR i Thin-LLR) i małych korzeni bocznych (SLR) znakowanych immunologicznie M107, M133 i M14. Sadzonki były uprawiane w warunkach hydroponicznych przez 2 tygodnie. Na żółto – znakowanie przeciwciał przy 561 nm, na niebiesko – autofluorescencja w świetle UV. Tkanki są oznaczone w następujący sposób: epiderma (ep), egzoderma (ex), kora (c), endoderma (ed). Należy zauważyć, że epiderma (ep) była często fragmentowana w trakcie eksperymentu. Bars = 20 μm.
Zmiany w liczbie zewnętrznych warstw komórek korowych (jedna w SLR, dwie w T-LLR, trzy w L-LLR i cztery do pięciu w radikuli) odgrywają główną rolę w średnicach korzeni ryżu (Rysunek 5).
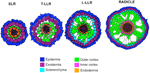
Rysunek 5. Schematyczne przedstawienie tkanek korzenia bocznego i radlic.
Wnioski
Do kwalifikacji obszarów podkorowych u roślin stosowano już różne terminy. Na przykład, obecność „wewnętrznej” zdrewniałej warstwy korowej, porównywalnej do badanej tutaj, została już opisana u dzikiego ryżu (Yang i in., 2014). U kukurydzy te dwie domeny korowe są inaczej zdefiniowane (Baluška i in., 1993). Domena „wewnętrzna” tworzy aerenchymę, odpowiadającą tutaj korze zewnętrznej, a kora „środkowo-zewnętrzna” jest zdrewniałą tkanką podporową, która może być sklerenchymą. U Arabidopsis opisano również warstwę komórek „środkowej kory”, znajdującą się pomiędzy monowarstwą korową a endodermą (Baum i in., 2002; Paquette i Benfey, 2005). Ostatnie wyniki sugerują, że ta warstwa korowa, której powstawanie jest regulowane m.in. przez GA, stres oksydacyjny oraz SHR i SCR, odgrywa rolę w tolerancji abiotycznej (Paquette i Benfey, 2005; Cui i Benfey, 2009; Pauluzzi i in., 2012; Wu i Gallagher, 2014). Co ciekawe, warstwa ta jest również opisywana jako helisa o typowym kształcie (Baum i in., 2002). Czy ta warstwa „środkowej kory” Arabidopsis może być funkcjonalnie i strukturalnie podobna do wewnętrznej warstwy korowej radikuli ryżu? Na podłużnych i poprzecznych przekrojach ryżu, wewnętrzna warstwa korowa również zwykle tworzy helisę, co sugeruje, że te dwie warstwy tkanki mogą być porównywalne. U Arabidopsis warstwa „środkowej kory” pochodzi z perycyklinowego podziału endodermy, który pojawia się z dala od QC między 7 a 14 dniem po kiełkowaniu (Paquette i Benfey, 2005). Do weryfikacji tych ważnych parametrów u ryżu potrzebne będą nowe narzędzia. Na przykład, do tej pory nie opisano żadnego mutanta wpływającego na czas tworzenia się tej warstwy. Co więcej, konieczny jest także postęp techniczny w obrazowaniu QC ryżu. Niemniej jednak, nasze markery specyficzne dla kory oferują nowe narzędzie do porównania funkcji i sieci molekularnej zaangażowanej w formowanie się kory wewnętrznej (ryż) w porównaniu z „korą środkową” (Arabidopsis). W naszym laboratorium trwają prace nad identyfikacją molekularnych determinantów formowania wewnętrznej i zewnętrznej kory, przy czym ortologi ryżowe SCR i SHR są pierwszymi kandydatami do regulacji formowania kory w korzeniach ryżu (Pauluzzi i in., 2012).
Materiały i metody
Materiał roślinny
Siewki sześciodniowe
Siewki Oryza sativa L. ssp. japonica Nipponbare uprawiano pionowo w sterylnych szalkach Petriego (Corning, 431301; 20 × 20 cm) w kontrolowanych warunkach (rytm dzień/noc: 12/12 h, 28/25°C, natężenie światła: 500 μE m-2 s-1). Najpierw nasiona sterylizowano powierzchniowo poprzez płukanie w 70% etanolu przez ~1 min. Następnie etanol zastąpiono roztworem składającym się z 40% wybielacza w wodzie destylowanej zawierającym trzy krople tween 80 (Sigma-Aldrich P4780-500 mL). Nasiona moczono w tym roztworze przez 30 min, delikatnie mieszając, a następnie płukano co najmniej czterokrotnie sterylną wodą destylowaną. Gorącą (~50°C), sterylizowaną w autoklawie pożywkę Murashige i Skoog (MS/2) (250 mL) wlewano do szalek Petriego i pozostawiano do zastygnięcia na ~45 min. Podłoże stałe MS/2 składa się z 2,15 g.L-1 mieszaniny soli podstawowych podłoża MS (Duchefa Biochemie, M0221), 75 mg.L-1 mieszaniny witamin MS (Duchefa Biochemie, M0409) i 8 g.L-1 agarozy typu II (Sigma-Aldrich, A6877). Sterylne nasiona wciśnięto do zestalonej pożywki MS/2 z korzonkami skierowanymi ku dołowi. Korzenie zbierano po 6 dniach wzrostu.
Rośliny czterotygodniowe
Po 3 dniach kiełkowania w wodzie, siewki przenoszono do systemu hydroponicznego w kontrolowanych warunkach (rytm dzień/noc: 12/12 h, 28/25°C, natężenie światła: 500 μE m-2 s-1, wilgotność względna: 55%). System hydroponiczny składa się z plastikowej skrzynki o pojemności 50 L zawierającej 30 L roztworu hydroponicznego, na której ułożony jest materac piankowy o grubości 1 cm. Materac piankowy jest poprzecinany szczelinami w celu utrzymania podstaw pędów sadzonek. Podłoże hydroponiczne składa się z (NH4)2SO4 (0,5 mM), MgSO4.7H2O (1,6 mM), Ca(NO3)2.4H2O (1,2 mM), KNO3 (0,7 mM), FeSO4 (0,1 mM), Na2EDTA (0,1 mM), MnSO4. H2O (1,7 μM), (NH4)6Mo7O24.4H2O (0,2 μM), ZnSO4.7H2O (0,2 μM), CuSO4.5H2O (0,2 μM), H3BO3 (1,4 μM) i KH2PO4 (0,6 mM). Roztwór był napowietrzany za pomocą pompy umieszczonej na dnie plastikowej skrzynki i wymieniany co 10 dni. pH było regulowane i utrzymywane na poziomie 5,4 ± 0,2.
Odcinanie świeżych korzeni
Końcówki rosnących siewek lub korzeni bocznych (2 cm) były cięte przy użyciu ostrego noża i umieszczane równolegle do siebie w celu wyrównania końcówek korzeni (Rysunki uzupełniające 1A,B). Zostały one zatopione w jednej kropli 3% rozpuszczonej agarozy (50°C; Supplementary Figure 1C). Płaty zawierające wierzchołki korzeni umieszczano w studzience o wymiarach 3 × 1 × 1 cm, wypełnionej 3% roztopioną agarozą (Supplementary Figure 1D). Po zestaleniu bloczki zmieniły rozmiar i przyklejono je na płytkę wibratomu w celu pokrojenia. Parametry wibratomu (Hm650v (Thermo Scientific Microm)) to prędkość 30, częstotliwość 70, amplituda 0,8 i grubość 60 μm (Supplementary Figure 1E). Sekcje przenoszono albo na szkiełka komorowe (Lab-teak 177402) do barwienia immunologicznego (Supplementary Figure 1F), albo na szkiełka nawilżone 1X buforem fosforanu alkalicznego (PBS, Sigma-Aldrich P3813) do obserwacji.
Immunolokalizacja
Sekcje umieszczone na szkiełkach komorowych (po trzy na komorę) płukano najpierw w 0,1 M glicynie uzupełnionej 1X PBS, a następnie dwukrotnie w 1X PBS, każde przez 10 min. Następnie tkanki zanurzano w roztworze PBS zawierającym 5% bydlęcej surowicy płodowej (roztwór blokujący, Thermo Fisher 37520) w temperaturze 4°C przez noc pod mieszaniem. Przeciwciała pierwotne, rozcieńczone w stosunku 1/10 w tym roztworze blokującym, nakładano przez noc w temperaturze 4°C pod mieszaniem. Następnie sekcje były płukane 3 razy w PBS 1X przez 10 min. Sekcje korzeni inkubowano przez 2 h z przeciwciałami drugorzędowymi rozcieńczonymi 500-krotnie w roztworze blokującym, pod mieszaniem. Przeciwciała te były sprzężone z fluoroforem, przeciwciałem Alexa 546 przeciwko szczurom (Invitrogen A11081) lub przeciwciałem Alexa 546 przeciwko myszom (Invitrogen A11060). Następnie, sekcje były płukane trzykrotnie w 1X PBS pod mieszaniem, przez 10 minut każda. Komory usuwano i dodawano kilka kropli podłoża montażowego mowiol (Sigma-Aldrich 81381). Na przekroje korzeni nałożono szkiełko nakrywkowe, które pozostawiono do wyschnięcia na 36 h w temperaturze 4°C w ciemności.
Utrwalanie paraplastów
Radia wyrosłe na płytkach Petriego przez 6 dni utrwalano w 4% paraformaldehydzie (w PBS 1X) przez noc w temperaturze 4°C i dwukrotnie przepłukano przy użyciu PBS 1X (Jackson, 1991). Utrwalone tkanki odwodniono w etanolu, oczyszczono w Histochoice Clearing Agent (HistoClear, Sigma Aldrich) i osadzono w Paraplast (Fisher). Tkanki poddano sekcji (grubość 6 μm) na mikrotomie Leica RM2255 i osadzono na szkiełkach SuperfrostPlus (Fisher).
Mikroskopia
Obserwacje w jasnym polu i autofluorescencji przeprowadzono przy użyciu mikroskopu Leica DM4500. W przypadku autofluorescencji zdjęcia wykonywano przy użyciu kostki filtracyjnej „A” (zakres wzbudzenia: UV; filtr wzbudzający: BP 340-380; filtr tłumiący: LP 425). Immunostarwione sekcje obserwowano za pomocą mikroskopów konfokalnych: Zeiss LSM 510 lub Leica SP8. Ściany komórkowe wizualizowano najpierw za pomocą autofluorescencji. Przeciwciało drugorzędowe wizualizowano przy użyciu lasera helowo-neonowego o długości fali odpowiednio 543 lub 561 nm. Zdjęcia wykonano kolorowym aparatem Retiga 2000R (QIMAGING, Kanada) z oprogramowaniem Volocity (Improvision, UK).
Wkład Autorów
SH, FD, MB, CB: zbieranie danych; SH, CP, AD analiza danych; SH, EG, CP, AD: redagowanie manuskryptu.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Dziękujemy MRI (Montpellier RIO Imaging plateform), PHIV i La Gaillarde Plateforms za ich wsparcie techniczne dla immunolokalizacji i/lub obrazowania konfokalnego i wielofotonowego. SH jest wspierany przez stypendium doktoranckie CIRAD.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online na: https://www.frontiersin.org/article/10.3389/fpls.2015.01139
Abbreviations
ae, aerenchyma; c, cortex; ed, endodermis; ep, epidermis; ex, exodermis; gt, ground tissue; ic, inner cortex; L-LLR, Large-type Large Lateral Root; oc, zewnętrzna kora; sc, sklerenchyma; SLR, Small Lateral Root; st, stela; T-LLR, Thin-type Large Lateral Root; x, xylem.
Baluška, F., Brailsford, R. W., Hauskrecht, M., Jackson, M. B., and Barlow, P. W. (1993). Cellular dimorphism in the maize root cortex: involvement of microtubules, ethylene and gibberellin in the differentiation of cellular behaviour in postmitotic growth zones. Bot. Acta 106, 394-403. doi: 10.1111/j.1438-8677.1993.tb00766.x
CrossRef Full Text | Google Scholar
Baum, S. F., Dubrovsky, J. G., and Rost, T. L. (2002). Organizacja wierzchołkowa i dojrzewanie kory i cylindra naczyniowego w korzeniach Arabidopsis thaliana (Brassicaceae). Am. J. Bot. 89, 908-920. doi: 10.3732/ajb.89.6.908
PubMed Abstract | CrossRef Full Text | Google Scholar
Brundett, M. C., Enstone, D. E., and Peterson, C. A. (1988). A Berberine-aniline blue fluorescent staining procedure for suberin, lignin, and callose in plant tissue. Protoplasma 146, 133-142. doi: 10.1007/BF01405922
CrossRef Full Text | Google Scholar
Coudert, Y., Périn, C., Courtois, B., Khong, N. G., and Gantet, P. (2010). Genetyczna kontrola rozwoju korzeni u ryżu, modelowego zboża. Trends Plant Sci. 15, 219-226. doi: 10.1016/j.tplants.2010.01.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., and Benfey, P. N. (2009). Interplay between SCARECROW, GA and LIKE HETEROCHROMATIN PROTEIN 1 in ground tissue patterning in the Arabidopsis root. Plant J. 58, 1016-1027. doi: 10.1111/j.1365-313X.2009.03839.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Di Laurenzio, L., Wysocka-Diller, J., Malamy, J. E., Pysh, L., Helariutta, Y., Freshour, G., et al. (1996). The SCARECROW gene regulates an asymmetric cell division that is essential for generating the radial organization of the Arabidopsis root. Cell 86, 423-433. doi: 10.1016/S0092-8674(00)80115-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Gregory, P. J. (2006). Plant Roots: Growth, Activity, and Interaction with Soils. Oxford; Ames, IA: Blackwell Pub.
Google Scholar
Heidstra, R., Welch, D., and Scheres, B. (2004). Mosaic analyses using marked activation and deletion clones dissect Arabidopsis SCARECROW action in asymmetric cell division. Genes Dev. 18, 1964-1969. doi: 10.1101/gad.305504
PubMed Abstract | CrossRef Full Text | Google Scholar
Helariutta, Y., Fukaki, H., Wysocka-Diller, J., Nakajima, K., Jung, J., Sena, G., et al. (2000). The SHORT-ROOT gene controls radial patterning of the Arabidopsis root through radial signaling. Cell 101, 555-567. doi: 10.1016/S0092-8674(00)80865-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Huang, C. F., Yamaji, N., Ono, K., and Ma, J. F. (2012). A leucine-rich repeat receptor-like kinase gene is involved in the specification of outer cell layers in rice roots. Plant J. 69, 565-576. doi: 10.1111/j.1365-313X.2011.04824.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Jackson, D. (1991). „In-situ hybridization in plants” in Molecular Plant Pathology: A Practical Approach, eds D. J. Bowles, M. McPherson, and S. J. Gurr (Totowa, NJ: Humana Press), 163-174.
Google Scholar
Justin, S. H. F. W., and Armstrong, W. (1991). Evidence for the involvement of ethylene in aerenchyma formation in adventitious roots of rice (Oryza sativa L.). New Phytol. 118, 49-62. doi: 10.1111/j.1469-8137.1991.tb00564.x
CrossRef Full Text | Google Scholar
Kamiya, N., Nagasaki, H., Morikami, A., Sato, Y., and Matsuoka, M. (2003). Isolation and characterization of a rice WUSCHEL-type homeobox gene that is specifically expressed in the central cells of a quiescent center in the root apical meristem. Plant J. 35, 429-441. doi: 10.1046/j.1365-313X.2003.01816.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Kawai, M., Samarajeewa, P. K., Barrero, R. A., Nishiguchi, M., and Uchimiya, H. (1998). Cellular dissection of the degradation pattern of cortical cell death during aerenchyma formation of rice roots. Planta 204, 277-287. doi: 10.1007/s004250050257
CrossRef Full Text | Google Scholar
Kawata, S., Sasaki, O., and Yamazaki, K. (1977). On the structure of the crown root and the lateral root, and the vessel connection between them, in rice plants. Jpn. J. Crop. Sci. 46, 569-579. doi: 10.1626/jcs.46.569
CrossRef Full Text | Google Scholar
Kawata, S., and Shibayama, B. (1965). On the lateral root primordia formation in the crown roots of rice plant. Proc. Crop Sci. Soc. Jpn. 33, 423-431. doi: 10.1626/jcs.33.423
CrossRef Full Text | Google Scholar
Kono, Y., Igeta, M., and Yamada, N. (1972). Studies on the developmental physiology of the lateral roots in rice seminal roots. Jpn. J. Crop. Sci. 41, 192-204. doi: 10.1626/jcs.41.192
CrossRef Full Text
Lartaud, M., Perin, C., Courtois, B., Thomas, E., Henry, S., Bettembourg, M., et al. (2014). PHIV-RootCell: a supervised image analysis tool for rice root anatomical parameter quantification. Front. Plant Sci. 5:790. doi: 10.3389/fpls.2014.00790
PubMed Abstract | CrossRef Full Text | Google Scholar
Lux, A., Luxova, M., Abe, J., and Morita, S. (2004). Root cortex: structural and functional variability and responses to environmental stress. Root Res. 13, 117-131. doi: 10.3117/rootres.13.117
CrossRef Full Text | Google Scholar
Paquette, A. J., and Benfey, P. N. (2005). Maturation of the ground tissue of the root is regulated by gibberellin and SCARECROW and requires SHORT-ROOT. Plant Physiol. 138, 636-640. doi: 10.1104/pp.104.058362
PubMed Abstract | CrossRef Full Text | Google Scholar
Pauluzzi, G., Divol, F., Puig, J., Guiderdoni, E., Dievart, A., and Périn, C. (2012). Surfing wzdłuż sieci genów tkanki podstawowej korzenia. Dev. Biol. 365, 14-22. doi: 10.1016/j.ydbio.2012.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Rebouillat, J., Dievart, A., Verdeil, J., Escoute, J., Giese, G., Breitler, J., et al. (2009). Molecular genetics of rice root development. Rice 2, 15-34. doi: 10.1007/s12284-008-9016-5
CrossRef Full Text | Google Scholar
Sabatini, S., Heidstra, R., Wildwater, M., and Scheres, B. (2003). SCARECROW is involved in positioning the stem cell niche in the Arabidopsis root meristem. Genes Dev. 17, 354-358. doi: 10.1101/gad.252503
PubMed Abstract | CrossRef Full Text | Google Scholar
Schneider, C. A., Rasband, W. S., and Eliceiri, K. W. (2012). NIH Image to ImageJ: 25 lat analizy obrazu. Nat. Methods 9, 671-675. doi: 10.1038/nmeth.2089
PubMed Abstract | CrossRef Full Text | Google Scholar
Sugimoto, K., Jiao, Y., and Meyerowitz, E. M. (2010). Arabidopsis regeneration from multiple tissues occurs via a root development pathway. Dev. Cell 18, 463-471. doi: 10.1016/j.devcel.2010.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Ten Hove, C. A., Willemsen, V., de Vries, W. J., Van Dijken, A., Scheres, B., and Heidstra, R. (2010). SCHIZORIZA encodes a nuclear factor regulating asymmetry of stem cell divisions in the Arabidopsis root. Curr. Biol. 20, 452-457. doi: 10.1016/j.cub.2010.01.018
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., and Gallagher, K. L. (2014). The movement of the non-cell-autonomous transcription factor, SHORT-ROOT relies on the endomembrane system. Plant J. 80, 396-409. doi: 10.1111/tpj.12640
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, C., Zhang, X., Li, J., Bao, M., Ni, D., and Seago, J. L. (2014). Anatomia i histochemia korzeni i pędów u dzikiego ryżu (Zizania latifolia Griseb.). J. Bot. 2014, 9. doi: 10.1155/2014/181727
CrossRef Full Text | Google Scholar
.