Wprowadzenie
Zakażenie wirusem zapalenia wątroby typu B (HBV) jest najczęstszą przyczyną marskości wątroby i raka wątrobowokomórkowego w większości rejonów Azji.1,2 W patogenezie przewlekłego zapalenia wątroby pośredniczy interakcja reakcji immunologicznej gospodarza i hepatocytów prezentujących antygeny HBV.3,4 Wcześniejsze badania wykazały, że ekspresja antygenów HBV przez hepatocyty jest istotnie związana z fazą i aktywnością przewlekłej choroby wątroby. W fazie tolerancji immunologicznej antygeny rdzeniowe zapalenia wątroby typu B (HBcAg) znajdują się głównie w jądrze i korelują z replikacją HBV, podczas gdy w następującej po niej fazie klirensu immunologicznego dochodzi do wewnątrzwątrobowego przesunięcia HBcAg z jądra do cytoplazmy i jest to związane z histologiczną aktywnością przewlekłego zapalenia wątroby.5,6 W przypadku wewnątrzwątrobowej ekspresji antygenu powierzchniowego zapalenia wątroby typu B (HBsAg) opisywano trzy wzorce – typ homogenny, typ I – hepatocyt ze szkła mielonego (GGH) i typ II – GGH. Jednorodne wzory w postaci zgrupowanej, dyskretnej lub słabo widocznej obserwowano u pacjentów z wysoką wiremią lub aktywnym zapaleniem wątroby. GGH typu I są zwykle rozproszone pojedynczo w zrazikach wątrobowych z inkluzyjną gęstą jednorodną ekspresją, podczas gdy GGH typu II wyrażają antygeny powierzchniowe na obrzeżach hepatocytów, które grupują się w grupy i są ogólnie obecne podczas fazy niskiej replikacji i stają się dominujące od aktywnego zapalenia wątroby do marskości wątroby i raka wątrobowokomórkowego.7-10 Stąd, zarówno wewnątrzwątrobowa ekspresja HBcAg, jak i HBsAg są ściśle związane z naturalnym przebiegiem zakażenia i replikacji HBV.
Pośród faz przewlekłego zapalenia wątroby typu B, faza oczyszczania immunologicznego lub określana jako HBeAg-dodatnie przewlekłe zapalenie wątroby typu B często występowała w młodszej populacji, wykazywała mniejszą aktywność histologiczną i charakteryzowała się mniejszą liczbą mutacji precore A1896 i mutacji promotora rdzenia podstawowego (BCP) T1762/A1764 niż przewlekłe zapalenie wątroby typu B HBeAg-ujemne.11 -14-Przebieg przewlekłego zapalenia wątroby typu B jest dynamiczny, co wynika z interakcji replikacji wirusa i układu odpornościowego gospodarza. W związku z tym u pacjentów HBeAg dodatnich powszechnie obserwuje się zróżnicowanie cech klinicznych i czynności histologicznych. Na przykład 34 do 55% pacjentów wykazuje pomostowe włóknienie lub marskość wątroby w badaniu histologicznym, podczas gdy u pozostałych pacjentów występuje łagodne włóknienie.15,16 Wykazano, że gromadzenie HBsAg w hepatocytach wiąże się z określonymi mutacjami wirusowymi i jest związane z aktywnością choroby.8,9 Interesujące jest zbadanie charakterystyki wewnątrzwątrobowej ekspresji HBsAg u pacjentów z różnym stopniem ciężkości histologicznej wątroby.
Mutanty wirusowe zwykle ewoluują pod presją nadzoru immunologicznego gospodarza. Wśród naturalnie występujących mutacji HBV, mutacje BCP T1762/A1764 stały się powszechne w miarę postępu choroby i często stwierdzano ich związek z zaawansowaną chorobą wątroby i rakiem wątrobowokomórkowym.17,18 Wzorce wewnątrzwątrobowej ekspresji HBsAg również ulegały zmianom podczas naturalnego przebiegu przewlekłego zapalenia wątroby typu B. Związek mutacji BCP T1762/A1764 z wewnątrzwątrobową ekspresją HBsAg jest nadal nieznany i pozostaje do zbadania.
W związku z tym celem tego badania była ocena cech wewnątrzwątrobowej ekspresji HBsAg i analiza związku z histologią wątroby, markerami replikacji wirusowej i mutacjami HBV w przewlekłym zapaleniu wątroby typu B z wynikiem dodatnim HBeAg.
Materiał i metodyPacjenci
Do badania retrospektywnie włączono 181 pacjentów z dodatnim antygenem e (HBeAg) zapalenia wątroby typu B, którzy spełnili kryteria włączenia. Kryteria włączenia obejmowały wiek powyżej 18 lat i mniej niż 70 lat, dodatni wynik HBsAg w surowicy przez ponad 6 miesięcy i poziom DNA HBV w surowicy ≥ 100 000 kopii/ml, nieprawidłowy poziom aminotransferazy alaninowej w surowicy, brak innej wytłumaczalnej etiologii przewlekłego zapalenia wątroby, w tym alkoholu, autoimmunologicznego zapalenia wątroby lub markerów zakażenia wirusem zapalenia wątroby typu C, wirusem zapalenia wątroby typu D lub ludzkim wirusem niedoboru odporności, a także brak w wywiadzie leczenia anty-HBV i próbki biopsji wątroby dostępnej do oceny histologicznej. Próbki surowicy i biopsji wątroby wszystkich pacjentów pobierano przed leczeniem przeciwwirusowym, a do czasu badania próbki przechowywano w temperaturze -70 oC. Badanie to zostało zatwierdzone przez Institutional Review Board of National Cheng Kung University Hospital (nr: ER-99-398). Uzyskano świadomą zgodę, zgodnie z Deklaracją Helsińską.
Atesty wirusologiczne HBV
Genotypowanie HBV przeprowadzono za pomocą reakcji łańcuchowej polimerazy typu multiplex, jak opisano w innym miejscu.19 Poziom DNA HBV w surowicy mierzono za pomocą testu COBAS Amplicor HBV Monitor (test COBAS-AM, Roche Diagnostics, Branchburg, NJ). Poziom HBsAg w surowicy oznaczano ilościowo za pomocą Abbott Architect HB-sAg QT (Abbott Diagnostics, Rungis, Francja) z zakresem dynamicznym 0,05-250,0 IU/mL. Próbki z poziomem HBsAg > 250 IU/mL były ponownie badane w rozcieńczeniach 1:20 i 1:1000.
Reakcja łańcuchowa polimerazy i sekwencjonowanie regionów precore i BCP
HBV DNA ekstrahowano z 50 μL surowicy przy użyciu Blood and Tissue Genomic Mini Kit (VIOGENE, Taipei, Taiwan). Pierwszą rundę PCR przeprowadzono w następujących warunkach: 96 oC przez 2 min, 94 oC przez 1 min, 54 oC przez 1 min i 72 oC przez 2 min ze starterami 5′-ACCTCTGCACGTAGCATGG (forward) i 3′-GGATTAAAGACAGGTACAGTAGAAG (reverse). Drugą rundę PCR przeprowadzono w tych samych warunkach ze starterami 5′-ATGTCAACGACCTTGA (forward) i 3′-TTCCCACCTTATGAGTCCAAG (reverse). Oczyszczone produkty PCR poddano następnie bezpośredniemu sekwencjonowaniu przy użyciu automatycznego sekwenatora DNA ABI 310 i zestawu ABI PRISM Big Dye Terminator Cycle Sequencing Ready Reaction Kit (Applied Biosystems) ze starterem forward, który został użyty podczas drugiej rundy PCR.
Badania histologiczne wątroby
Badania histologiczne wątroby zostały ocenione przez jednego patologa, który nie znał pochodzenia pacjentów. Martwicze zapalenie i zwłóknienie oceniano na podstawie stopnia martwiczego zapalenia Knodella (od 0 do 18)20 i stopnia zwłóknienia Ishaka (od 0 do 6),21 odpowiednio.
Barwienie immunohistochemiczne przeprowadzono zgodnie z opisem w innym miejscu.22. Krótko mówiąc, deparafinowane sekcje o grubości 5 μm inkubowano z monoklonalnym mysim anty-HBsAg (Clone 3E7, Dako Corp., Carpinteria, USA) i anty-HBcAg (Novocastra Laboratories, Newcastle, Wielka Brytania) przez noc w temperaturze 4 ° C. Optymalne rozcieńczenie anty-HBsAg lub anty-HBcAg zostało określone przy użyciu tkanki wątroby od nosiciela HBV jako kontroli pozytywnej. Do wykrywania powstałego kompleksu immunologicznego użyto zestawu StrAviGen Super Sensitive MultiLink Kit (BioGenex). Aktywność peroksydazy była wizualizowana za pomocą zestawu substratów aminoetylokarbazolowych (Zymed Laboratory, Inc, San Francisco, CA). Na koniec sekcje były barwione hematoksyliną. Jako kontrolę ujemną w inkubacji zamiast przeciwciała pierwotnego zastosowano nieimmunologiczną immunoglobulinę mysią. Wzorce ekspresji HBcAg w jądrze, cytoplazmie lub w obu tych miejscach były rejestrowane. Wzory ekspresji HBsAg zostały sklasyfikowane jako homogenne, typu I GGH, typu II GGH.22 Homogennie wybarwione hepatocyty zostały zidentyfikowane jako hepatocyty z umiarkowanym do silnego homogennego barwienia cytoplazmatycznego; typ I GGH został zidentyfikowany jako hepatocyty z gęstym zabarwieniem globularnym lub „inkluzyjnym”, a typ II GGH został zidentyfikowany jako hepatocyty z zabarwieniem antygenu powierzchniowego na krawędziach komórek lub na obrzeżach.6,22 GGH typu I są rozproszone pojedynczo lub skupiają się w zrazikach wątrobowych, podczas gdy GGH typu II konsekwentnie skupiają się w guzkach. Poziomy ekspresji HBcAg i HBsAg oceniano półilościowo na podstawie odsetka komórek znakowanych immunologicznie, w skali od 0 do 4+, co odpowiadało wartościom dodatnim w 0, 1-10, 11-25, 25-50% i ponad 50% badanych hepatocytów.
Analizy statystyczne
Dane wyrażono jako średnią ± odchylenie standardowe. Zmienne ciągłe porównywano za pomocą testu U Manna-Whitneya lub ANOVA Kruskala-Wallisa dla analizy jednoczynnikowej. Zmienne kategoryczne analizowano za pomocą testu χ2 lub dokładnego testu Fishera. Niezależne czynniki, które były związane z poziomem wewnątrzwątrobowej ekspresji HBsAg, analizowano za pomocą wieloczynnikowej analizy regresji logistycznej. Obsługa danych i analizy statystyczne zostały wykonane przy użyciu oprogramowania SPSS dla Windows, wersja 17.0 (SPSS Inc., Chicago, IL).
WynikiCharakterystyka włączonych pacjentów
Tabela 1 zawiera charakterystykę demograficzną 181 włączonych pacjentów. Większość pacjentów stanowili mężczyźni (69,1%), a 63,0% z nich wykazywało genotyp C HBV. Mutację precore A1896 wykryto u 20 pacjentów (11,0%), a mutacje BCP T1762/A1764 u 38 pacjentów (21,0%). Spośród 181 pacjentów dodatnie barwienie HB-sAg wykryto u 105 pacjentów (58,0%). Pacjenci z barwieniem HBsAg wykazywali znacząco wyższe stężenie HBsAg w surowicy (P
Charakterystyka kliniczna, wirusologiczna i histologiczna 181 pacjentów.
| Charakterystyka | Wartość | |||
|---|---|---|---|---|
| Wyrażenie HBsAg | Wartość P | |||
| Wszyscy pacjenci (n = 181) | Negatywni (n = 76) | Dodatni (n = 105) | ||
| Wiek (rr) ± SD | 36.4 ± 10.5 | 34.2 ± 9.2 | 38.0 ± 11.2 | 0.009 |
| Płeć (mężczyzna/kobieta) | 125/56 | 50/26 | 75/30 | 0.418 |
| Mean AST level (U/L) ± SD | 59.7 ± 51.2 | 58.7 ± 42.5 | 60.5 ± 56.8 | 0,634 |
| Mean ALT level (U/L) ± SD | 116,3 ± 124,2 | 120,2 ± 100,8 | 113,5 ± 139.1 | 0,282 |
| Genotyp HBV (B/C) | 114/67 | 66/10 | 48/57 | |
| Precore: G1896/A1896 | 20/161 | 13/63 | 7/98 | 0.027 |
| BCP:* mutant/wild | 38/143 | 12/64 | 26/79 | 0,144 |
| HBV DNA (log copies/mL) | 8,4 ± 1.1 | 4,0 ± 0,7 | 4,3 ± 0,7 | |
| Poziom HBsAg ((log IU/mL) | 4,2 ± 0.7 | 8.1 ± 1.0 | 8.6 ± 1.1 | 0.003 |
| Mean Knodell necroinflammation grade ± SD | 5.0 ± 3.0 | 5.3 ± 2.8 | 4.7 ± 3.0 | 0.128 |
| Mean Ishak fibrosis stage ± SD | 1.8 ± 1.6 | 1.7 ± 1.2 | 1.9 ± 1.7 | 0.703 |
Mutant, T1762 i A1764; wild, A1762 i T1764. Test χ2 zastosowano dla zmiennych płci, genotypu HBV, mutacji promotora precore i basal core, a test U Manna-Whitneya dla pozostałych zmiennych. AST: aminotransferaza asparaginianowa. ALT: aminotransferaza alaninowa. BCP: basal core promotor. HBV: wirus zapalenia wątroby typu B.
Wzory dystrybucji ekspresji HBsAg
W odniesieniu do 105 pacjentów, którzy wykazywali ekspresję HBsAg, jednorodny wzór (Figura 1A) wykryto u 34 (32.4%) pacjentów, typ I GGH (Figura 1B) został wykryty u 50 (47,6%), typ II GGH (Figura 1C) został wykryty u siedmiu (6,7%), a mieszany wzór został wykryty u 14 (13,3%). Jak wskazano w tabeli 2, wyższą częstość występowania mutacji BCP T1762/A1764 zaobserwowano w typie II GGH (P =0,001) w porównaniu z innymi wzorcami. Istniała wzajemna zależność między ekspresją HBsAg a markerami replikacji wirusowej w surowicy. Na rycinie 1D pokazano, że pacjenci z ekspresją typu II GGH mieli niższe poziomy DNA HBV i miana HBsAg, ale wyższe poziomy wewnątrzwątrobowej ekspresji HBsAg (Figura 1D). Poza tym, histologia wątroby wyświetlana typ II GGH wykazywała znacznie cięższe czynności martwiczo-zapalne wątroby i zwłóknienie, a także wyższy poziom wewnątrzwątrobowej ekspresji HBsAg (Figura 1E).
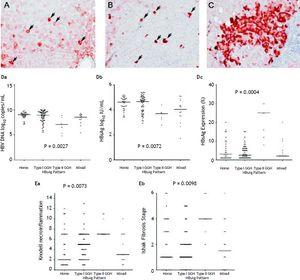
Charakterystyka demograficzna według wzorców dystrybucji f ekspresji HBsAg.
| HBsAg Pattern (n = 105) | |||||
|---|---|---|---|---|---|
| Mixed (n = 14) | Homogenous | Typ I GGH | Typ II GGH | Wartość P | |
| (n = 34) | (n = 50) | (n = 7) | |||
| Wiek (yr) ± SD | 36.3 ± 9.2 | 36.3 ± 10.0 | 39.2 ± 12.7 | 40.0 ± 7.9 | 0.104 |
| Płeć (mężczyzna/kobieta) | 11/3 | 26/11 | 35/15 | 6/1 | 0.720 |
| Mean AST level (U/L) ± SD | 64.9 ± 56.5 | 61.1 ± 38.6 | 49.9 ± 28.3 | 122.4 ± 168,7 | 0,474 |
| Mean ALT level (U/L) ± SD | 116,7 ± 112,4 | 114,6 ± 91,1 | 91,5 ± 63,8 | 259,1 ± 447.6 | 0,651 |
| Genotyp HBV (B/C) | 10/4 | 15/19 | 22/28 | 1/6 | 0,085 |
| Precore: G1896/A1896 | 0/14 | 3/31 | 4/46 | 0/7 | 0.594 |
| BCP:* mutant/wild | 4/10 | 4/30 | 12/38 | 6/1 | 0.001 |
| HBV DNA (log copies/mL) | 3.9 ± 1.0 | 4.5 ± 0,5 | 4,4 ± 0,7 | 3,6 ± 0,5 | 0,001 |
| Poziom HBsAg ((log IU/mL) | 8,2 ± 1.1 | 8,9 ± 0,7 | 8,7 ± 1,1 | 6,9 ± 1,5 | |
| Stopień nekroinflamacji węzłów chłonnych ± SD | 4.2 ± 2.9 | 4.2 ± 3.3 | 4.7 ± 2.7 | 8.6 ± 2.0 | 0.003 |
| Ishak fibrosis stage ± SD | 1,9 ± 1,9 | 1,9 ± 1,9 | 1,5 ± 1,3 | 4,1 ± 1,5 | 0.007 |
Mutant, T1762 i A1764; wild, A1762 i T1764. Test χ2 zastosowano dla zmiennych płci, genotypu HBV, mutacji promotora precore i basal core, a test U Manna-Whitneya dla pozostałych zmiennych. AST: aminotransferaza asparaginianowa. ALT: aminotransferaza alaninowa. BCP: basal core promotor. HBV: wirus zapalenia wątroby typu B.
Poziom ekspresji HBsAg
Rysunek 2A do 2D przedstawia ilustrację półilościowego pomiaru ekspresji HBsAg. W tym badaniu nie było pacjenta z ekspresją HBsAg w skali 4+. Zaobserwowano wzajemną zależność pomiędzy replikacją wirusa a histologią wątroby. Pacjenci ze skalą 2+/3+ ekspresji HBsAg mieli niższe miana HBsAg i poziomy HBV DNA, ale znacząco wyższy stopień nekroinflammation grade i fibrosis stage niż pacjenci ze skalą 1+ ekspresji HBsAg i ujemnym barwieniem HBsAg (Rycina 2E). Pacjenci, u których stwierdzono stopień nekroinflamacji Knodella ≥ 5 punktów lub stopień zwłóknienia Ishake’a ≥ 1, mieli istotnie wyższy odsetek ekspresji HBsAg (Figura 3).
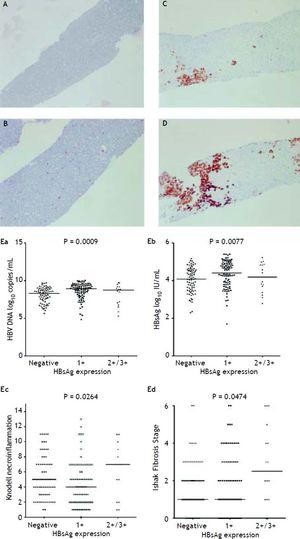

Kliniczne cechy ekspresji HBsAg
Po pierwsze, zbadaliśmy związek czynników wirusowych i ekspresji HBcAg/HBsAg. Ekspresja HBsAg, a nie ekspresja HBcAg, wykazywała znacząco niższy poziom w obecności mutacji precore (P = 0,001). Pacjenci z genotypem C wykazywali większe zaawansowanie włóknienia wątroby (P = 0,004). U pacjentów z mutacjami BCP T1762/A1764 stwierdzono istotnie większy stopień nekroinflamacji i stopień zwłóknienia, a także niższą ekspresję HBcAg zarówno w cytoplazmie, jak i w jądrze. Wszystkie te obserwacje wskazywały na aktywne uszkodzenie wątroby. Dodatkowo, pacjenci z mutacjami BCP T1762/A1764 wykazywali wyższą wewnątrzwątrobową ekspresję HBsAg (9,3 ± 8,0% vs. 4,3 ± 5,0%, P = 0,008) (Tabela 3). Ponadto zbadaliśmy czynniki, które mogą wiązać się z poziomem ekspresji HB-sAg. W tabeli 4, 16 pacjentów wykazywało 2+/3+ skalę ekspresji HBsAg i 1+ skalę w grupie 89 pacjentów. Analiza jednoczynnikowa wykazała, że 2+/3+ skala ekspresji HBsAg była związana z mutacjami BCP T1762/A1764 oraz bardziej nasilonym procesem martwiczo-zapalnym i włóknieniem wątroby. Wielowariantowa analiza regresji ujawniła, że mutacje BCP T1762/A1764 były niezależnym czynnikiem, który był związany z 2+/3+ skalami wewnątrzwątrobowej ekspresji HBsAg.
Kliniczne, wirusologiczne i histologiczne cechy pacjentów z lub bez mutacji wirusowych.
Mutant, T1762 i A1764; wild, A1762 i T1764. Test χ2 zastosowano dla zmiennych płci, genotypu HBV, mutacji promotora precore i basal core, a test U Manna-Whitneya dla pozostałych zmiennych. AST: aminotransferaza asparaginianowa. ALT: aminotransferaza alaninowa. BCP: basal core promotor. HBV: wirus zapalenia wątroby typu B.
Związek cech demograficznych i stopni ekspresji HBsAg.
| Univariate | Multivariate | ||||
|---|---|---|---|---|---|
| HBsAg expression, skala | 1+ (n = 89) | 2+/3+ (n = 16) | Wartość P | Odds ratio (95% CI) | P value |
| Age | 38.2 ±11.2 | 36.6 ±11.1 | 0.608 | 0,963 (0,903-1,026) | 0,242 |
| Płeć (mężczyzna/kobieta) | 63/26 | 12/4 | 1.000 | ||
| Poziom AST (U/L) | 55,0 ± 37,7 | 90,4 ± 113,2 | 0,234 | 1,026 (0,991∼1.063) | 0,142 |
| PoziomALT (U/L) | 103,3 ± 84,4 | 170,1 ± 297,2 | 0,386 | 0,991 (0,978∼1.005) | 0.216 |
| Genotyp HBV (B/C) | 42/47 | 6/10 | 0.589 | 0.994 (0.234∼4.231) | 0.994 |
| Mutacja prekursora A1896 (+/-) | 7/82 | 0/16 | 0,592 | 0,000 (0,000∼) | 0.999 |
| BCP:*mutant/dziki | 17/72 | 9/7 | 0,003 | 6,356 (1,204∼33,356) | 0.029 |
| Poziom HBsAg (log10IU/mL) | 4.3 ± 0.7 | 4.2 ± 0.8 | 0.180 | 2.096 (0.598∼7.349) | 0.247 |
| Serum HBV DNA (log10 kopii/mL) | 8,6 ± 1,1 | 8,1 ± 1,4 | 0,135 | 0,731 (0,386∼1,383) | 0.335 |
| Knodell necroinflammation grading | 4,4 ± 2,9 | 6,3 ± 3,3 | 0,027 | ||
| Ishak fibrosis stage | 1.7 ± 1,6 | 2,9 ± 2,1 | 0,041 | ||
| Ekspresja cytoplazmatyczna HBcAg (%) | 53.1 ± 25,8 | 52,3 ± 28,5 | 0,915 | ||
| HBcAg ekspresja jądrowa (%) | 14,4 ± 18,3 | 10.1 ± 19.3 | 0.389 | ||
Mutant, T1762 i A1764; wild, A1762 i T1764. Analiza jednoczynnikowa: test χ2 zastosowano dla zmiennych: płeć, genotyp HBV, mutacje promotora rdzenia precore i basal, a test U Manna-Whitneya dla pozostałych zmiennych. Analiza wieloczynnikowa: Analiza regresji logistycznej wyrażona jako Odds ratio z 95% przedziałem ufności i wartościami P. AST: aminotransferaza asparaginianowa. ALT: aminotransferaza alaninowa. BCP: promotor rdzenia podstawowego. HBV: wirus zapalenia wątroby typu B.
Dyskusje
Wewnątrzwątrobowa ekspresja HBsAg jest związana z różnymi etapami replikacji i ewolucją choroby podczas naturalnego przebiegu przewlekłego zapalenia wątroby typu B.7,10,23 Typ I GGH występuje głównie w fazie aktywnej zapalenia wątroby, natomiast typ II GGH głównie w fazie nieaktywnej lub marskości wątroby.8 W niniejszej pracy wykazano, że typ II GGH wiąże się z cięższym obrazem histologicznym wątroby, któremu towarzyszy znacząco niższe stężenie HBV DNA w surowicy i miano HBsAg oraz względnie wyższy poziom wewnątrzwątrobowej ekspresji HBsAg. Ta wzajemna zależność między histologią wątroby a replikacją HBV wskazywała, że występowanie GGH typu II może być markerem zaawansowanej choroby wątroby podczas ewolucji choroby w przewlekłym wirusowym zapaleniu wątroby typu B HBeAg dodatnim. Wykazano, że wzory ekspresji HB-sAg są związane z różnymi mutacjami wirusowymi, które mają wpływ na regulację replikacji HBV i defekt wydzielania antygenów powierzchniowych z hepatocytów.9,24 Typ II GGH konsekwentnie zawiera mutacje delecyjne Pre-S2, które zmniejszają syntezę środkowych białek powierzchniowych, a następnie powodują akumulację dużych białek powierzchniowych w hepatocytach i defekt wydzielania HBsAg.25 W tym badaniu przeprowadzono korelację surowicy HBsAg i HBV DNA między pacjentami z lub bez typu II GGH. Umiarkowaną korelację między tymi dwoma wskaźnikami replikacji HBV wykazano u pacjentów bez GGH typu II (r = 0,686, P 26,27 Delecja Pre-S może prowadzić do stresu ER i aktywować transdukcję sygnału związanego ze stresem. Oksydacyjne uszkodzenie DNA hepatocytów, a następnie pobudzenie mechanizmów naprawy DNA może skutkować niestabilnością genomową, która pogarsza uszkodzenie wątroby i predysponuje do kancerogenezy.28
Oprócz wzorców ekspresji HBsAg, stwierdziliśmy, że wyższym poziomom ekspresji towarzyszyły bardziej nasilone czynności histologiczne wątroby i wyższy wskaźnik mutacji BCP T1762/A1764. Mutacje BCP T1762/A1764 są silnie związane z ciężką aktywnością histologiczną wątroby i rakiem wątroby.29,30 Według naszej wiedzy istnieje silne powiązanie między genotypem C a obecnością mutacji BCP T1762 / A1764.30 W tym badaniu genotyp C wydawał się nie odgrywać żadnej roli w poziomie ekspresji HBsAg. Natomiast mutacje BCP T1762/A1764 wykazywały silny związek z ekspresją HBsAg. W odniesieniu do mutacji wirusowych, mutacje BCP T1762/A1764 mogą stanowić podstawę dla innych mutacji HBV, w tym delecji pre-S i złożonych mutacji często spotykanych w obecności mutacji BCP T1762/ A1764. Złożone mutacje HBV wykazywały częściowe lub całkowite defekty w ekspresji i sekrecji białek e, rdzeniowych i powierzchniowych.31 Zmniejszone wydzielanie antygenu powierzchniowego zapalenia wątroby typu B korelowało z nieprawidłową lokalizacją białek powierzchniowych w ER i skutkowało wysoką ekspresją HBsAg. Ponadto uważa się, że mutacja BCP T1762/A1764 jest konsekwencją sprawności wirusa z powodu presji selekcyjnej nadzoru immunologicznego gospodarza. Podobnie mutacje pre-S2, port w GGH typu II, pokrywają się z ograniczonymi do ludzkiego antygenu leukocytów epitopami limfocytów T i B.32 Wokół GGH typu II zwykle nie ma martwicy komórek ani nacieku limfocytów T, co sugeruje, że HBV z pojawieniem się mutacji delecyjnej pre-S2 jest również prawdopodobnie nową mutacją ucieczkową.33 Jednak akumulacja antygenu powierzchniowego w hepatocytach może się zdarzyć bez przenoszenia żadnej ze znanych mutacji wirusowych w genomach pre-S lub S lub w promotorach powierzchniowych.31,34 Dlatego ekspresja HBsAg może być sekwencją w połączeniu z mutacjami wirusowymi lub bez nich.
To badanie miało kilka potencjalnych ograniczeń. Obserwacje w tym badaniu były oparte na retrospektywnym projekcie przekrojowym, ale nie przeprowadzono podłużnej obserwacji. Poziom ekspresji HBsAg w hepatocytach i nasilenie histologiczne mogą się różnić w różnych częściach wątroby u jednego pacjenta; biopsja wątroby per se nie może dokładnie reprezentować żadnej tkanki wątroby, z wyjątkiem rdzenia biopsyjnego.
Podsumowując, pacjenci wykazali typ II GGH wzór lub wyższy poziom wewnątrzwątrobowej ekspresji HBsAg wykazał wzajemną zależność między bardziej surowymi działaniami histologicznymi wątroby i niższą zdolnością do replikacji HBV. Silny związek między wewnątrzwątrobową ekspresją HBsAg i mutacjami BCP T1762/A1764 wskazywał, że ekspresja HBsAg może być uważana za manifestację histologiczną podczas ewolucji genomu HBV pod presją immunologiczną gospodarza.
Skróty
- –
BCP: basal core promotor.
- –
GGH: ground glass hepatocyte.
- –
HBcAg: antygen rdzeniowy zapalenia wątroby typu B.
- –
HBeAg: antygen e zapalenia wątroby typu B.
- –
HBsAg: antygen powierzchniowy zapalenia wątroby typu B.
- –
HBV: wirus zapalenia wątroby typu B.
Konflikty interesów
T.-.T. C. otrzymał finansowanie badań od firm Gilead Sciences, Bristol-Myers Squibb Company, Glaxo-SmithKline, Merck Sharp & Dohme (I.A.) Corporation i Pfizer Inc. W przypadku pozostałych autorów nie występuje konflikt interesów.
.