W firmie Exelead podchodzimy do produkcji kontraktowej z ukierunkowaniem na preparaty liposomalne i PEGylowane, przeznaczone do leczenia rzadkich chorób oraz małych lub niezadłużonych populacji. Specjalizujemy się w opracowywaniu i wytwarzaniu leków pozajelitowych na bazie lipidów, a nasz zespół ma ponad 20-letnie doświadczenie w pracy z wieloma klientami z branży przedklinicznej, klinicznej i komercyjnej.
Czym są liposomy i jak są wykorzystywane w dostarczaniu leków?
Liposomy są wyspecjalizowanymi nośnikami leków, które pełnią wiele funkcji w zwiększaniu możliwości aktywnych składników farmaceutycznych (API). Po pierwsze, mogą one chronić lek przed wykryciem przez układ odpornościowy organizmu, naśladując błony biologiczne i dając lekowi więcej czasu na dotarcie do miejsca przeznaczenia. Po drugie, pomagają one w rozpuszczaniu wysoce lipofilnych cząsteczek leków lub modulują farmakokinetykę i biodystrybucję API, pomagając w ten sposób zminimalizować efekty uboczne i poprawić profil bezpieczeństwa produktu.
Liposomy posiadają unikalną strukturę pęcherzykową. Pęcherzyki te składają się z dwuwarstwy lipidowej, która tworzy się w kształcie wydrążonej kuli obejmującej fazę wodną. Jako taki, każdy interesujący nas ładunek może być zamknięty w liposomach w przedziale wodnym (jeśli jest rozpuszczalny w wodzie/hydrofilny) lub w dwuwarstwie lipidowej (jeśli jest rozpuszczalny w tłuszczach/lipofilny).
Niektóre z podstawowych lipidów używanych do wytwarzania liposomów to fosfolipidy i sfingolipidy. Te dwie kategorie lipidów są unikalne pod względem grupy głównej, która jest kochająca wodę / hydrofilowe i grupy ogonowej, która jest nienawidząca wody / lipofilowe. Ze względu na ich amfifilową naturę, cząsteczki te spontanicznie samoistnie łączą się w liposomy i inne unikalne struktury 3D po dodaniu do roztworów wodnych. Kształt lub morfologia struktur 3D zależy od wielu różnych czynników – na przykład od składu lipidów, temperatury, pH lub obecności innych buforów, soli i cukrów w wodzie.

Image Source: Chem Libre Texts
Jak lek wchodzi w interakcje z organizmem i staje się dostępny do użycia, gdy jest sformułowany jako liposomalny produkt leczniczy?
W ostatnich latach liposomy przyciągnęły znaczną uwagę jako zaufana klasa pojazdów do dostarczania leków. Ich samozamykające się struktury mogą enkapsulować wiele leków jednocześnie, chroniąc zamknięty ładunek przed hydrolizą i rozpadem. Dodatkowo, białka celujące i powierzchniowe ligandy funkcjonalne na zewnętrznej powłoce dwuwarstwy lipidowej mogą dodać nową funkcjonalność – umożliwiając ukierunkowane wejście liposomów do komórek, albo poprzez przeciwciała, albo ligandy celowane w receptory. Ligandy te przyłączają się do receptorów komórkowych, które są nadmiernie eksprymowane w niektórych chorych komórkach, umożliwiając wprowadzenie leku przez błonę komórkową.
„Liposomy chronią załadowane cząsteczki leku przed zewnętrzną degradacją, a ich podobieństwo do błon biologicznych zapewnia unikalne możliwości dostarczania cząsteczek leku do komórek lub przedziałów subkomórkowych … Ponadto, różne właściwości fizykochemiczne liposomów – w tym ich rozmiar, ładunek i powierzchniowe ligandy funkcjonalne – mogą być zmieniane, co skutkuje funkcjonalnościami sprzyjającymi specyficznym zadaniom dostarczania leków. Zalety te uczyniły z liposomów wiodącą platformę dostarczania leków o szerokim zakresie zastosowań w klinice.”
– Liposomopodobne nanostruktury do dostarczania leków | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Typowo, liposomy są produkowane jako sterylne materiały do wstrzykiwania w celu dostarczenia do krwiobiegu, a uwolnienie leku następuje, gdy lipidowe otoczki rozpadają się – co może się zdarzyć w środowisku zewnątrzkomórkowym lub wewnątrzkomórkowym.
Różne strategie zostały zastosowane do zaprojektowania konwencjonalnych liposomów z możliwością uwalniania wyzwalanego, zwiększając skuteczność terapeutyczną poprzez spowodowanie, że liposomy uwalniają zamknięty w nich API lub „ładunek” na podstawie odpowiedzi na bodziec. Uwalnianie to następuje albo w wyniku konwencjonalnego rozpadu liposomów, albo pod wpływem aktywnych bodźców i wskazówek środowiskowych, w tym energii cieplnej, gradientu pH i naprężeń ścinających.1
Formuły przeznaczone do uwalniania w środowiskach wewnątrzkomórkowych mogą zawierać lipidy wrażliwe na pH, które zmieniają strukturę liposomalną lub ulegają degradacji w przedziałach kwaśnych, umożliwiając uwalnianie zamkniętego w nich leku. Alternatywnie, termoczułe lub światłoczułe składniki są czasami włączone, aby umożliwić rozpad i modulację struktury w wyniku zmian temperatury lub reakcji na światło o określonej długości fali.
Liposomopodobne nośniki leków mogą występować w wielu różnych odmianach, wykazując szeroki zakres właściwości biochemicznych i biofizycznych. Chociaż jest to korzystne i umożliwia tym cząsteczkom opartym na lipidach przyjęcie użytecznych zastosowań w setkach różnych warunków, liczba potencjalnych odmian sprawia, że konieczna jest rygorystyczna kontrola produkcji.2
Exelead produkuje leki oparte na lipidach od wczesnych lat 90-tych, zaczynając od Abelcetu. Amfoterycyna B, aktywny składnik leku Abelcet, jest przechowywana w kompleksie lipidowym i selektywnie łączy się z błonami grzybów, aby dotrzeć do komórek chorobowych.
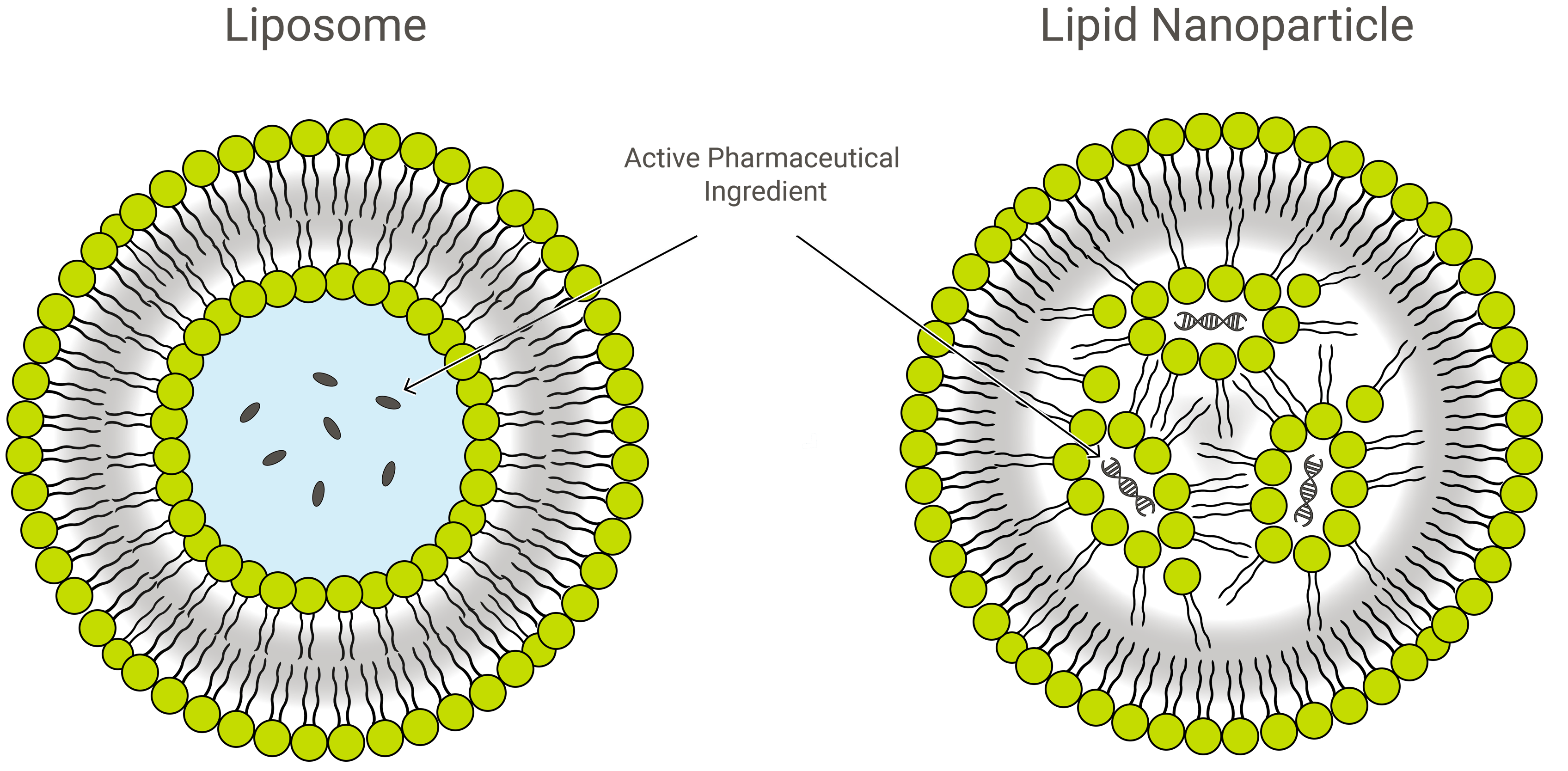
Liposomy a nanocząstki lipidowe
Liposomy i nanocząstki lipidowe (LNP) są podobne pod względem budowy, ale różnią się nieco składem i działaniem. Oba są nanoformulacjami lipidowymi i doskonałymi nośnikami leków, transportującymi interesujący nas ładunek wewnątrz ochronnej, zewnętrznej warstwy lipidów. Jednak w zastosowaniu LNP mogą przybierać różne formy.
LNP są strukturami podobnymi do liposomów, szczególnie ukierunkowanymi na enkapsulację szerokiej gamy kwasów nukleinowych (RNA i DNA); i jako takie, są one najpopularniejszym niewirusowym systemem dostarczania genów. Exelead opracowuje i wytwarza LNP do enkapsulacji różnych typów ładunków genetycznych, w tym siRNA, mRNA i saRNA.
Tradycyjne liposomy zawierają jeden lub więcej pierścieni dwuwarstwy lipidowej otaczającej kieszeń wodną, ale nie wszystkie LNP mają przylegającą dwuwarstwę, która kwalifikowałaby je jako pęcherzyki lipidowe lub liposomy. Niektóre LNP przyjmują strukturę podobną do miceli, zamykając cząsteczki leku w niewodnym rdzeniu.
PEGylacja LNP i struktur dostarczania leków podobnych do liposomów
LNP składają się głównie z lipidów kationowych (patrz terapia genowa poniżej) wraz z innymi składnikami lipidowymi. Obejmują one zazwyczaj neutralne cząsteczki fosfolipidowe należące do klasy fosfatydylocholiny (PC) i sterole, takie jak cholesterol. Innym powszechnym składnikiem lipidowym jest to, co jest znane jako PEGylowany fosfolipid – polimer glikolu polietylenowego (PEG) kowalencyjnie przyłączony do grupy głównej fosfolipidu.

PEGylowane fosfolipidy są stosowane w wielu nośnikach leków opartych na lipidach przede wszystkim dlatego, że oferują to, co jest znane jako efekt ukrycia produktu leczniczego, gdy krąży on w organizmie. Ludzki układ odpornościowy jest napędzany do ochrony organizmu przed wszelkimi obcymi obiektami, a nanocząstki lecznicze nie są tu wyjątkiem. Aby pomóc w wydajności dostarczania i umożliwić więcej czasu obiegu dla cząsteczek ładunku, aby dotrzeć do zamierzonych miejsc choroby, PEG jest dodawany do osłony tych nanocząstek poprzez zapobieganie wchłanianiu białek osocza krwi do powierzchni liposomów, zwiększając czas życia obiegu krwi.1
Drugą korzyścią z PEGylacji jest zwiększenie stabilności dla liposomów jak nanostruktur. Konwencjonalne liposomy, szczególnie te mniejsze niż 200 nm, mogą być niestabilne same w sobie i mają tendencję do łączenia się ze sobą w celu zmniejszenia napięcia powierzchniowego. Może to powodować utratę zamkniętego w nich leku lub niekorzystne mieszanie się ładunków z różnych pęcherzyków. Jednym ze sposobów, w jaki producenci leków nauczyli się przezwyciężać ten problem, jest pokrycie zewnętrznej strony liposomów polimerami takimi jak PEG.
Te nanocząsteczki wyposażone w technologię „stealth-equipped” doprowadziły do powstania nowej generacji preparatów liposomalnych i wielu zatwierdzonych klinicznie produktów. PEGylowane liposomy i LNP są obecnie nowym paradygmatem dla większości terapii przeciwnowotworowych.
LNP w terapii genowej
Przez długi czas najskuteczniejszym sposobem dostarczania do ludzkich komórek leków opartych na genach było wykorzystanie wirusa, który został zmodyfikowany tak, aby przenosił ładunek leczniczy, a nie szkodliwe, samoreplikujące się geny. Metoda ta jest nadal sporadycznie stosowana i określa się ją mianem wirusowego dostarczania genów. Niewirusowe dostarczanie genów stało się jednak popularne w ciągu ostatnich 20 lat ze względu na zwiększony profil bezpieczeństwa, niższy odsetek niepożądanych reakcji immunogennych i łatwość produkcji. Jedną z głównych sił napędowych tego ruchu był rozwój nośników opartych na lipidach i polimerach, z których najbardziej popularne są LNP.
LNPs stosowane do dostarczania genów są głównie syntetyzowane przy użyciu kationowych, lub dodatnio naładowanych, lipidów, które łączą się z anionowymi, lub ujemnie naładowanymi, kwasami nukleinowymi. Inne składniki oparte na lipidach mogą być również dodawane w celu modulowania wydajności dostarczania i lokalizacji uwalniania ładunku genetycznego. LNPs zapewniają również stabilność mechaniczną, kontrolowaną morfologię i wąski rozkład wielkości.1
Materiały nieorganiczne, organiczne i hydrożele były badane jako rdzenie nanocząstek liposomalnych, zamknięte w różnej liczbie warstw lipidowych, które tworzą powłokę. Jedna z najbardziej udanych odmian tych hybrydowych nanocząstek zawiera polimery PLA lub PGLA w monowarstwie lipidowej. Te dwa podstawowe biopolimery są szczególnie przydatne w dostarczaniu leków, ponieważ ułatwiają kontrolowane uwalnianie leków.1

Przedstawiona powyżej formulacja nanocząstek jest hybrydą lipidowo-polimerową z hydrofobowym rdzeniem PGLA i hydrofilową powłoką lipidowo-PEG.
Rozwijająca się dziedzina
„Liposomy przeszły długą drogę, aby stać się klasą zatwierdzonych nośników leków… Opracowywana jest coraz większa różnorodność liposomopodobnych nanostruktur, z których każda ma unikalne właściwości odpowiednie do określonych zadań związanych z dostarczaniem leków. Tymczasem zrozumienie interakcji pomiędzy tymi nanostrukturami a systemami biologicznymi jest szybko postępujące. Uzyskano znaczną ilość informacji na temat czasu ich krążenia, akumulacji w tkankach i potencjalnej toksyczności. Jest pewne, że liposomopodobne nanonośniki będą odgrywały większą rolę w dostarczaniu leków w przewidywalnej przyszłości.”
– Liposomopodobne nanostruktury do dostarczania leków | Gao W, Hu C-MJ, Fang RH, Zhang L 1
Pomimo, że trwają znaczące prace nad rozwojem środków leczniczych o kontrolowanym uwalnianiu, nanokompartmentalizowanych, liposomy i LNPs są szczególnie obiecującymi opcjami. Struktury te zapewniają unikalną, naturalnie stabilną, podobną do komórek morfologię dla nanomedycyny i są przygotowane do postępu w kierunku bardziej zaawansowanych strategii terapeutycznych. Firma Exelead podejmuje takie wyzwania, w tym rozwój nanożeli, które zawierają szereg leków biologicznych i małych cząsteczek.
Odkąd liposomy zostały po raz pierwszy zaproponowane jako system dostarczania leków w późnych latach 60-tych, pojawiły się różne warianty struktury i funkcjonalności, zapewniając cenny postęp w zakresie ukierunkowania na choroby. Leki LNP pojawiły się w całym przemyśle farmaceutycznym jako terapie zaprojektowane do dostarczania środków przeciwnowotworowych, antybiotyków, leków genowych, środków znieczulających i przeciwzapalnych.3
„W zastosowaniach klinicznych leki liposomalne okazały się najbardziej przydatne ze względu na ich zdolność do „pasywnego” gromadzenia się w miejscach o zwiększonej przepuszczalności naczyń, gdy ich średnia średnica jest w zakresie ultrafiltracyjnym (<200 nm średnicy), a także ze względu na ich zdolność do zmniejszania działań niepożądanych leków enkapsulowanych w stosunku do leków wolnych. Doprowadziło to do ogólnego wzrostu indeksu terapeutycznego, który mierzy skuteczność nad toksycznością.”
– Liposomalne systemy dostarczania leków: od koncepcji do zastosowań klinicznych | Allen TM, Cullis PR 3
Zastosowania w medycynie spersonalizowanej – nowa era w strategiach terapeutycznych
W przeciwieństwie do tradycyjnego, big-pharma podejścia do leczenia chorób, medycyna spersonalizowana bierze pod uwagę indywidualne różnice w stylu życia, środowisku i biologii – w tym genetykę pacjenta.
Ma to ogromne zastosowanie w przypadku chorób takich jak nowotwory. Nawet w obrębie jednego rodzaju nowotworu, typy guzów różnią się u poszczególnych pacjentów, a zrozumienie konkretnej mutacji genetycznej, którą rozwinął dany pacjent, pozwala lekarzom na zastosowanie bardziej specyficznego i precyzyjnego leczenia.4
Dzięki pojawieniu się spersonalizowanych terapii genetycznych, lekarze i naukowcy mogą skutecznie dostosować aktywny składnik farmaceutyczny – często RNA lub DNA – do konkretnego profilu choroby danego pacjenta lub małej grupy pacjentów. To podejście do hiperspecyficznego ukierunkowania na chorobę zwiększa skuteczność i zmniejsza niepożądane efekty uboczne w grupach podobnych pacjentów.
LNP jako nośniki oligonukleotydów
Ponieważ tak wiele z rozwijającej się dziedziny medycyny spersonalizowanej skupia się na terapiach genetycznych, LNP stały się szczególnie użyteczne jako platformy dostarczania leków. Każdy oligonukleotyd mógłby teoretycznie zostać zamknięty w liposomie lub LNP, ale siRNA są obecnie najczęstszym ładunkiem w tego typu produktach leczniczych.
Teoretycznie segmenty siRNA można zaprojektować tak, aby wyciszyć dowolny gen, co jest ekscytującą koncepcją zarówno dla lekarzy, jak i badaczy. Niestety, dostarczanie wolnego, niekapsułkowanego RNA do ludzkich komórek jest trudne, ponieważ są one duże, niestabilne w surowicy i podatne na degradację przez nukleazy.5
Choć badacze podejmowali próby ustabilizowania siRNA w surowicy poprzez dodanie wiązań fosforoetionowych, do skutecznego wyciszenia genów u ludzi wymagane są wysokie dawki. LNPs stanowią rozwiązanie tego problemu, zapewniając elastyczne i łatwe sposoby enkapsulacji, chroniąc segmenty siRNA do momentu dotarcia do miejsca przeznaczenia i ułatwiając ich dostarczenie do komórek docelowych.5
„LNPs zawierające jonizowalne lipidy kationowe posiadają szereg cech niezbędnych do ogólnoustrojowego dostarczania kwasów polinukleinowych, w tym małe rozmiary, stabilność w surowicy, niski powierzchniowy potencjał zeta przy fizjologicznym pH i ładunek kationowy przy kwaśnych wartościach pH (np. w endosomach). Ponadto, wykorzystując procesy „endogennego” ukierunkowania dzięki asocjacji z ApoE po podaniu, można uzyskać wysoce wydajny wychwyt do hepatocytów po podaniu i.v., co prowadzi do doskonałych możliwości wyciszania genów.”
– Lipidowe systemy dostarczania nanocząstek dla terapii opartych na siRNA | Wan C, Allen TM, Cullis PR 5
Mniejsze rozmiary partii
Spersonalizowane produkty lecznicze są często wytwarzane w małych partiach dla pojedynczych pacjentów lub małych populacji i często mogą skutkować mniej niż jednym litrem produktu. W przeciwieństwie do tego, tradycyjne partie produkcyjne głównych farmaceutyków często wytwarzają tysiące litrów produktu na skalę. Medycyna spersonalizowana wymaga wyjątkowego podejścia, a każda partia musi być wytwarzana w rygorystycznych warunkach cGMP.
Ponieważ medycyna spersonalizowana stała się jednym z głównych obszarów rozwoju leków, wiele firm z branży farmaceutycznej dostosowało swoje linie produkcyjne tak, aby oprócz tradycyjnej produkcji leków na dużą skalę, były w nich wytwarzane mniejsze partie przeznaczone dla małych grup pacjentów.
W firmie Exelead dołożono wielu starań, aby dostosować się do tych małoseryjnych terapii, które często wymagają drogich interfejsów API i szybkiego czasu realizacji. Leki specyficzne dla pacjenta lub antygenu nie pozostawiają wiele czasu od momentu sekwencjonowania oligonukleotydu do momentu, gdy produkt musi zostać opracowany w naszym zakładzie. Te krótkoterminowe prognozy, czasami tylko sześciotygodniowe, stanowią wyzwanie, które udało nam się pokonać dzięki udoskonaleniu naszych istniejących systemów i wprowadzeniu innowacyjnych technik formulacji.
Wszechstronne zastosowania
Mimo że medycyna spersonalizowana ma potencjał leczenia niemal każdej choroby, obecne badania skupiają się głównie na 1) immunoterapiach, 2) konwencjonalnych terapiach wzbogaconych o farmakogenomikę oraz 3) terapiach nowotworowych związanych z biomarkerami. Liposomy i LNPs mają zastosowanie jako nośniki dla każdej z tych kategorii produktów leczniczych, co czyni je niezbędnym atutem w tej nowej dziedzinie rozwoju farmaceutycznego.

Artykuły referencyjne
- Gao W, Hu C-MJ, Fang RH, Zhang L. Liposome-like Nanostructures for Drug Delivery. Journal of materials chemistry B, Materials for biology and medicine. 2013;1(48):10.1039/C3TB21238F. doi:10.1039/C3TB21238F.
- Kraft JC, Freeling JP, Wang Z, Ho RJY. Emerging Research and Clinical Development Trends of Liposome and Lipid Nanoparticle Drug Delivery Systems. Journal of pharmaceutical sciences. 2014;103(1):29-52. doi:10.1002/jps.23773.
- Theresa M. Allen, Pieter R. Cullis. Liposomalne systemy dostarczania leków: Od koncepcji do zastosowań klinicznych. Advanced Drug Delivery Reviews. 2013 Jan;65(1):36-48
- Esposito L. What Does Personalized Medicine Really Mean? US News: Health Care. 2018 Jan;
- Wan C, Allen TM, Cullis PR. Lipidowe systemy dostarczania nanocząstek dla terapii opartych na siRNA. Drug Deliv Transl Res. 2014 Feb;4(1):74-83. doi: 10.1007/s13346-013-0161-z.
- Vogenberg FR, Isaacson Barash C, Pursel M. Personalized Medicine: Part 1: Evolution and Development into Theranostics. Pharmacy and Therapeutics. 2010;35(10):560-576.