US Pharm. 2012;37(5):HS-2-HS-7.
Ból jest najczęstszym powodem, dla którego ludzie szukają pomocy medycznej.1W niedawnym badaniu oszacowano, że ból dotyka dziesiątki milionów Amerykanów i kosztuje Stany Zjednoczone 635 miliardów dolarów rocznie z powodu zwiększonej konsumpcji opieki medycznej i kosztów pośrednich wynikających z opuszczonych dni pracy i utraty produktywności.2 Leczenie przewlekłego bólu za pomocą leków takich jak opioidy jest powszechną strategią, ale przewlekły ból może utrzymywać się lub pogarszać pomimo agresywnej terapii opioidowej. Niniejszy artykuł ma na celu rzucenie światła na zjawisko opioidów, które są przepisywane w celu leczenia bólu, ale powodują nowy lub paradoksalnie pogarszający się ból.Ten stan nazywamy hiperalgezją indukowaną opioidami (OIH). OIH może być bardziej formalnie zdefiniowana jako zwiększona wrażliwość nocyceptywna spowodowana ekspozycją na opioidy.3OIH różni się od tolerancji, uzależnienia, współuzależnienia i progresji choroby. Częstość występowania klinicznego OIH jest nieznana.4
Diagnostyka i prezentacja
Jednym z głównych problemów w prawidłowym rozpoznaniu OIH jest bliskie podobieństwo tego stanu do tolerancji na opioidy. Tolerancja i OIH charakteryzują się zmniejszoną odpowiedzią analgetyczną na dawkę opioidu i prawdopodobnie mają wiele takich samych mechanizmów komórkowych.5 Tolerancję można przezwyciężyć przez zwiększenie dawki opioidu, podczas gdy takie samo zwiększenie dawki u pacjenta z OIH powoduje pogorszenie bólu.4 Dodatkowo tolerancja ma tendencję do powolnego rozwijania się w czasie, podczas gdy zwiększenie bólu wynikające z leczenia opioidami u pacjenta z OIH następuje stosunkowo szybko. Często OIH różni się od tolerancji tym, że natężenie bólu jest silniejsze niż początkowo zgłaszane.6
Ból nieleczony jest kolejną możliwością, którą należy wykluczyć. Jeśli terapia opioidowa jest suboptymalna, zwiększenie dawki powinno prowadzić do złagodzenia bólu; w przypadku obecności OIH powinno być odwrotnie. Aby postawić trafne rozpoznanie OIH, ból musi ustąpić po zaprzestaniu leczenia opioidem.6 Aby jeszcze bardziej skomplikować sprawę, hiperalgezja wynikająca z odstawienia opioidów jest zjawiskiem dobrze udokumentowanym.7 W związku z tym ustąpienie bólu po odstawieniu opioidów w OIH nie będzie natychmiastowe i będzie wymagało cierpliwości. Stanowi to wyzwanie zarówno dla klinicysty, jak i pacjenta.
OIH ma tendencję do występowania z innymi odrębnymi cechami (TABELA 1).Ból związany z OIH ma tendencję do bycia bardziej rozproszonym i o mniejszej jakości, a bodźce toksyczne mają tendencję do bycia bardziej bolesnymi niż normalnie można by się spodziewać. W OIH ból często pojawia się w obszarach wykraczających poza obszar urazu lub uszkodzenia tkanek. Ból może utrzymywać się w OIH pomimo usunięcia pierwotnego źródła bólu lub wygojenia się uszkodzonej tkanki.W OIH, w miarę postępu leczenia opioidami, ból może dawać złudzenie pogorszenia się w stosunku do pierwotnie zgłaszanego, pomimo upływu czasu, odpoczynku i innych środków, które normalnie pozwoliłyby na uzyskanie klinicznie istotnej ilości wyleczenia.5 Dodatkowo, allodynia została wykazana w wielu badaniach nad OIH u ludzi i zwierząt.8

Etiologia
Istnieje wiele teorii dotyczących przyczyny OIH. Teoria, która była najczęściej badana i obecnie otrzymuje najwięcej uwagi, to model neuroekscytacyjny. Uważa się, że niektóre opioidy i ich metabolity agonizują receptor N-metylo-D-asparaginianu(NMDA). Aktywacja receptora NMDA powoduje napływ wapnia, który znacznie zwiększa pobudliwość neuronu. Kiedy receptor NMDA i odpowiadające mu neurony są bardziej aktywne, mogą łatwiej przekazywać impulsy bólowe inicjowane przez krążącą substancję lub inne szkodliwe bodźce. Glutaminian jest podstawowym endogennym agonistą receptora NDMA.9
Poparciem tej teorii pronocycepcji modulowanej przez aktywację receptora NMDA są badania wykazujące złagodzenie OIH po podaniu antagonistów receptoraNMDA. Antagoniści ci wiążą się niekompetycyjnie z miejscem fencyklidynowym na kanale NMDA i blokują napływ wapnia, który wystąpiłby, gdyby receptor związał glutaminian lub innego antagonistę.10 W badaniach na zwierzętach i ludziach wykazano, że osoby z OIH, którym podawano ketaminę, antagonistę receptora NMDA, uzyskiwały lepsze wyniki podczas kontrolowanych testów bodźców bólowych. W jednym z badań szczurom podawano morfinę doogonowo przez kilka dni, aż do wystąpienia u nich OIH wrażliwego na ciepło. Podanie dizokilpiny, inhibitora NMDA, było skuteczne w przynajmniej częściowym odwróceniu hiperalgezji termicznej.5 Inni antagoniści receptora NMDA, tacy jak dekstrometorfan, wykazali pewne dowody na łagodzenie stanów hiperalgezji poprzez hamowanie receptora NMDA.
Opioidy, takie jak kodeina, hydromorfon i morfina, przechodzą szereg biotransformacji w ramach normalnego procesu metabolicznego.Kodeina jest metabolizowana do morfiny przez enzym CYP2D6. Morfina jest metabolizowana do wielu cząsteczek, ale jest metabolizowana głównie poprzez glukuronidację do morfino-3-glukuronidu (M3G) i, w mniejszym stopniu, do morfino-6-glukuronidu (M6G) (RYSUNEK 1).11
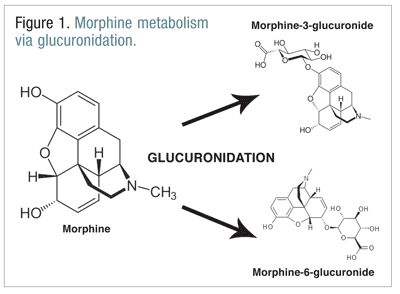
M6G jest metabolitem o znaczeniu terapeutycznym. Ma powinowactwo do receptora mu podobnego do morfiny i jest w stanie wywołać analgezję, depresję oddechową i inne efekty podobne do tych, które wywołuje morfina. M3G nie jest jednak agonistą receptora mu, a jego powinowactwo do receptora mu jest niewielkie w porównaniu z morfiną. W przeciwieństwie do morfiny, M6G i innych opioidów, M3G jest agonistą NMDA. W wyniku glukuronidacji M3G jest przekształcany z szybkością około sześciokrotnie większą niż M6G.12 Inne opioidy mają aktywność agonisty NMDA i paradoksalne działanie neuropobudzające.6
Potwierdzeniem teorii, że OIH jest spowodowana aktywnością receptorów poza receptorem opioidowym mu, są dowody na to, że OIH nie ustępuje po podaniu antagonisty opioidowego (np. naloksonu). U pacjentów doświadczających OIH podczas leczenia dużymi dawkami opioidów podanie naloksonu spowodowało nasilenie bólu.13 Wypierając opioid z receptora mu, nalokson uniemożliwił opioidowi zapewnienie analgezji, która była możliwa dzięki aktywacji receptora mu, a jednocześnie hiperalgezja pozostała niezagrożona.14
Dynorfina może być również zaangażowana w rozwój OIH.15Dynorfina jest endogennym peptydem opioidowym, który wiąże się przede wszystkim z receptorem opioidowym kappa oraz, w mniejszym stopniu, z receptorami opioidowymi mu i NMDA. Uważa się, że agonizm receptora opioidowego kappa i receptora NMDA przez dynorfinę odgrywa rolę w pronocycepcji OIH, pomimo obecności czystych agonistów receptora mu. Badania wykazały, że odwrócenie działania dynorfiny może przywrócić analgetyczne działanie morfiny, gdy badanym podaje się antiserum dynorfiny. Ponadto wiadomo, że dynorfina zwiększa się podczas długotrwałego podawania opioidów. Dynorfina powoduje również uwalnianie pobudzających neuropeptydów w różnych lokalizacjach ośrodkowego układu nerwowego.
Opcje leczenia
Po postawieniu diagnozy OIH istnieje szereg opcji leczenia, z których należy starannie wybierać. Zakładając, że początkowy bolesny uraz lub uszkodzenie tkanek ustąpiły, a ból utrzymuje się pomimo – i z powodu – leczenia opioidami, najprostszym podejściem jest odstawienie szkodliwego opioidu. Należy to robić stopniowo, aby zminimalizować niepożądane efekty odstawienia. Należy zauważyć, że hiperalgezja może się prawdopodobnie nasilić na początku procesu odstawiania.16 Stanowi to wyzwanie etyczne, w którym klinicysta może mieć trudności z przekonaniem pacjenta, że lek przepisany w celu leczenia bólu mógł spowodować lub nasilić ból i że ból może się jeszcze nasilić, zanim ostatecznie ustąpi.17
Jeśli uzasadniony ból utrzymuje się i wymagana jest pewna analgezja opioidami, należy rozważyć inne strategie poza całkowitym odstawieniem opioidów. Pacjenci doświadczający OIH mogą uzyskać ulgę przez zmniejszenie dawki opioidu.4 Istnieją doniesienia o pacjentach, którzy po zmniejszeniu dawki opioidu znaleźli akceptowalną równowagę między analgezją a ulgą od hiperalgezji.
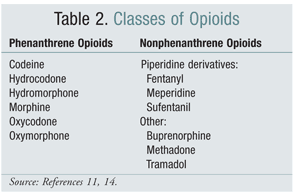
Zamiana jednej strukturalnej klasy opioidów na inną była w niektórych badaniach skuteczną opcją łagodzenia OIH. Dotychczasowe badania wykazały, że OIH jest silniej związana z opioidami z klasy fenantrenów (TABELA 2).4 Miareczkowanie opioidu fenantrenowego i zamiana na inny może rozwiązać problem OIH. Kodeina, hydromorfon, morfina i podobne strukturalnie opioidy podlegają glukuronidacji w ramach ich metabolizmu. Uniknięcie metabolitu glukuronidu aktywującego receptor NMDA jest możliwe poprzez przejście na opioid, który jest strukturalnie unikalny, taki jak fentanyl. W chwili pisania tego tekstu nie wykazano OIH w badaniach z udziałem oksymorfonu.4
Uzupełnienie terapii opioidowej inhibitorem cyklooksygenazy 2 (COX-2) to kolejna strategia, która ma pewne poparcie. Poprzez zmniejszenie syntezy prostaglandyn, inhibitory COX-2 mogą zmniejszyć sensytyzację neuronów pronocyceptywnych. Niesteroidowe leki przeciwzapalne (NLPZ) i inhibitory COX-2 wydają się mieć działanie przeciwbólowe niezależne od ich zdolności do obwodowego hamowania syntezy prostaglandyn.9 Inhibitory COX-2 wykazały również zdolność do antagonizowania receptora NMDA. Ośrodkowo NLPZ są w stanie antagonizować receptor NMDA poprzez blokowanie glutaminianu, substancji P i innych aminokwasów pobudzających. Niezależnie od tego, aktywacja receptora NMDA może zwiększać ekspresję COX-2.18
Biorąc pod uwagę uwagę uwagę uwagę, jaką receptor NMDA otrzymał za swoją rolę w OIH, antagonizowanie tego receptora wydaje się być rozsądną strategią leczenia. Ketamina była przedmiotem wielu badań, ale jej działania niepożądane mogą być poważne. Chociaż antagonizuje NMDA i zapewnia efekt znieczulający, który sprzyja analgezji, działania niepożądane są częste, różnorodne i poważne.19 Obejmują one tachyarytmię, nadciśnienie tętnicze, zaburzenia poznawcze i reakcje psychomimetyczne, w tym zmiany nastroju, żywe sny, delirium, halucynacje i sedację. Ketamina jest skuteczna w odwracaniu hiperalgezji i zwiększaniu działania opioidów u pacjentów otrzymujących duże dawki, ale jej działania niepożądane uniemożliwiają jej zastosowanie w leczeniu.
Dekstrometorfan jest kolejnym antagonistą receptora NMDA, który był badany w leczeniu OIH. Badano produkt łączony zawierający mieszaninę morfiny i dekstrometorfanu w proporcji 1:1.20Badania nie wykazały, że terapia łączona może zapewnić większą analgezję w porównaniu z samą morfiną. Podobne niepowodzenie terapii wystąpiło w badaniu, w którym stosowano mieszaninę 2:1 tych samych środków.Badania te krytykowano za zbyt małą ilość dekstrometorfanu, aby odpowiednio antagonizować receptor NMDA.21Nie wiadomo, jaka dawka dekstrometorfanu jest konieczna, aby albo wzmocnić analgezję opioidów, albo zapobiec OIH spowodowanej aktywacją receptora NMDA.
Metadon jest opioidem o wyjątkowych właściwościach, które sprawiają, że jest on doskonałą opcją w leczeniu bólu u pacjentów z OIH. Poza działaniem przeciwbólowym poprzez wiązanie się z receptorem opioidowym mu, metadon jest słabym antagonistą receptora NMDA.4 Odnotowano, że dodanie nawet małej dawki metadonu było skuteczne w zmniejszaniu hiperalgezji. W jednym przypadku dodanie metadonu w małej dawce (10 mg dwa razy dziennie) znacznie poprawiło odczuwanie bólu, przy zmniejszeniu całkowitej dawki opioidów o 40% do 50%.22Popularyzowaną strategią leczenia jest zamiana opioidu, który wywołał chorobę, na metadon. Tramadol i meperydyna mają również pewną aktywność antagonisty receptora NMDA.
Innym sposobem leczenia, który ma pewien potencjał w leczeniu OIH, jest buprenorfina.23,24 Buprenorfina jest częściowym agonistą opioidów na receptorze mu i ma również aktywność antagonisty receptora kappa.4 Wiadomo, że stężenie dynorfiny, agonisty receptora kappa, wzrasta podczas leczenia opioidami. Aktywacja receptora kappa w znacznym stopniu antagonizuje działanie opioidów wywołane przez receptor mu.25 Przydatność kliniczna buprenorfiny w leczeniu OIH nie została jeszcze w pełni wyjaśniona.
Conclusion: Looking Forward
Much work remains to be done before it can be declared that OIH isunderstood. Dokładny mechanizm komórkowy i szlaki sygnalizacyjne odpowiedzialne za to zjawisko nie są zdefiniowane. Aby skomplikować to, istnieją sprzeczne raporty, czy konkretne składniki odgrywają kluczową rolę, lub jakąkolwiek rolę. Większość badań nad wyjaśnieniem patofizjologii OIH dotyczyła modelu zwierzęcego. Ma to pewną wartość, ale informacje z modelu ludzkiego są skąpe.
Słabe zrozumienie przyczyny stanu generuje niepewne armamentarium opcji leczenia. Najlepszą dostępną strategią jest całkowite odstawienie problematycznego opioidu, ale jest to mało użyteczne dla pacjenta, który wymaga uśmierzania bólu za pomocą opioidów.Zbadano kilka innych metod leczenia, ale wszystkie z nich mogłyby skorzystać z dalszych badań. Większość badań przeprowadzonych na ludziach dotyczy pacjentów pooperacyjnych, osób uzależnionych od narkotyków oraz eksperymentalnych modeli bólu. Badania te nie są pozbawione wartości, ale te populacje nie odzwierciedlają populacji bólu przewlekłego. Inne ograniczenia dostępnych metod leczenia obejmują słabe wyniki, nadmierną toksyczność pomimo umiarkowanego sukcesu oraz małe badania dające słabe wnioski.
W chwili obecnej trwają lub są planowane liczne badania kliniczne z zastosowaniem antagonisty receptora NMDA – memantyny w leczeniu OIH.26 Nadal istnieją sprzeczne doniesienia co do dokładnej roli receptorów NMDA w OIH. Konieczne jest przeprowadzenie dalszych badań w celu określenia kluczowych receptorów i mechanizmów obecnych w OIH. Zwiększenie liczebności próby badawczej pomoże potwierdzić wnioski, które już zostały wyciągnięte na temat tego, które środki lecznicze są odpowiedzialne za OIH i skuteczne w leczeniu. Prowadzenie badań, które koncentrują się na bólu przewlekłym, a nie na modelach bólu ostrego, może przynieść klinicznie istotne informacje dla lekarza.
Chapman i współpracownicy postawili konkretne pytania, na które należy odpowiedzieć przed rozpoznaniem OIH i skutecznym leczeniem.27 Jakie są zależności między dawką opioidu i czasem trwania a OIH? W przypadku jakiego rodzaju bólu lub u jakiego rodzaju pacjenta istnieje większe prawdopodobieństwo rozwoju OIH? To są pytania, które muszą kierować przyszłymi badaniami klinicznymi.
1. Parselis Kelly J, Cook SF, Kaufman DW, et al. Prevalence and characteristics of opioid use in the US adult population. Pain. 2008;138:507-513.
2. Instytut Medycyny. Relieving Pain in America: A Blueprint for Transforming Prevention, Care, Education, and Research. Washington, DC: The National Academies Press; 2011.
3. Chu LF, Angst MS, Clark D. Opioid-induced hyperalgesia in humans: molecular mechanisms and clinical considerations. Clin J Pain. 2008;24:479-496.
4. Lee M, Silverman SM, Hansen H, et al. A comprehensive review of opioid-induced hyperalgesia. Pain Physician. 2011;14:145-161.
5. Mao J. Opioid-induced abnormal pain sensitivity: implications in clinical opioid therapy. Pain. 2002;100:213-217.
6. Raffa RB, Pergolizzi JV Jr. Opioid-induced hyperalgesia: is it clinically relevant for the treatment of pain patients? Pain Manage Nurs. 2011;1-17.
7. Li X, Clark JD. Hyperalgesia during opioid abstinence: mediation by glutamate and substance P. Anesth Analg. 2002;95:979-984.
8. Pud D, Cohen D, Lawental E, Eisenberg E. Opioids and abnormal painperception: new evidence from a study of chronic opioid addicts andhealthy subjects. Drug Alcohol Depend. 2006;82:218-223.
9. Malmberg AB, Yaksh TL. Hyperalgesia mediated by spinal glutamateor substance P receptor blocked by spinal cyclooxygenase inhibition. Science. 1992;257:1276 -1279.
10. Fisher K, Coderre TJ, Hagen NA. Targeting theN-methyl-D-aspartate receptor for chronic pain management. Preclinical animal studies, recent clinical experience and future researchdirections. J Pain Symptom Manage. 2000;20:358-373.
11. Lötsch J. Metabolity opioidów. J Pain Symptom Manage. 2005;29:S10-S24.
12. Skarke C, Lötsch J. Morphine metabolites: clinical implications. Semin Anesth, Perioperative Med Pain. 2002;21:258-264.
13. Juni A, Klein G, Kest B. Morphine hyperalgesia in mice isunrelated to opioid activity, analgesia, or tolerance: evidence formultiple diverse hyperalgesic systems. Brain Res. 2006;1070:35-44.
14. Angst M, Clark JD. Opioid-induced hyperalgesia: a qualitative systematic review. Anesthesiology. 2006;104:570-587.
15. Vanderah TW, Gardell LR, Burgess SE, et al. Dynorphin promotes abnormal pain and spinal opioid antinociceptive tolerance. J Neurosci. 2000;20:7074-7079.
16. Hooten WM, Mantilla CB, Sandroni P, Townsend CO. Associationsbetween heat pain perception and opioid dose among patients with chronicpain undergoing opioid tapering. Pain Med. 2010;11:1587-1598.
17. Silverman S. Opioid induced hyperalgesia: clinical implications for the pain practitioner. Pain Physician. 2009;12:679-684.
18. Li SQ, Xing YL, Chen WN, et al. Activation of NMDA receptor isassociated with up-regulation of COX-2 expression in the spinal dorsalhorn during nociceptive inputs in rats. Neurochem Res. 2009;34:1451-1463.
19. Okon T. Ketamina: wprowadzenie dla lekarza zajmującego się leczeniem bólu i medycyny paliatywnej. Pain Physician. 2007;10:493-500.
20. Galer BS, Lee D, Ma T, et al. MorphiDex (morphinesulfate/dextromethorphan hydrobromide combination) in the treatment ofchronic pain: three multicenter, randomized, double-blind, controlledclinical trials fail to demonstrate enhanced opioid analgesia orreduction in tolerance. Pain. 2005;115:284-295.
21. Wiesenfeld-Hallin Z. Combined opioid-NMDA antagonist therapies.What advantages do they offer for the control of pain syndromes? Drugs. 1998;55;1-4.
22. Vorobeychik Y, Chen L, Bush MC, Mao J. Improved opioid analgesic effect following opioid dose reduction. Pain Med. 2008;9:724-727.
23. Baron MJ, McDonald PW. Significant pain reduction in chronic pain patients after detoxification from high-dose opioids. J Opioid Manag. 2006;2:277-282.
24. Koppert W, Ihmsen H, Körber N, et al. Different profiles ofbuprenorphine-induced analgesia and antihyperalgesia in a human painmodel. Pain. 2005;118:15-22.
25. Pan ZZ. Mu-opposing actions of the kappa-opioid receptor. Trends Pharmacol Sci. 1998;19:94-98.
26. Ballantyne JC, Mao J. Opioid therapy for chronic pain. N Engl J Med. 2003;349:1943-1953.
27. Chapman CR, Lipschitz DL, Angst MS, et al. Opioid pharmacotherapyfor chronic non-cancer pain in the United States: a research guidelinefor developing an evidence-base. J Pain. 2010;11:807-829.