Introduction
Immunofluorescencja (IF) wykorzystuje przeciwciała i detekcję fluorescencyjną do badania lokalizacji, względnej ekspresji i stanów aktywacji białek docelowych w utrwalonych komórkach lub tkankach. IF jest szeroko stosowany w różnych dziedzinach nauki.
IF może być używany do odpowiedzi na pytania takie jak:
- Jakie komórki lub tkanki wyrażają moje białko(a) docelowe?
- Jak zmienia się ekspresja i/lub aktywacja mojego białka docelowego w odpowiedzi na perturbacje eksperymentalne?
- Gdzie w komórce/tkance zlokalizowane jest białko docelowe?
- Jaka jest relacja przestrzenna pomiędzy różnymi białkami docelowymi w kontekście architektury komórki lub tkanki?
Immunofluorescencja obejmuje szereg powiązanych technik, które rozwinęły się w czasie. Wszystkie te techniki wykorzystują specyficzne rozpoznawanie celów biologicznych przez przeciwciała i wykrywanie reporterów fluorescencyjnych w analizie cytometrycznej. Zapewnienie, że próbka biologiczna jest dobrze zachowana, a antygeny docelowe są dostępne dla przeciwciał jest ważne, ale może stanowić wyzwanie, które różni się w zależności od próbki, celu i przeciwciała.
Na tej stronie zebraliśmy zasoby pomocne w poruszaniu się po protokołach, odpowiadaniu na najczęściej zadawane pytania i pomaganiu w projektowaniu udanych eksperymentów IF.
Wybór właściwej techniki i protokołu IF
Na optymalną technikę/protokół IF wpływa rodzaj materiału biologicznego, etapy przetwarzania próbki, właściwości antygenu docelowego i stosowane przeciwciało.
Uwagi obejmują:
- Materiały wejściowe mogą być hodowanymi liniami komórkowymi, zamrożonymi tkankami lub tkankami utrwalonymi w formalinie, zatopionymi w parafinie (FFPE).
- Dla hodowanych linii komórkowych i komórek pierwotnych należy szukać przeciwciał zwalidowanych dla immunofluorescencji-immunocytochemii (IF-IC).
- W wielu laboratoriach „immunohistochemia/IHC” jest używana jako termin ogólny, obejmujący tkankę, która jest albo zatopiona w parafinie, albo zamrożona, i może być używana w celu uwzględnienia zarówno chromogennej, jak i fluorescencyjnej detekcji. Na stronie cellsignal.com, aplikacje rozróżniają preparaty tkanek mrożonych (IF-F) i preparaty tkanek zatopionych w parafinie.
- Dla próbek tkanek FFPE, przeciwciała zwalidowane dla immunohistochemii (IHC-P) mogą być również używane z detekcją fluorescencyjną bez wzmocnienia, jeśli antygen docelowy jest obfity, lub w multipleksowanym IHC (mIHC) ze wzmocnieniem sygnału.
- Przeciwciało może być zwalidowane dla jednego lub więcej zastosowań wymienionych powyżej. Zalecenia dotyczące protokołów są wynikiem testowania przez naukowców podczas procesu walidacji.
- Protokoły specyficzne dla produktu można znaleźć na stronie internetowej każdego produktu. W przypadku przeciwciał zwalidowanych w IF należy wybrać opcję „IF” na stronie produktu, aby wyświetlić dane i protokół walidacji IF. Podstawowe informacje (rozcieńczenia/stężenie robocze, zatwierdzone zastosowania, reaktywność gatunkowa, gatunki gospodarzy) dla każdego przeciwciała są zawarte w karcie danych produktu.
- Najczęściej używane protokoły IF można również znaleźć na stronie z protokołami.
- Nie potrzebujesz lub nie chcesz używać detekcji fluorescencyjnej dla swoich próbek tkanek? Alternatywnym podejściem jest detekcja chromogenna, omówiona na stronie IHC.
Wybór przeciwciał do IF: znaczenie walidacji przeciwciał
Najlepsze przeciwciała dają silny, specyficzny sygnał z minimalnym tłem. Ważne jest, aby wybierać przeciwciała, które zostały zwalidowane w aplikacji, która będzie używana. Walidacja przeciwciał w IF może obejmować eksperymenty z pozytywną i negatywną ekspresją (z wykorzystaniem linii komórkowych knockout, modeli genetycznych, CRISPR lub RNAi), eksperymentalną manipulację lokalizacją białek docelowych lub modyfikacjami potranslacyjnymi oraz optymalizację protokołu.
Wydajność przeciwciał różni się w zależności od zastosowania. Przeciwciało, które działa dobrze w eksperymencie western blot, na przykład, może, ale nie musi działać w IF. Podczas testowania nowych przeciwciał, niektóre z nich będą wykazywać niewielkie wiązanie poza celem; nie są one nigdy zalecane do IF lub innych zastosowań innych niż BW. Ponadto, przeciwciało może działać dobrze na tkance mrożonej, ale nie na tkance FFPE, lub odwrotnie. Czułość i wydajność przeciwciał może się zmieniać w zależności od sposobu utrwalania i przetwarzania próbki oraz od warunków pracy przeciwciał.
Po podjęciu decyzji, jaki rodzaj próbek biologicznych zostanie użyty w eksperymencie i jak zostaną one przygotowane, najłatwiejszym sposobem przeglądania przeciwciał na stronie cellsignal.com jest wybranie najpierw odpowiedniej aplikacji. Następnie można wprowadzić wyszukiwane hasła lub wybrać inne atrybuty (takie jak gatunek gospodarza, obszar badań i inne), aby jeszcze bardziej zawęzić wyszukiwanie i wybrać przeciwciało, które zostało zwalidowane w wymaganej aplikacji.
Projektowanie eksperymentów kontrolnych dla IF
Aby mieć pewność co do projektu eksperymentu i wyników oraz co do tego, że przeciwciało wiernie raportuje swój cel, pozytywne i negatywne eksperymenty kontrolne mogą być pouczające. Na przykład:
- Kontrole tylko drugorzędowe mogą powiedzieć, czy istnieje niespecyficzne wiązanie przeciwciała drugorzędowego.
- Potwierdź specyficzność przeciwciała pierwszorzędowego, projektując eksperymenty Knockout/siRNA lub porównując znane linie komórkowe wykazujące ekspresję i nie wykazujące ekspresji.
- Doświadczenia z pojedynczym celem są używane w ustawianiu obrazowania spektralnego bez mieszania. Ten typ eksperymentu może pomóc określić, czy brak barwienia jest spowodowany przeszkodą steryczną, która występuje, gdy 2 antygeny znajdują się w bliskiej odległości od siebie.
- Poddać próbki działaniu fosfatazy, aby potwierdzić, że przeciwciała fosfospecyficzne rozpoznają tylko fosforylowany cel w IF.
- Jeśli podejrzewasz problemy z utrwalaniem lub permeabilizacją, sprawdzenie z przeciwciałem, które działało w Twoim laboratorium w przeszłości może być pomocne w rozwiązywaniu problemów.
Naukowcy z firmy Cell Signaling Technology (CST) rutynowo przeprowadzają tego typu kontrole jako część naszego procesu walidacji (patrz przykład). Może być warto skonfigurować podobne kontrole w swoim doświadczalnym systemie modelowym, szczególnie jeśli masz trudności z uzyskaniem pożądanych wyników.
Pierwotne vs wtórne przeciwciała oraz bezpośrednie vs pośrednie barwienie
Pierwotne przeciwciała zapewniają specyficzne rozpoznawanie docelowego antygenu. Przeciwciała drugorzędowe wiążą się z przeciwciałami pierwszorzędowymi w oparciu o gatunek, w którym zostały wyhodowane. Przeciwciała pierwszorzędowe, które zostały wyhodowane na króliku lub myszy są podatne na wykrywanie odpowiednio z drugorzędowymi przeciwciałami anty króliczymi lub anty mysimi.
Parowanie pierwszorzędowego przeciwciała i drugorzędowego przeciwciała (specyficznego dla gatunku gospodarza pierwszorzędowego), które jest sprzężone z fluoroforem jest znane jako barwienie pośrednie. Stosowanie przeciwciał pierwszorzędowych sprzężonych z fluoroforami, bez przeciwciał drugorzędowych, znane jest jako barwienie bezpośrednie. Metody bezpośredniego barwienia oszczędzają czas i pozwalają na multipleksowanie przy użyciu przeciwciał wyhodowanych na tym samym gatunku gospodarza. Barwienie pośrednie tradycyjnie oferuje wyższą czułość dzięki wzmocnieniu sygnału, które występuje, gdy wiele przeciwciał drugorzędowych wiąże się z pojedynczym przeciwciałem pierwszorzędowym.
Dostępne są inne odmiany tych technik, takie jak stosowanie biotynylowanych przeciwciał pierwszorzędowych z fluorochromem sprzężonym z awidyną/streptawidyną. Skoniugowane z fluoroforem fragmenty przeciwciał drugorzędowych F(ab’)2 (bez domeny Fc) mogą pomóc w zmniejszeniu tła. W mIHC, przeciwciała drugorzędowe sprzężone z peroksydazą chrzanową (HRP) są stosowane do katalizowania osadzania koniugatów tyramidowo-fluoroforowych.
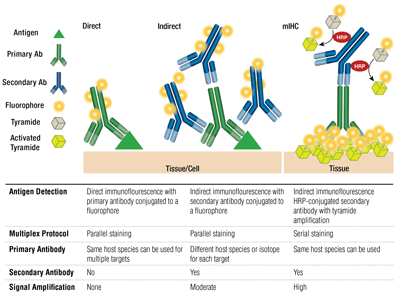
Wybór przeciwciał fluoroforowych
Wybór przeciwciał fluoroforowych
Jak wiele celów/przeciwciał można multipleksować?
Multipleksowanie polega na wykrywaniu więcej niż 1 celu jednocześnie za pomocą wielu przeciwciał i wykrywaniu różnych długości fal (kolorów) dla każdego celu. W przypadku barwienia pośredniego, zdolność do multipleksowania opiera się na parowaniu sprzężonych z fluoroforami, specyficznych gatunkowo przeciwciał drugorzędowych z każdym przeciwciałem pierwotnym. Przeciwciała myszy z różnych izotypów mogą być również multipleksowane przy użyciu specyficznych dla izotypu przeciwciał drugorzędowych, umożliwiając wykrywanie do 5 przeciwciał myszy jednocześnie. W przypadku bezpośredniego barwienia, każde przeciwciało pierwotne powinno być sprzężone z innym fluoroforem. Pozwala to na łączenie wielu przeciwciał z tego samego gatunku/izotypu, a także umożliwia barwienie „mysz na myszy”, ponieważ niespecyficzne wiązanie drugorzędowych przeciwciał anty-mysich do tkanki myszy nie stanowi problemu.
Przy projektowaniu multipleksowych eksperymentów IF, należy wziąć pod uwagę charakterystykę spektralną mikroskopu fluorescencyjnego, w tym dostępne źródła wzbudzenia i zestawy filtrów, w celu uniknięcia krwawienia spektralnego. Nowoczesne epifluorescencyjne i konfokalne mikroskopy fluorescencyjne zazwyczaj mają zdolność rozróżniania 3 lub więcej kanałów.
Połączenie barwienia przeciwciałami z barwnikami lub znacznikami
Barwniki komórkowe, które są stosowane po utrwaleniu lub trwałe etykiety żywych komórek mogą być włączone do przepływu pracy IF. Znakowanie organelli jest często używane do weryfikacji subkomórkowej lokalizacji celu. Znaczniki ekspresyjne, takie jak GFP, są często używane do śledzenia transfekowanych komórek lub w eksperymentach mozaikowych; jeśli sygnał fluorescencji GFP jest niski, przeciwciało anty-GFP może być użyte w IF. Użycie barwników lub białek fluorescencyjnych zajmie kanały fluorescencyjne, pozostawiając mniej dostępne dla przeciwciał.
Wybór fluoroforów do eksperymentu
Zależy to od charakterystyki spektralnej źródła wzbudzenia i dostępnego filtrowania wzbudzenia/emisji. Należy ocenić profil wzbudzenia i emisji fluoroforu przed przeprowadzeniem eksperymentu, aby uniknąć przebicia fluorescencji. CST oferuje różne przeciwciała pierwotne i wtórne sprzężone z fluoroforami, w tym barwniki z linii Alexa Fluor®.
Przygotowanie próbki
Tkanka
Wycinki tkanek mogą być przygotowane albo przez szybkie zamrożenie w medium o optymalnej temperaturze cięcia (OCT) albo przez utrwalenie i zatopienie w parafinie. Zamrożone próbki mogą być cięte przy użyciu kriostatu i pozostawione do wyschnięcia na powietrzu na szkiełku 10 do 15 minut przed utrwaleniem przed następnym krokiem. W przypadku próbek tkanek FFPE wymagania dotyczące etapów pobierania, utrwalania i zatapiania w parafinie mogą się różnić w zależności od rodzaju tkanki.
Tkanka mrożona vs tkanka FFPE
Ogólnie tkanka FFPE ma lepszą morfologię niż tkanka mrożona zatopiona w OCT. Może to ułatwić ocenę ilościową komórek dodatnich lub identyfikację granic między barwnikami. Tkanka FFPE jest również bardzo stabilna; raz osadzone bloki tkanki mogą być przechowywane przez lata. Ten typ tkanki jest również łatwiejszy do przesyłania między laboratoriami i jest preferowaną metodą przetwarzania ludzkich próbek patologicznych.
Z drugiej strony, tkanka FFPE przechodzi kilka dodatkowych etapów przetwarzania, które zmniejszają całkowitą ilość antygenu z powodu degradacji białka, wymagają etapów demaskowania w celu wykrycia pozostałego antygenu i nasilają autofluorescencję wywołaną aldehydem. Jeżeli nie pracuje się z bardzo obfitym białkiem, pozostały antygen może być trudny do wykrycia przez pośrednie IF i może wymagać amplifikacji w celu uzyskania odpowiedniego zabarwienia. Możliwe jest również, że pobieranie antygenu może zdemaskować antygeny, które normalnie nie byłyby wykrywane, a przeciwciało, które w przeciwnym razie daje oczekiwany wzór barwienia, może dawać niespecyficzne barwienie. Równie możliwa jest praca z celem, gdzie do wykrycia docelowego epitopu wymagana jest specyficzna metoda odzyskiwania antygenu. Dlatego ważne jest, aby rozważyć, w jaki sposób przeciwciało jest walidowane i jakie kroki są wymagane do jego użycia.
W przypadku mrożonej tkanki OCT-embedded, redukcja przetwarzania ma priorytet nad morfologią. Jest to najszybsza metoda uzyskiwania wyników barwienia immunologicznego, ponieważ szkiełka są gotowe do użycia w momencie cięcia tkanki i jest mniej etapów przetwarzania przed osadzeniem. Następuje mniejsza degradacja białek i więcej antygenu jest dostępne do wiązania przeciwciał, bez konieczności przeprowadzania dodatkowych, trudnych etapów pobierania. Ponieważ metoda ta nie wymaga amplifikacji, jest ona bardziej wrażliwa na jakość tkanki. Typ utrwalania (alkohol vs aldehyd), czas trwania (niektóre cele, takie jak czynniki transkrypcyjne wymagają krótszego czasu utrwalania) i wiek tkanki (zwłaszcza po sekcji) są ważne i będą się różnić w zależności od celu. Wreszcie, praca z mrożoną tkanką daje większą elastyczność w wyborze celu, ponieważ przetwarzanie może nastąpić po sekcji, co pozwala na większe dostosowanie w projektowaniu testów.
Komórki hodowlane
Komórki muszą być posiane na materiale nośnym zgodnym z mikroskopem fluorescencyjnym. Typowe podłoża obejmują szklane naczynia do hodowli komórkowych, szklane szkiełka nakrywkowe (przechowywane w plastikowych naczyniach do hodowli) przygotowane z polilizyną i/lub składnikami macierzy pozakomórkowej w celu wsparcia przylegającej hodowli komórkowej oraz dostępne w handlu komory wielokomorowe montowane na szklanych szkiełkach, które są kompatybilne z mikroskopami.
Należy pamiętać, że warunki hodowli komórkowej mogą wpływać na zdrowie komórek, morfologię i ekspresję/lokalizację białka docelowego i ostatecznie dyktować jakość danych IF. Należy upewnić się, że komórki są zdrowe, regularnie sprawdzając media hodowlane pod kątem zmian pH i poszukując oznak stresu komórkowego (takich jak wielojądrzaste komórki) przy małym powiększeniu mikroskopu. Sprawdź również, czy konfluencja komórek jest odpowiednia dla typu komórek i celu.
Utrwalanie próbek
Idealny utrwalacz zachowuje „życiopodobne” ujęcie, jednocześnie szybko zatrzymując degradacyjny proces autolizy poprzez sieciowanie i hamowanie endogennych enzymów, i przedstawia antygen do rozpoznania przez przeciwciało. Niestety, nie ma jednej metody utrwalania, która działałaby idealnie na każdej próbce i dla każdego antygenu. Nawet różne antygeny na tym samym białku docelowym mogą wykazywać różnice pomiędzy protokołami. Dlatego właśnie najlepszy protokół może się różnić nie tylko w zależności od typu próbki, ale również od epitopu (i przeciwciała).
Tkanka
W przypadku świeżo zamrożonej tkanki, sekcje, które zostały zamrożone i poddane kriostatycznej sekcji powinny być teraz traktowane utrwalaczem. Alternatywnie, próbki tkanek mogą być konserwowane przez utrwalenie najpierw z perfuzją przezskórną lub zanurzeniową, utrwalenie wtórne i etapy kriokonserwacji, a następnie zamrożenie i sekcję.
W przetwarzaniu tkanek FFPE, tkanka jest konserwowana przez utrwalenie zanurzeniowe z formaliną (lub innym utrwalaczem na bazie aldehydu) lub z perfuzją, jak powyżej, a następnie zatopienie w parafinie i sekcję. Przed inkubacją z przeciwciałem, sekcje muszą być poddane etapom deparafinacji, rehydratacji i odzyskiwania antygenu, aby umożliwić przeciwciałom dostęp do próbki i związanie cząsteczek docelowych.
Komórki
Płukanie komórek ciepłą pożywką bezbiałkową lub PBS bezpośrednio przed utrwalaniem może zapobiec wytrącaniu się białka pozakomórkowego i resztek. Szybkie utrwalanie uzyskuje się przez szybką wymianę nośnika na roztwór utrwalacza.
Utrwalanie aldehydem vs utrwalanie alkoholem
Utrwalacze na bazie aldehydu, takie jak formaldehyd, formalina (mieszanina rozpuszczonego formaldehydu z mniejszym procentem metanolu) i aldehyd glutarowy są najczęściej używane, gdy zachowanie struktury jest najważniejsze. Dla większości przeciwciał, CST zaleca utrwalanie przy użyciu 4% formaldehydu (bez metanolu). Aldehydy reagują z pierwszorzędowymi aminami białek komórkowych i sieciują je, stabilizując próbkę. Ponadto, enzymy komórkowe, w tym fosfatazy i proteazy, są dezaktywowane przez wiązania krzyżowe. Aldehydy przekraczają błonę plazmatyczną i wiążą rozpuszczalne białka lepiej niż alkohole, ale niektóre cele mogą stracić swoją antygenowość z sieciowaniem aldehydowym.
Utrwalacze alkoholowe odwadniające/denaturujące, takie jak metanol, wypierają wodę wokół makrocząsteczek komórkowych, powodując ich denaturację i wytrącanie in situ. Denaturacja białka docelowego może odsłonić ukryte epitopy, co czyni to podejście korzystniejszym niż utrwalanie aldehydowe dla niektórych przeciwciał. Jednakże, utrwalacze odwadniające są mniej odpowiednie dla celów rozpuszczalnych i przeciwciał specyficznych dla stanu modyfikacji, takich jak przeciwciała fosforyzujące. Należy sprawdzić kartę danych produktu w celu uzyskania optymalnej metody utrwalania.
Wybór środka permeabilizującego
Jeśli stosowany jest utrwalacz sieciujący, błona plazmatyczna będzie nadal nienaruszona, przez co cele wewnątrzkomórkowe będą niedostępne dla przeciwciał. Dlatego permeabilizacja powinna być wykonywana po utrwalaniu sieciującym, chyba że przeciwciała rozpoznają epitopy zewnątrzkomórkowe. Optymalna metoda permeabilizacji różni się w zależności od przeciwciała; zawsze należy sprawdzić stronę produktu w celu uzyskania zalecanego protokołu.
Użycie Triton® X-100 do permeabilizacji po utrwaleniu jest powszechne. Triton i inne detergenty, takie jak NP-40, TWEEN®, Saponin, Digitonin i DOTMAC, oddziałują z błonami komórkowymi tworząc zmienne rozmiary „porów” i umożliwiając dostęp przeciwciał.
Alternatywnie, permabilizacja alkoholowa z użyciem etanolu lub metanolu może być przeprowadzona po etapie utrwalania. Ta metoda łączy szybkie utrwalanie utrwalaczy sieciujących z pośrednią denaturacją białka i delipidacją błony. Może to poprawić sygnał dla niektórych celów, szczególnie tych związanych z organellami lub cytoszkieletem.
Jakich warunków utrwalania/perm należy używać podczas multipleksowania?
Jeśli multipleksujesz z przeciwciałami, które wymagają różnych protokołów CST, może być konieczne ustalenie priorytetu, którego przeciwciała użyć w jego optymalnych warunkach. Przykład optymalizacji kolejności wykonywanej w mIHC jest przedstawiony w tej nocie aplikacyjnej (PDF). Wykonanie małej serii testów porównujących różne protokoły może być przydatne przed zwiększeniem skali eksperymentów.
Wybór odczynnika blokującego
Najczęstszym zaleceniem jest 5% normalnej surowicy koziej (lub surowicy tego samego gatunku co przeciwciało drugorzędowe) w PBS + 0,3% Triton® X-100. Sprawdź arkusz danych pod kątem zalecanego środka blokującego.
Jeśli w próbce obecne są receptory Fc, sygnał przeciwciała będzie pochodził z połączenia specyficznego rozpoznawania celu (poprzez miejsce wiązania antygenu/zmienny region przeciwciała), jak również niespecyficznej absorpcji łańcucha ciężkiego przeciwciała wiążącego się z receptorami Fc. Całkowita IgG obecna w surowicy zwierzęcej blokuje receptory Fc, aby zapobiec wiązaniu przeciwciał pierwotnych i wtórnych oraz zmniejszyć szum tła. Wybór fragmentów F(ab’)2 sprzężonych z fluoroforem również pozwoli uniknąć wiązania receptorów Fc dla przeciwciała drugorzędowego (ale nie dla przeciwciała pierwszorzędowego)
W innych zastosowaniach opartych na przeciwciałach, takich jak western blotting, etapy blokowania zmniejszają sygnał tła spowodowany niespecyficznym wiązaniem o niższym powinowactwie przeciwciał pierwszorzędowych i drugorzędowych do miejsc innych niż ich zamierzony cel. Stwierdziliśmy jednak, że rekombinowane królicze przeciwciała monoklonalne, które były rygorystycznie testowane w IF, działają dobrze na wielu próbkach z lub bez blokowania. Ostatecznie, wybór wysokiej jakości przeciwciał zwalidowanych w immunofluorescencji pozwala uniknąć szumu tła.
Stężenie przeciwciał i stosunek sygnału do szumu w IF
Stosunek sygnału do szumu (S/N) jest związany ze swoistością i czułością przeciwciała w konkretnym zastosowaniu. S/N można obliczyć porównując „sygnał” intensywności fluorescencji w komórkach, które wykazują ekspresję interesującego nas celu, z „szumem tła” komórek, które nie wykazują ekspresji. Jeśli przeciwciało jest stosowane w zbyt niskim stężeniu, sygnał fluorescencji będzie zbyt niewyraźny, aby odróżnić go od szumu tła. Z drugiej strony, zbyt wysokie stężenie przyczyni się do wybarwienia tła, zmniejszając S/N. Zawsze należy sprawdzić kartę charakterystyki produktu pod kątem zalecanego rozcieńczenia, które jest oparte na miareczkowaniu wykonanym podczas walidacji przeciwciała.
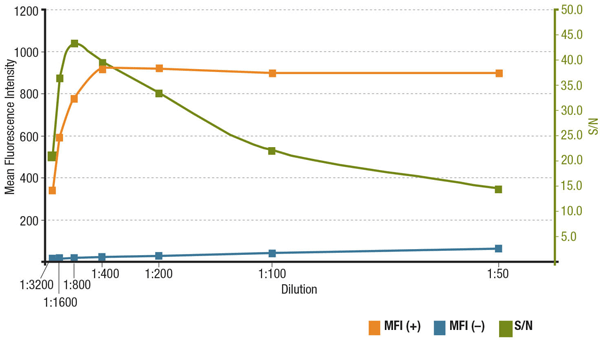
Analyis of S/N for MUC1 (D9O8K) XP® Rabbit mAb #14161 dilution. Quantitation of Mean Fluorescence Intensity in expressing (MFI(+), orange) ZR-75-1 cells and non-expressing (MFI(-), blue) HCT 116 cells, and calculated S/N (green).
Analyis of S/N for MUC1 (D9O8K) XP® Rabbit mAb #14161 dilution. Ilościowa ocena średniej intensywności fluorescencji w komórkach ZR-75-1 wykazujących ekspresję (MFI(+), kolor pomarańczowy) i komórkach HCT 116 nie wykazujących ekspresji (MFI(-), kolor niebieski) oraz obliczona wartość S/N (kolor zielony).
Czas inkubacji przeciwciała
Na ogół, inkubacja przez noc w temperaturze 4°C powoduje uzyskanie silnego sygnału. Zmiana czasu inkubacji i temperatury może zmienić sygnał i S/N. Różne przeciwciała mogą różnie reagować na zmienione warunki inkubacji; więcej informacji na ten temat można znaleźć w tym wpisie na blogu.
Czy do wykonania IF potrzebuję dostępu do mikroskopu konfokalnego?
IF można wykonać w każdym mikroskopie fluorescencyjnym z odpowiednim źródłem wzbudzenia i filtrowaniem, w tym w mikroskopach epifluorescencyjnych, skaningowych i z wirującym dyskiem konfokalnym. Immunofluorescencja jest również ogólnie zgodna z wyspecjalizowanymi technikami fluorescencyjnymi, w tym fluorescencją z całkowitym wewnętrznym odbiciem (TIRF), mikroskopią płatu świetlnego i niektórymi technikami superrozdzielczości.
Zgodność ze zautomatyzowanymi badaniami przesiewowymi o dużej wydajności/analizą wysokiej zawartości
Każde przeciwciało zatwierdzone do IF-IC może być stosowane w badaniach przesiewowych o dużej wydajności (HCS) i analizie wysokiej zawartości (HCA). Eksperymenty te są oparte na standardowych technikach IF, z uwzględnieniem automatyzacji.
Potrafisz napotkać problemy z eksperymentem IF? Kliknij tutaj, aby zapoznać się z przewodnikiem rozwiązywania problemów.
Cell Signaling Technology, CST, i XP są znakami towarowymi firmy Cell Signaling Technology, Inc. Wszystkie inne znaki towarowe są własnością ich właścicieli.