Struktura Kekulé dla benzenu
Wiadomo, że benzen miał wzór cząsteczkowy C6H6, ale jego wzór strukturalny był nieznany.
Jeśli benzen był węglowodorem nienasyconym o prostym łańcuchu, powinien łatwo ulegać reakcjom addycji (podobnie jak inne alkeny i alkeny).
Na przykład brom, Br2, powinien dodać się przez podwójne lub potrójne wiązanie, jak pokazano poniżej:
| możliwa reakcja addycji o prostej strukturze łańcucha: | |||
| CH3-C≡C-C≡C-CH3 | + Br2 | → | CH3-CBr=CBr-C≡C-CH3 |
Ale, gdy brom jest dodawany do benzenu w temperaturze 25°C i ciśnieniu 1 atm (101.3 kPa), żadna reakcja nie zachodzi.
Więc możliwe struktury benzenu obejmujące podwójne i/lub potrójne wiązania ułożone w łańcuch wydawały się najbardziej nieprawdopodobne, ponieważ powinny one ulegać reakcjom addycji.
Jeśli brom zostanie dodany do benzenu w obecności FeBr3, ulega on reakcji substytucji, w której jeden z atomów wodoru zostaje zastąpiony atomem bromu, dając związek o wzorze C6H5Br, jak pokazano poniżej:
| znana reakcja substytucji: | ||||||||
| C6H6 | + Br2 | FeBr3 → |
C6H5Br | + HBr | ||||
Pod tym względem, benzen zachowywał się znacznie bardziej jak węglowodór nasycony (tylko pojedyncze wiązania między atomami węgla).
Więc, pierwsza struktura zaproponowana przez Kekulégo dla benzenu w 1865 roku nie zawierała żadnych podwójnych wiązań, ale układała 6 atomów węgla w pierścień, jak pokazano poniżej:
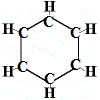
Kekulé zdał sobie sprawę, że ta cząsteczka łamie zasadę tetrawalencji dla węgla, to znaczy, że każdy atom węgla tworzy tylko 3 wiązania zamiast 4.
Więc w 1872 roku Kekulé zaproponował strukturę benzenu składającą się z trzech naprzemiennych wiązań pojedynczych i podwójnych, jak pokazano poniżej:

Proszę zauważyć, że chociaż atomy węgla nie są zapisane w strukturze, zawsze rozumie się, że atom kabonu istnieje tam, gdzie łączą się dwie linie sześciokąta, tak więc istnieje 6 „połączeń”, 6 kątów, a zatem 6 atomów węgla.
W tej strukturze każdy atom węgla jest związany z atomem wodoru, i, do dwóch innych atomów węgla. Jedno z wiązań węgiel-węgiel jest wiązaniem pojedynczym, drugie wiązanie węgiel-węgiel jest wiązaniem podwójnym. Każdy atom węgla ma wykonane 4 wiązania.
Chociaż struktura ta nie wyjaśnia, dlaczego benzen nie ulega reakcjom addycji, może wyjaśnić, dlaczego benzen tworzy tylko jeden izomer strukturalny, gdy benzen reaguje z bromem w reakcji substytucji, jak pokazano poniżej:
 proponowana struktura benzenu |
+ Br2 | → |  tylko 1 izomer strukturalny |
. | + HBr |
Inne proponowane struktury pierścienia dla benzenu przewidywałyby więcej niż jeden izomer strukturalny dla produktu reakcji substytucji, jak pokazano poniżej:
| inne proponowane struktury pierścieniowe reakcji: | 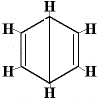 |
Br2 → |
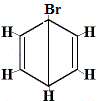 izomer strukturalny 1 |
+ | . | 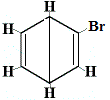 izomer strukturalny 2 |
Co by się stało, gdyby kolejny atom wodoru został zastąpiony (podstawiony) atomem bromu?
| C6H5Br | + Br2 | FeBr3 → |
C6H4Br2 | + HBr |
Ile izomerów strukturalnych C6H4Br2 powstałoby?
 |
Br2 → FeBr3 |
.  strukturalny izomer 1 |
+ | 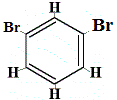 strukturalny izomer 2 |
+ | . 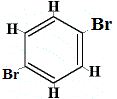 izomer strukturalny 3 |
+ |  izomer strukturalny 4 |
Izomery strukturalne 1 i 4 różnią się, ponieważ w izomerze 1 dwa atomy Br są połączone z atomami węgla wiązaniem C-C, podczas gdy w izomerze 4 dwa atomy Br są związane z atomami węgla na C=C wiązanie.
Jednakże, gdy C6H5Br otrzymany z benzenu reaguje z bromem w reakcji substytucji, powstają tylko 3 izomery strukturalne C6H4Br2!
Aby rozwiązać ten problem, Kekulé zaproponował, że pierścień benzenu jest w szybkiej równowadze między strukturami, w których wiązania podwójne znajdują się w alternatywnych pozycjach, jak pokazano poniżej:
 |
⇋ |  |
Tak więc, gdy brom reaguje z C6H5Br w reakcji substytucji w celu wytworzenia C6H4Br2, pary izomerów strukturalnych C6H4Br2 są ze sobą w równowadze.
To oznacza, że izomery strukturalne 1 i 4 pokazane powyżej, które różnią się tylko tym, że atomy Br są związane w poprzek pojedynczego wiązania lub podwójnego wiązania, są teraz w szybkiej równowadze ze sobą, jak pokazano poniżej:
| Atomy Br na sąsiadujących atomach C, strukturalny izomer 1 ma atomy Br przez C-C strukturalny izomer 4 ma atomy Br przez C=C |
 strukturalny izomer 1 |
⇋ |  strukturalny izomer 4 |
Według Kekulégo, te dwa izomery strukturalne C6H4Br2 są w tak szybkiej równowadze, że nie mogą być rozdzielone jako dwie oddzielne cząsteczki, więc wydaje się, że istnieją tylko 3 izomery zamiast 4.
Chociaż ta struktura szybkiej równowagi dla benzenu, znana jako struktura Kekulégo, okazała się przydatna, nie wyjaśnia wyjątkowej stabilności (braku reaktywności) pierścienia benzenowego, nie wyjaśnia, dlaczego benzen nie poddaje się łatwo reakcjom addycji, ale można go skłonić do poddania się reakcjom addycji.
Czy rozumiesz to?
Dołącz do AUS-e-TUTE!
Zrób test teraz!
.