Abstract
Objectives
To identify the prevalence of Barrett’s esophagus (BE) in patients with nasopharyngeal reflux (NPR) presenting to a tertiary rhinology practice in 2017, and to assess for any correlation with the presence of symptomatic gastroesophageal reflux disease (GERD).
Metody
Dane demograficzne, samodzielnie zgłaszane objawy oraz istotny wywiad chorobowy z przeszłości zostały zebrane na podstawie standaryzowanego kwestionariusza pobraniowego. Objawy pogrupowano w 3 kategorie: NPR, refluks krtaniowo-gardłowy (LPR) i GERD. Przeprowadzono opisowe i nieparametryczne analizy statystyczne.
Wyniki
Wśród 807 nowych pacjentów widzianych w 2017 roku, 86 (10,7%) zostało skierowanych do gastroenterologii (GI) z objawami związanymi z NPR, w oparciu o istniejące wcześniej wskazania do skierowania. Czterdziestu trzech pacjentów zostało ocenionych przez gastroenterologa, a 25 przeszło EGD z raportem patologicznym dostępnym do przeglądu. BE rozpoznano u 6/25 (24%) pacjentów. Pięciu z tych sześciu pacjentów (83,3%) zgłaszało łagodne objawy GERD lub nie zgłaszało ich wcale. Żadne czynniki związane z pacjentem ani objawy nie były istotnie związane z rozpoznaniem BE.
Wnioski
Te dane dotyczące kolejnych nowych pacjentów sugerują, że przestrzeganie zaleceń dotyczących skierowania na leczenie jest słabe wśród pacjentów z NPR i że częstość występowania BE w tej populacji może być wyższa niż powszechnie zgłaszana wśród pacjentów z GERD. Doświadczenie to wzmacnia wskazania do skierowania na EGD w celu wykluczenia BE i podkreśla znaczenie edukacji pacjentów w celu poprawy przestrzegania zaleceń.
Keywords
Esophageal cancer, Gastroesophageal reflux, Screening, Reflux esophagitis, Laryngopharyngeal reflux, GERD
Introduction
Symptomatic gastroesophageal reflux disease (GERD) is known to increase patients’ risk of developing Barrett’s esophagus (BE). BE jest powszechnie uznawany za stan przedrakowy, w którym ochronny nabłonek płaski błony śluzowej dystalnego odcinka przełyku jest zastępowany przez kolumnowy nabłonek jelitowy. U osób z BE występuje znacznie wyższe ryzyko (szacowane na 30-120 X>) rozwoju gruczolakoraka przełyku (EAC) niż w populacji ogólnej. Podczas gdy rozwój BE był wcześniej podkreślany jako problem u osób z długotrwałym refluksem krtaniowo-gardłowym (LPR), nie jest on opisywany jako szczególny problem u osób, u których dominuje refluks nosowo-gardłowy (NPR) z objawami jamy nosowej i otologicznymi refluksu pozaprzełykowego (EER).
Co ciekawe, BE jest wykrywany u 1-2% wszystkich pacjentów poddawanych ezofagogastroduodenoskopii (EGD). Częstość jej występowania jest znacznie większa u osób z objawową GERD (5-15%) i częściej stwierdza się ją u osób z objawami LPR (18%). O ile czas trwania objawów GERD koreluje z większym prawdopodobieństwem wystąpienia BE, o tyle nie ma zależności między nasileniem objawów GERD a skłonnością do rozwoju BE. Uważa się, że dodatkowe czynniki ryzyka rozwoju BE obejmują genetykę, centralną otyłość, palenie papierosów, obturacyjny bezdech senny (OSA) i zespół metaboliczny .
W 2018 roku pojawiły się dwa obawy związane z pacjentami EER widzianymi w Sinus & Nasal Institute of Florida (SNI), które skłoniły do zainicjowania tego projektu oceny jakości i poprawy (QAI). Po pierwsze, dwóch pacjentów z cichym refluksem zaprzeczyło, że wiedzieli o rozpoznaniu BE potwierdzonym biopsją. Dodatkowo, ci dwaj pacjenci słabo stosowali się do zalecanych środków dietetycznych, zmian stylu życia i leków. Co więcej, nie doceniali oni znaczenia kolejnych EGD dla monitorowania BE. Po drugie, znaczna liczba pacjentów z cichym refluksem, którym zalecono wizytę u gastroenterologa, nie zastosowała się do tego zalecenia.
Celem tego komunikatu jest podzielenie się wynikami naszego programu oceny i poprawy jakości (QAI) w odniesieniu do doświadczenia trzeciorzędowego oddziału rynologii z cichym refluksem i BE. W szczególności, komunikat ten ma na celu zbadanie częstości występowania BE u pacjentów z NPR i określenie odsetka pacjentów, którzy zlekceważyli znaczenie ich skierowania do GI.
Metody
W ramach trwającego programu QAI, wszyscy nowi pacjenci SNI, którzy zostali skierowani do gastroenterologii (GI) w 2017 roku, zostali zidentyfikowani przy użyciu elektronicznego rekordu medycznego (EMR). Kryteria skierowania SNI 2017 do GIare wymienione są w Tabeli 1. Dane demograficzne, samodzielnie zgłaszane objawy, istotna przeszłość medyczna i BMI związane z klinicznym podejrzeniem refluksu pozaprzełykowego zostały zebrane ze standaryzowanego kwestionariusza wejściowego. Zebrane informacje obejmowały stopień nasilenia objawów: przekrwienie błony śluzowej nosa, odbarwiony wyciek z nosa, drenaż pozanosowy (PND), czas trwania PND, objawy alergii wziewnej (zapalenie błony śluzowej nosa i spojówek), uczucie pełności w uszach, klikanie w uszach, chrypka, nieświeży oddech, ślinienie się, krztuszenie się jedzeniem, pogorszenie astmy, kaszel, niestrawność, zgaga, trudności w połykaniu i ból przy połykaniu. Zapisywano również wywiad chorobowy dotyczący OSA i palenia tytoniu w przeszłości. W przypadku osób, u których wykonano EGD, dokonano przeglądu wyników procedury i raportów patologicznych. Raporty histopatologiczne potwierdziły obecność lub brak BE.
Dla celów porównawczych samodzielnie zgłaszane objawy EER, wyekstrahowane ze standardowego kwestionariusza pobraniowego rhinology, zostały pogrupowane na podstawie trzech lokalizacji anatomicznych: 1) jama nosowa/przełyk dla NPR; 2) krtań/przełyk dla LPR; 3) przełyk dla GERD. Objawy NPR to: Przekrwienie nosa, odbarwiony drenaż nosa, drenaż po nosie (PND), uczucie pełności w uszach i klikanie w uszach. LPR składa się z następujących objawów: Chrypka, nieświeży oddech, ślinienie się, krztuszenie się jedzeniem, pogorszenie astmy i kaszel. Objawy GERD składały się z niestrawności, zgagi, trudności w przełykaniu i bólu przy przełykaniu.
Analizę statystyczną przeprowadzono przy użyciu Jamovi Version 0.9 (The jamovi project 2019 https://www.jamovi.org). Do porównania danych ciągłych między dwiema grupami zastosowano test U Manna-Whitneya. Przy porównywaniu danych kategorycznych między dwiema grupami zastosowano dokładny test Fishera.
Populacja &objawy
Komputerowy raport rejestru z naszego oprogramowania EMR zidentyfikował 807 nowych pacjentów widzianych w SNI w roku 2017. Spośród nich, 86 (10,7%) zostało skierowanych do GI w tym samym roku dla jednego lub więcej wskazań wymienionych w Tabeli 1. Spośród tych 86 pacjentów, 48 (55,8%) było kobietami, a średni wiek wynosił 55 (15-83). Sześćdziesięciu jeden pacjentów (70,9%) zostało skierowanych do GI w czasie pierwszej wizyty. Czterdziestu trzech pacjentów (50%) było widzianych przez gastroenterologa. Spośród 86 pacjentów skierowanych do GI, 79 miało wypełnione kwestionariusze z pierwszej wizyty dostępne do wglądu. Objawy występujące u pacjentów skierowanych, pacjentów, u których wykonano EGD i pacjentów z potwierdzoną biopsją BE przedstawiono w Tabeli 2.
Tabela 1: Kryteria SNI dla skierowania do IG. View Table 1
Table 2: Objawy związane z refluksem występujące podczas pierwszej wizyty. Zobacz Tabelę 2
Przynajmniej jeden objaw NPR był obecny u wszystkich 79 pacjentów, którzy wypełnili kwestionariusze. Krople z nosa były najczęstszym objawem, zgłaszanym u 73/79 (92,4%) wszystkich pacjentów skierowanych do gastroenterologii i u 100% pacjentów, u których wykonano EGD. Kapanie z nosa i/lub uczucie pełności/klaskania w uszach występowało u 75/79 (94,9%) wszystkich pacjentów. Przynajmniej jeden objaw LPR występował u 69 pacjentów (87,3%), ale tylko 44 pacjentów (55,7%) miało jeden lub więcej objawów charakterystycznych dla GERD. Nie stwierdzono statystycznej różnicy w występowaniu objawów NPR, LPR lub GERD w trzech kategoriach pacjentów: 1) Osoby skierowane do GI; 2) Osoby, u których wykonano EGD lub 3) Osoby z BE.
W grupie pacjentów z BE, wszyscy mieli objawy NPR, 4 (66,7%) miało prezentujące się objawy LPR i 4 (66,7%) miało prezentujące się objawy GERD. Jednak tylko jeden pacjent z BE miał istotne objawy GERD, a pozostałe były łagodne, bez istotnego wpływu na jakość życia. U pacjentów bez BE 7 (36,8%) miało objawy GERD, a 17 (89,5%) miało objawy LPR. Porównując pacjentów z i bez BE, z i bez refluksowego zapalenia przełyku oraz z i bez zapalenia błony śluzowej żołądka, nie stwierdzono istotnej różnicy między grupami objawów. Jeśli chodzi o występujące objawy, nie było istotnej różnicy między tymi 79 pacjentami a 25 pacjentami, u których wykonano EGD lub 6 pacjentami z BE. Chociaż retrospektywnie nie można było ustalić wskazania do stosowania inhibitora pompy protonowej (IPP) podczas pierwszej wizyty u lekarza nieżytu nosa, 50% pacjentów z BE i 26,3% pacjentów bez BE przyjmowało już IPP.
EGD &Wyniki patologii
EGD wykonano u 25/86 (29,1%). BE potwierdzono u 6/25 (24%) pacjentów (Rycina 1 i Rycina 2), z których jeden miał dysplazję niskiego stopnia. U żadnego z nich nie stwierdzono dysplazji wysokiego stopnia ani złośliwości. Tylko 2/6 pacjentów z BE i 11/19 pacjentów bez BE miało endoskopowe dowody na zapalenie przełyku potwierdzone patologicznie. Innymi słowy, BE nie zawsze było związane z histopatologicznymi dowodami zapalenia przełyku. Jeden z pacjentów, u którego rozpoznano BE, nie był wystarczająco świadomy tego rozpoznania, dopóki raport patologiczny nie został wyszukany przez kierującego na badanie Rhinologa. Zapalenie błony śluzowej żołądka zostało potwierdzone histopatologicznie u 21/25 (84%) pacjentów poddanych EGD. Ośmiu miało aktywne zapalenie żołądka i 13 nieaktywne zapalenie żołądka. Zapalenie błony śluzowej żołądka stwierdzono u wszystkich pacjentów z BE i u 78,9% pacjentów bez BE.
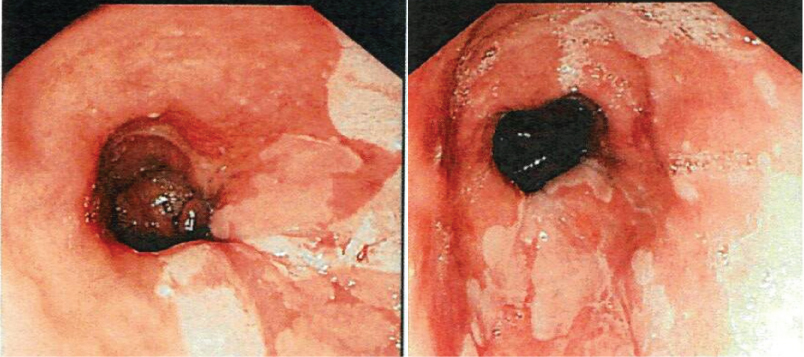 Rycina 1: Obrazy EGD przedstawiające płaty błony śluzowej w kolorze łososiowym rozciągające się do przełyku od połączenia żołądkowo-przełykowego, zgodne z metaplazją jelitową. View Figure 1
Rycina 1: Obrazy EGD przedstawiające płaty błony śluzowej w kolorze łososiowym rozciągające się do przełyku od połączenia żołądkowo-przełykowego, zgodne z metaplazją jelitową. View Figure 1
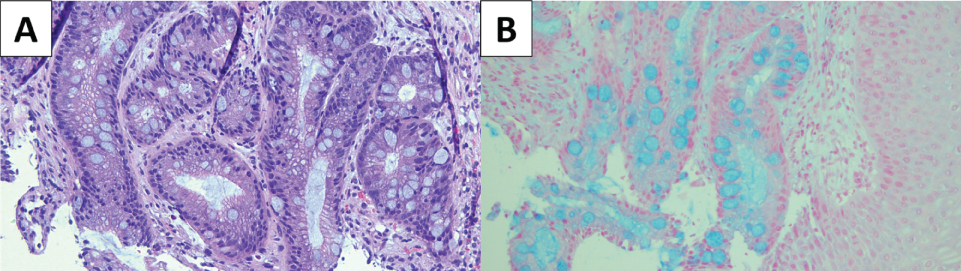 Figura 2: (A) Slajd przełyku Barretta barwiony hematoksyliną &eozyną (H&E); (B) Barwienie błękitem Alciana podkreśla obecność komórek zwojowych, które są związane z metaplastycznym nabłonkiem jelitowym. View Figure 2
Figura 2: (A) Slajd przełyku Barretta barwiony hematoksyliną &eozyną (H&E); (B) Barwienie błękitem Alciana podkreśla obecność komórek zwojowych, które są związane z metaplastycznym nabłonkiem jelitowym. View Figure 2
Żaden z objawów zgłaszanych przez pacjentów nie różnił się istotnie między pacjentami EGD z i bez potwierdzonego biopsją BE.
Dyskusja
Choć rzadki, EAC niesie ze sobą złe rokowanie z szacowaną 5-letnią przeżywalnością na poziomie 17% . Podobnie jak w przypadku wzrostu liczby BE w ciągu ostatnich kilku dekad, w ciągu ostatnich 30-40 lat zaobserwowano dramatyczny wzrost (300-500%) liczby EAC. Ponownie, ryzyko rozwoju EAC wzrasta w przypadku BE od 30 do 125 razy w porównaniu z populacją ogólną. Ogólnie, progresję BE do EAC szacuje się na 0,1-0,3% rocznie.
Wytyczne kliniczne dotyczące diagnostyki i leczenia BE zalecają badania przesiewowe pacjentów z wieloma czynnikami ryzyka. Opublikowane czynniki ryzyka EAC i BE obejmują wiek powyżej 50 lat, płeć męską, rasę białą, otyłość typu truncal, palenie tytoniu w wywiadzie, występowanie BE lub EAC w rodzinie oraz przewlekłe objawy GERD. W naszej małej populacji QAI otyłość, wiek i płeć nie zostały wykryte jako czynniki ryzyka BE. History of tobacco use, OSA, and infrequent or mild heartburn demonstrated a tendency to be risk factors.
If BE is detected, then additional monitoring is implemented periodically in order to diagnose dysplasia or early malignancy. Endoskopowy nadzór nad BE wiąże się z lepszymi wynikami w odniesieniu do śmiertelności EAC. Warto zwrócić uwagę, że 50% pacjentów z BE lub EAC nie zgłasza przewlekłych objawów refluksu. Nie zaleca się jednak przesiewowego badania EGD w populacji ogólnej. Wcześniej zalecano, aby objawy LPR były uwzględnione jako wskazanie do BE i badań przesiewowych w kierunku raka .
EER, lub cichy refluks, jest rozpoznaniem klinicznym, zwykle opartym na prezentacji objawów laryngologicznych, wynikach badania przedmiotowego (w tym nosogardzieli-laryngoskopii) i badaniach zleconych w celu wykluczenia innych wyjaśnień choroby laryngologicznej (np. CT zatok, test alergiczny). Potwierdzenie rozpoznania cichego refluksu jest często trudne do potwierdzenia, gdy pacjent nigdy lub rzadko odczuwa objawy żołądkowo-jelitowe. Niestety, żadne pojedyncze badanie nie jest w stanie wykluczyć istnienia cichego refluksu. W związku z tym proponuje się, aby „brak odpowiedzi na agresywną terapię hamującą wydzielanie kwasu w połączeniu z prawidłowym badaniem pH poza terapią lub badaniem impedancji-pH w trakcie terapii znacząco zmniejsza prawdopodobieństwo, że refluks jest czynnikiem przyczyniającym się do wystąpienia objawów pozaprzełykowych”. Nawet te kroki nie mogą w pełni wyeliminować EER jako wyjaśnienia niewyjaśnionych objawów nosowo-gardłowych, takich jak kapanie z nosa. To doświadczenie QAI wspiera koncepcje, że objawowe NPR, nie tylko LPR i GERD, są związane z BE.
Ponieważ objawy cichego refluksu są zwykle dokuczliwe i nie zagrażają życiu, wielu pacjentów staje się łatwo sfrustrowanych i porzuca opiekę, gdy nie widzą szybkiej odpowiedzi na leczenie. Rozpoznanie cichego refluksu często podważa zaufanie pacjenta do umiejętności diagnostycznych lekarza i planu leczenia. Pacjenci są wtedy niechętni do poddania się inwazyjnym badaniom w celu potwierdzenia diagnozy choroby związanej z refluksem. To może pomóc wyjaśnić ustalenie QAI, że 50% pacjentów nie poddało się ocenie gastroenterologicznej.
Drenaż zatokowy jest tu definiowany jako uczucie dokuczliwego drenażu powstającego w drogach oddechowych nosa i spływającego do gardła. PND jest zwykle przypisywany chorobie zapalnej zatok, ale dane sugerują, że NPR może występować jako forma niealergicznego zapalenia błony śluzowej nosa. W jednym badaniu kontrolowanym placebo, dwa razy dziennie terapia pompą protonową okazała się poprawiać PND wśród pacjentów bez dowodów na zapalenie błony śluzowej nosa i alergie .
To doświadczenie QAI podkreśla potencjalny związek między opornym NPR i BE z lub bez zgagi. Objawy post-nosowe i otologiczne były najczęstszymi objawami wśród osób skierowanych do EGD. Ten projekt QAI sugeruje również, że historia palenia tytoniu i obturacyjny bezdech senny są czynnikami ryzyka rozwoju zapalenia przełyku i/lub BE, jak opisano wcześniej w innym miejscu. Opierając się na 25% częstości występowania BE w tej małej, samodzielnie wybranej populacji, uważamy, że pacjenci z podejrzeniem NPR powinni być objęci zaleceniem wykonania EGD. Ten projekt QAI sugeruje, że konieczne są dalsze badania, zanim będzie można wyciągnąć zdecydowane wnioski.
Wady tego raportu QAI obejmują jego retrospektywny charakter i małą liczebność próby oraz niespójne wskazania do stosowania IPP zarówno u pacjentów z BE, jak i bez BE w EGD. IPP mogły zostać przepisane przez internistę lub otolaryngologa kierującego pacjenta z powodu objawów EER lub też pacjenci mogli samodzielnie leczyć się z powodu objawowej GERD. Niemniej jednak nie zaobserwowano różnicy w stosowaniu IPP między pacjentami z BE i bez BE.
Podsumowanie
Przełyk Barretta zidentyfikowano u 24% samodzielnie wyselekcjonowanych, kolejnych, nowych pacjentów z trzeciorzędową chorobą nosa, u których wykonano EGD. Liczba ta jest znacznie wyższa niż przewidywano na podstawie opublikowanych danych dotyczących GERD i LPR. To doświadczenie QAI wzmacnia wskazania do kierowania pacjentów do gastroenterologii w celu wykonania EGD, aby wykluczyć BE. Czynniki pogarszające, takie jak łagodna zgaga, palenie tytoniu w wywiadzie i OSA, były zbliżone, ale nie osiągnęły istotności statystycznej jako czynniki ryzyka BE. W grupie pacjentów z zapaleniem przełyku istotnie więcej było pacjentów z OSA.
Blisko połowa nowych pacjentów z nieżytem nosa skierowanych do GI nie skorzystała z tego skierowania. Wyjaśnienie znaczenia BE jako czynnika ryzyka EAC może pomóc w motywowaniu pacjentów do stosowania się do zaleceń GI. Programy QAI, takie jak ten, są podstawą poprawy opieki nad pacjentem.
Podziękowania
Chcielibyśmy podziękować zarówno Arthurowi Bermanowi, DO za dostarczenie obrazów endoskopowych, jak i Kernowi Davisowi, MD za dostarczenie obrazów patologicznych.
Funding
Ten projekt nie otrzymał żadnej konkretnej dotacji od jakiejkolwiek agencji finansującej w sektorze publicznym, komercyjnym lub non-profit.
Declaration of Conflicting Interests
Autorzy deklarują brak konfliktów interesów.
- Runge TM, Abrams JA, Shaheen NJ (2015) Epidemiology of Barrett’s esophagus and esophageal adenocarcinoma. Gastroenterol Clin North Am 44: 203-231.
- Reavis KM, Morris CD, Gopal DV, Hunter JG, Jobe BA (2004) Laryngopharyngeal reflux symptoms better predict the presence of esophageal adenocarcinoma than typical gastroesophageal reflux symptoms. Ann Surg 239: 849-856.
- Halum SL, Postma GN, Bates DD, Koufman JA (2006) Incongruence between histologic and endoscopic diagnoses of Barrett’s esophagus using transnasal esophagoscopy. Laryngoscope 116: 303-306.
- Shaheen NJ, Falk GW, Iyer PG, Gerson LB (2016) ACG Clinical Guideline: Diagnosis and Management of Barrett’s Esophagus. Am J Gastroenterol 111: 30-50.
- Hammad TA, Thrift AP, El-Serag HB, Husain NS (2019) Missed Opportunities for Screening and Surveillance of Barrett’s Esophagus in Veterans with Esophageal Adenocarcinoma. Dig Dis Sci 64: 367-372.
- Vaezi MF, Katzka D, Zerbib F (2018) Extraesophageal symptoms and diseases attributed to GERD: Where is the pendulum swinging now? Clin Gastroenterol Hepatol 16: 1018-1029.
- Vaezi MF, Hagaman DD, Slaughter JC, Tanner SB, Duncavage JA, et al. (2010) Proton pump inhibitor therapy improves symptoms in postnasal drainage. Gastroenterology 139: 1887-1893.
Citation
Chislett SP, Kalathia J, Solyar AY, Limjuco AP, Lanza DC (2020) Nasopharyngeal Reflux: A New Indication for Esophagogastroduodenoscopy to Rule Out Barrett’s Esophagus? J Otolaryngol Rhinol 6:093. doi.org/10.23937/2572-4193.1510093
.