Tylakoidy zawierają wiele integralnych i peryferyjnych białek błonowych, a także białka lumenalne. Ostatnie badania proteomiczne frakcji tylakoidów dostarczyły dalszych szczegółów na temat składu białkowego tylakoidów. Dane te zostały podsumowane w kilku bazach danych białek plastydowych, które są dostępne online.
Według tych badań, proteom tylakoidów składa się z co najmniej 335 różnych białek. Spośród nich 89 znajduje się w świetle, 116 to integralne białka błonowe, 62 to białka peryferyjne po stronie zrębu, a 68 to białka peryferyjne po stronie lumenalnej. Dodatkowe niskoobjętościowe białka lumenalne mogą być przewidywane za pomocą metod obliczeniowych. Spośród białek tylakoidów o znanych funkcjach, 42% jest zaangażowanych w fotosyntezę. Kolejne największe grupy funkcjonalne obejmują białka zaangażowane w ukierunkowanie, przetwarzanie i składanie białek (11%), odpowiedź na stres oksydacyjny (9%) i translację (8%).
Integralne białka błonoweEdit
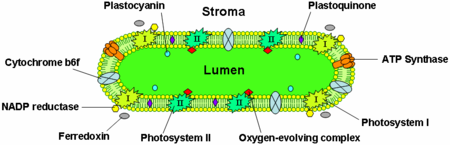
Błony tylakoidów zawierają integralne białka błonowe, które odgrywają ważną rolę w pozyskiwaniu światła i zależnych od światła reakcjach fotosyntezy. W błonie tylakoidów znajdują się cztery główne kompleksy białkowe:
- Fotosystemy I i II
- Kompleks cytochromu b6f
- Syntaza ATP
Fotosystem II znajduje się głównie w tylakoidach grana, podczas gdy fotosystem I i syntaza ATP znajdują się głównie w tylakoidach zrębu i zewnętrznych warstwach grana. Kompleks cytochromu b6f jest równomiernie rozmieszczony w błonach tylakoidów. Ze względu na oddzielną lokalizację obu fotosystemów w systemie błon tylakoidalnych, do przenoszenia elektronów między nimi niezbędne są ruchome nośniki elektronów. Nośnikami tymi są plastochinon i plastocyanina. Plastochinon przenosi elektrony z fotosystemu II do kompleksu cytochromu b6f, podczas gdy plastocyanina przenosi elektrony z kompleksu cytochromu b6f do fotosystemu I.
Łącznie, białka te wykorzystują energię świetlną do napędzania łańcuchów transportu elektronów, które generują potencjał chemiosmotyczny przez błonę tylakoidu i NADPH, produkt końcowej reakcji redoks. Syntaza ATP wykorzystuje potencjał chemiosmotyczny do wytwarzania ATP podczas fotofosforylacji.
FotosystemyEdit
Te fotosystemy są napędzanymi przez światło centrami redoks, z których każde składa się z kompleksu antenowego, który wykorzystuje chlorofile i dodatkowe pigmenty fotosyntetyczne, takie jak karotenoidy i fitobiliproteiny, do zbierania światła o różnych długościach fali. Każdy kompleks antenowy ma od 250 do 400 cząsteczek pigmentu, a energia, którą absorbują jest przenoszona przez rezonansowy transfer energii do wyspecjalizowanego chlorofilu a w centrum reakcji każdego fotosystemu. Kiedy któraś z dwóch cząsteczek chlorofilu a w centrum reakcji absorbuje energię, elektron jest wzbudzany i przenoszony do cząsteczki akceptora elektronów. Fotosystem I zawiera w swoim centrum reakcyjnym parę cząsteczek chlorofilu a, oznaczoną jako P700, która maksymalnie absorbuje światło o długości 700 nm. Fotosystem II zawiera chlorofil P680, który najlepiej absorbuje światło o długości 680 nm (należy pamiętać, że te długości fali odpowiadają głębokiej czerwieni – patrz spektrum widzialne). P jest skrótem od pigmentu, a liczba jest specyficznym pikiem absorpcji w nanometrach dla cząsteczek chlorofilu w każdym centrum reakcji. Jest to zielony pigment obecny w roślinach, który nie jest widoczny dla niewidomych oczu.
Kompleks cytochromu b6fEdit
Kompleks cytochromu b6f jest częścią łańcucha transportu elektronów w tylakoidzie i sprzęga transfer elektronów z pompowaniem protonów do światła tylakoidu. Energetycznie, znajduje się pomiędzy dwoma fotosystemami i przenosi elektrony z fotosystemu II-plastochinonu do plastocyaniny-fotosystemu I.
Syntaza ATPEdit
Tylakoidalna syntaza ATP jest syntazą CF1FO-ATP podobną do mitochondrialnej ATPazy. Jest ona wbudowana w błonę tylakoidu z czę¶ci± CF1 przylegaj±c± do stromy. Tak więc synteza ATP zachodzi po stromalnej stronie tylakoidów, gdzie ATP jest potrzebny do niezależnych od światła reakcji fotosyntezy.
Białka lumenuEdit
Białko transportu elektronów plastocyanina jest obecna w lumenie i przenosi elektrony z kompleksu białkowego cytochromu b6f do fotosystemu I. Podczas gdy plastochinony są rozpuszczalne w lipidach i dlatego przemieszczają się w obrębie błony tylakoidu, plastocyanina przemieszcza się przez światło tylakoidu.
Światło tylakoidów jest również miejscem utleniania wody przez kompleks wydzielający tlen związany ze stroną lumenalną fotosystemu II.
Białka lumenalne mogą być przewidywane obliczeniowo w oparciu o ich sygnały docelowe. W Arabidopsis, spośród przewidywanych białek lumenalnych posiadających sygnał Tat, największe grupy o znanych funkcjach to 19% zaangażowanych w przetwarzanie białek (proteolizę i fałdowanie), 18% w fotosyntezę, 11% w metabolizm i 7% nośniki redoks i obronę.
Ekspresja białekEdit
Chloroplasty posiadają własny genom, który koduje szereg białek tylakoidowych. Jednak w trakcie ewolucji plastydów od ich endosymbiotycznych przodków sinicowych doszło do rozległego transferu genów z genomu chloroplastów do jądra komórkowego. W wyniku tego cztery główne kompleksy białkowe tylakoidów są kodowane częściowo przez genom chloroplastowy, a częściowo przez genom jądrowy. Rośliny wykształciły kilka mechanizmów współregulujących ekspresję różnych podjednostek kodowanych w dwóch różnych organellach, aby zapewnić właściwą stechiometrię i składanie tych kompleksów białkowych. Na przykład, transkrypcja genów jądrowych kodujących części aparatu fotosyntetycznego jest regulowana przez światło. Biogeneza, stabilno¶ć i obrót kompleksów białkowych w tylakoidach regulowane s± przez fosforylację za po¶rednictwem wrażliwych na redoks kinaz w błonach tylakoidów. Tempo translacji białek kodowanych w chloroplaście jest kontrolowane przez obecność lub brak partnerów do montażu (kontrola przez epistazę syntezy). Mechanizm ten polega na ujemnym sprzężeniu zwrotnym poprzez wiązanie nadmiaru białka do 5′ nieulegającego translacji regionu mRNA chloroplastu. Chloroplasty muszą również równoważyć proporcje fotosystemu I i II dla łańcucha przeniesienia elektronów. Stan redoks nośnika elektronów plastochinonu w błonie tylakoidu wpływa bezpośrednio na transkrypcję genów chloroplastowych kodujących białka centrów reakcji fotosystemów, przeciwdziałając w ten sposób zaburzeniom równowagi w łańcuchu przenoszenia elektronów.
Kierowanie białek do tylakoidówEdit
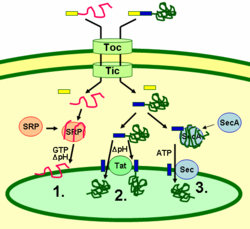
Białka tylakoidów są kierowane do miejsca przeznaczenia za pośrednictwem peptydów sygnałowych i szlaków wydzielniczych typu prokariotycznego wewnątrz chloroplastu. Większość białek tylakoidowych kodowanych przez genom jądrowy rośliny potrzebuje dwóch sygnałów ukierunkowujących dla prawidłowej lokalizacji: N-końcowy peptyd kierujący do chloroplastu (na rysunku zaznaczony kolorem żółtym), a następnie peptyd kierujący do tylakoidu (zaznaczony kolorem niebieskim). Białka są importowane przez translokon kompleksów błony zewnętrznej i wewnętrznej (Toc i Tic). Po wniknięciu do chloroplastu pierwszy peptyd docelowy zostaje rozszczepiony przez proteazę przetwarzaj±c± importowane białka. Powoduje to odsłonięcie drugiego sygnału ukierunkowuj±cego i białko jest eksportowane ze zrębu do tylakoidu w drugim etapie ukierunkowywania. Ten drugi etap wymaga działania składników translokacji białek w tylakoidach i jest zależny od energii. Białka są wprowadzane do błony za pośrednictwem szlaku zależnego od SRP (1), szlaku zależnego od Tat (2) lub spontanicznie przez ich domeny transmembranowe (nie pokazane na rysunku). Białka lumenalne s± eksportowane przez błonę tylakoidu do ¶wiatła za pomoc± szlaku zależnego od Tat (2) lub szlaku zależnego od Sec (3) i uwalniane przez rozszczepienie sygnału kieruj±cego do tylakoidu. Różne szlaki wykorzystują różne sygnały i źródła energii. Szlak Sec (sekrecyjny) wymaga ATP jako źródła energii i składa się z SecA, który wiąże się z importowanym białkiem oraz kompleksu błonowego Sec, który przenosi białko na drugą stronę. Białka z motywem podwójnej argininy w peptydzie sygnałowym tylakoidu są transportowane szlakiem Tat (translokacja podwójnej argininy), który wymaga kompleksu Tat związanego z błoną i gradientu pH jako źródła energii. Niektóre inne białka są wprowadzane do błony za pośrednictwem szlaku SRP (signal recognition particle). SRP chloroplastu może oddziaływać z białkami docelowymi zarówno posttranslacyjnie, jak i współtranslacyjnie, transportując w ten sposób białka importowane, jak również te, które są translokowane wewnątrz chloroplastu. Szlak SRP wymaga GTP i gradientu pH jako źródeł energii. Niektóre białka transmembranowe mogą również spontanicznie wprowadzać się do błony od strony zrębu bez zapotrzebowania na energię.
.