Wiązanie wodorowe Definicja
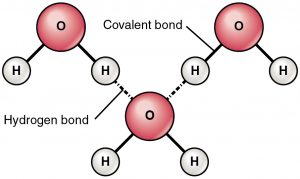
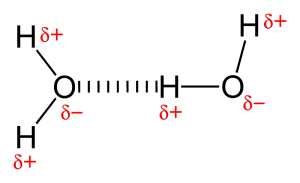
Wiązanie wodorowe jest siłą przyciągającą pomiędzy częściowo dodatnio naładowanym wodorem i częściowo ujemnie naładowanym atomem (tlen i azot). Jest to bardzo słabe wiązanie i siła wiązania wodorowego (5-10 Kcal na wiązanie) jest znacznie mniejsza niż siła wiązania kowalencyjnego. Wiązania wodorowe są zwykle pokazywane jako przerywane linie pomiędzy dwoma atomami. Na przykład wiązanie wodorowe między dwiema cząsteczkami wody jest pokazane poniżej:
Przyczyna wiązania wodorowego
Z powodu obecności bardzo elektroujemnego atomu, takiego jak tlen lub azot, wspólna para elektronów między tlenem i wodorem jest ciągnięta w kierunku bardziej elektroujemnego atomu. Ten nierównomierny rozkład pary elektronowej prowadzi do powstania dwóch częściowych dipoli. Częściowo dodatnio naładowany wodór jest następnie przyciągany przez inne częściowo ujemnie naładowane tlenu lub azotu jest znany jako wiązanie wodorowe.
Typy wiązania wodorowego
Wiązanie wodorowe może wystąpić między dwoma atomami tej samej cząsteczki lub między dwoma atomami różnych cząsteczek. W zależności od tego wiązanie wodorowe jest dwojakiego rodzaju:
- Wewnątrzcząsteczkowe wiązanie wodorowe
- Wewnątrzcząsteczkowe wiązanie wodorowe
Wewnątrzcząsteczkowe wiązanie wodorowe
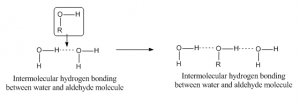
Gdy wiązanie wodorowe zachodzi pomiędzy atomami różnych cząsteczek, wtedy nazywamy je międzycząsteczkowym wiązaniem wodorowym. Dla takiego wiązania jedna cząsteczka powinna mieć częściowo dodatni wodór jako atom akceptorowy, a inna powinna mieć częściowo ujemny lub atom donorowy. Jak na przykład, wiązanie wodorowe między aldehydem i cząsteczki wody podano poniżej:
2. Wewnątrzcząsteczkowe wiązanie wodorowe
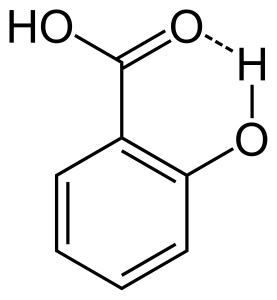
Gdy wiązanie wodorowe występuje między dwoma częściowo naładowane atomy tej samej cząsteczki, że jest nazywany wewnątrzcząsteczkowe wiązanie wodorowe. To występuje, gdy dwie grupy funkcyjne są obecne w tej samej cząsteczce i są one w taki sposób, że mogą przyciągać się nawzajem do tworzenia wiązania wodorowego. Na przykład kwas salicylowy posiada dwie grupy funkcyjne alkohol i kwas karboksylowy. Tutaj wewnątrzcząsteczkowe wiązanie wodorowe występuje między atomem wodoru grupy alkoholowej i atomem tlenu grupy kwasu karboksylowego.
Wpływ wiązania wodorowego
Na temperaturę wrzenia
Oczekuje się, że temperatura wrzenia substancji o tej samej lub podobnej masie cząsteczkowej powinna mieć taką samą lub podobną temperaturę wrzenia. Temperatura wrzenia eteru i alkanu o podobnej masie cząsteczkowej nie są daleko od siebie. Ale temperatura wrzenia alkoholi jest znacznie wyższa niż eter o podobnej masie cząsteczkowej. Można to wyjaśnić w kategoriach wiązań wodorowych. Ze względu na wiązania wodorowe w alkoholu temperatura wrzenia wzrasta. Dodatkowa energia jest potrzebna do przerwania wiązania wodorowego, zanim dojdzie do wrzenia. Ponieważ nie ma wiązań wodorowych alkany i etery mają niską temperaturę wrzenia.

Na rozpuszczalność
Alkohole są rozpuszczalne w wodzie, ale alkany nie. Dzieje się tak dlatego, że międzycząsteczkowe związki z wiązaniami wodorowymi mogą rozpuszczać się w międzycząsteczkowym rozpuszczalniku z wiązaniami wodorowymi. Polarna cząsteczka jak alkohol może wejść do dwóch cząsteczek wody, aby utworzyć wiązanie wodorowe, podczas gdy nie polarna substancja jak alkany nie może. Jednak wraz ze wzrostem łańcucha węglowego w alkoholach rozpuszczalność spada, ponieważ długi łańcuch przeszkadza w tworzeniu wiązania wodorowego.
Podsumowanie
- Wiązanie wodorowe to siła przyciągania między częściowo dodatnio naładowanym wodorem a częściowo ujemnie naładowanym atomem.
- Gdy wiązanie wodorowe występuje między atomami różnych cząsteczek, nazywa się to międzycząsteczkowym wiązaniem wodorowym.
- Gdy wiązanie wodorowe występuje pomiędzy dwoma częściowo naładowanymi atomami tej samej cząsteczki, nazywa się to wewnątrzcząsteczkowym wiązaniem wodorowym.
- Z powodu międzycząsteczkowego wiązania wodorowego temperatura wrzenia związków polarnych jest wyższa niż związków polarnych o tym samym a.
- Z powodu wiązania wodorowego pomiędzy związkiem organicznym a wodą, rozpuszczalność jest możliwa do pewnego stopnia.
.