Evaporação
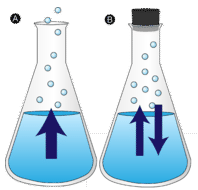
Uma poça de água deixada sem ser perturbada eventualmente desaparece. As moléculas líquidas escapam para a fase gasosa, tornando-se vapor de água. A vaporização é o processo no qual um líquido é convertido em gás. A evaporação é a conversão de um líquido em vapor abaixo da temperatura de ebulição do líquido. Se a água for mantida em um recipiente fechado, as moléculas de vapor de água não têm chance de escapar para o ambiente e, portanto, o nível da água não muda. Como algumas moléculas de água se tornam vapor, um número igual de moléculas de vapor de água se condensam de volta ao estado líquido. Condensação é a mudança de estado de um gás para um líquido.
Para que uma molécula líquida escape para o estado gasoso, a molécula deve ter energia cinética suficiente para superar as forças de atracção intermoleculares no líquido. Lembre-se que uma determinada amostra de líquido terá moléculas com uma ampla gama de energias cinéticas. As moléculas líquidas que têm este certo limiar de energia cinética escapam à superfície e tornam-se vapor. Como resultado, as moléculas líquidas que permanecem agora têm uma energia cinética mais baixa. À medida que a evaporação ocorre, a temperatura do líquido restante diminui. Você tem observado os efeitos do resfriamento evaporativo. Num dia quente, as moléculas de água na tua transpiração absorvem o calor do corpo e evaporam da superfície da tua pele. O processo de evaporação deixa o resfriador de transpiração restante, que por sua vez absorve mais calor do seu corpo.
Um determinado líquido evaporará mais rapidamente quando for aquecido. Isto porque o processo de aquecimento resulta em uma fração maior das moléculas do líquido tendo a energia cinética necessária para escapar da superfície do líquido. A figura abaixo mostra a distribuição da energia cinética das moléculas do líquido a duas temperaturas. Os números de moléculas que têm a energia cinética necessária para evaporar são mostrados na área sombreada sob a curva à direita. O líquido de temperatura mais alta tem mais moléculas capazes de escapar para a fase de vapor do que o líquido de temperatura mais baixa (T_1 à esquerda).

A 29.029 pés (esquerda( 8848: texto (m) direita)), o Monte Everest na cordilheira dos Himalaias na fronteira entre a China e o Nepal é o ponto mais alto da Terra. A sua altitude apresenta muitos problemas práticos para os alpinistas. O conteúdo de oxigênio do ar é muito mais baixo do que ao nível do mar, tornando necessário trazer tanques de oxigênio (embora alguns escaladores tenham atingido o pico sem oxigênio). Um outro problema é o da água fervente para cozinhar os alimentos. Embora a água ferva ao nível do mar, o ponto de ebulição no topo do Monte Evereste é apenas cerca de 70º (70º texto). Esta diferença torna muito difícil conseguir uma chávena de chá decente (o que definitivamente frustrou alguns dos alpinistas britânicos).