Gases Reais e Ideais
Um gás ideal é aquele que segue as leis de gás em todas as condições de temperatura e pressão. Para isso, o gás teria de obedecer completamente à teoria cinético-molecular. As partículas de gás teriam de ocupar volume zero e não teriam de exibir quaisquer forças atraentes umas para as outras. Como nenhuma dessas condições pode ser verdadeira, não existe um gás ideal. Um gás real é um gás que não se comporta de acordo com os pressupostos da teoria cinético-mollecular. Felizmente, nas condições de temperatura e pressão que normalmente se encontram num laboratório, os gases reais tendem a comportar-se muito como gases ideais.
Em que condições, então, os gases se comportam menos idealmente? Quando um gás é colocado sob alta pressão, suas moléculas são forçadas a se aproximar mais à medida que o espaço vazio entre as partículas é diminuído. Uma diminuição do espaço vazio significa que a suposição de que o volume das próprias partículas é insignificante é menos válida. Quando um gás é resfriado, a diminuição da energia cinética das partículas faz com que elas desacelerem. Se as partículas estão se movendo a velocidades mais lentas, as forças atrativas entre elas são mais proeminentes. Outra maneira de ver é que o resfriamento contínuo do gás acabará por transformá-lo em um líquido e um líquido certamente não é mais um gás ideal (veja nitrogênio líquido na figura abaixo). Em resumo, um gás real é mais desviado de um gás ideal a baixas temperaturas e altas pressões. Os gases são mais ideais a altas temperaturas e baixas pressões.

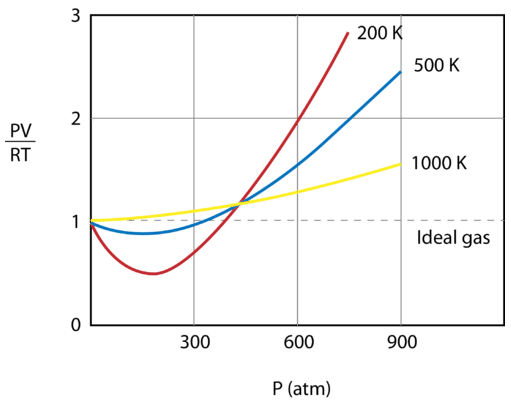
A figura abaixo mostra um gráfico do gás a três temperaturas diferentes – (200: texto), (500: texto), e 1000: \texto. Um gás ideal teria um valor de 1 para essa relação em todas as temperaturas e pressões e o gráfico seria simplesmente uma linha horizontal. Como pode ser visto, ocorrem desvios de um gás ideal. Quando a pressão começa a subir, as forças atrativas fazem com que o volume do gás seja menor do que o esperado e o valor de {PVFrac{RT}} cai abaixo de 1. O aumento contínuo da pressão faz com que o volume das partículas se torne significativo e o valor do gás a 1. Note que a magnitude dos desvios da idealidade é maior para o gás a 200 (200: texto (K)) e menor para o gás a 1000 (K).
A idealidade de um gás também depende da força e do tipo de forças atrativas intermoleculares que existem entre as partículas. Os gases cujas forças de atracção são fracas são mais ideais do que aqueles com forças de atracção fortes. À mesma temperatura e pressão, o néon é mais ideal do que o vapor de água porque os átomos do néon são atraídos apenas por forças de dispersão fracas, enquanto as moléculas do vapor de água são atraídas por ligações de hidrogênio relativamente mais fortes. O hélio é um gás mais ideal do que o néon porque seu menor número de elétrons significa que as forças de dispersão do hélio são ainda mais fracas do que as do néon.